Цели урока:
Образовательная:
актуализировать и обобщить знания учащихся о сере в свете трех форм существования этого химического элемента: в форме атомов и простых веществ, также рассмотреть ее аллотропные модификации;
физические свойства и химические в свете окислительно-восстановительных реакций.
Развивающая:
развить навыки составления уравнений химических реакций;
логическое мышление и память учащихся;
совершенствовать умения доказывать, сравнивать.
Воспитательная:
установление межпредметных связей;
повышение интереса к предмету;
воспитание внимательности, аккуратности при написании уравнений реакций;
способствовать воспитанию экологической культуры учащихся, стремлению соблюдать технику безопасности.
Ход урока.
I. Организационный момент.
Сегодня на уроке мы обобщим знания о строении сере и узнаем много нового о ее свойствах, применении и местонахождении.
II. Проверка изученного материала (экспресс-опрос)
Какое строение имеет кислород?
степень окисления в соединениях: -2, реже +1, +2/.
Когда и кем открыт был кислород? /Первые упоминания о кислороде датируются 8 в., открытие зафиксировано в 18 в. К. Шеееле и Дж. Пристли/.
Назовите основные физические и химические свойства кислорода. /Газ, БЦ, БВ, БЗ, ? = 1, 43 г/л; tпл=-218, 7°; tкип=-183°/.
Как получают кислород в промышленности и в лаборатории? /Из жидкого воздуха (методом фракционной дистилляции), электролитическим разложением воды/.
Какие аллотропные модификации кислорода вам известны? /Кислород - О2 и озон - О3/.
Какова роль озонового слоя для жизни на Земле? /Защита от космического ультрафиолетового излучения/.
Где применяется кислород? /В металлургии, химической промышленности, медицине, в авиации, в ракетно-космической технике, при сварке и резке металлов, и т. д. /.
III. Объяснение нового материала.
Актуализация знаний

Тема сегодняшнего урока "Сера, ее физические и химические свойства".
Эпиграфом к уроку служат такие строки:
Немало сера знаменита,
И в древности ее Гомер воспел,
С ней много тысяч лет прожито,
И человек в ней пользу разглядел.
Мы с вами познакомимся с историей открытия серы. Сера известна человеку довольно давно и не сохранились сведения о ее первооткрывателе
В природе сера встречается очень часто, она входит в состав многих органических и минеральных веществ, а также в самородном виде. Обратите внимание на следующие слайды
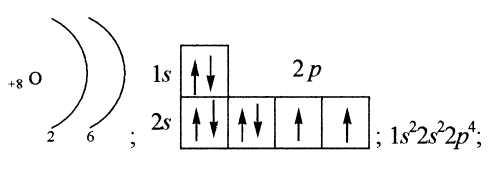
Давайте вспомним, что мы уже знаем о сере: ее характеристику по положению в ПСХЭ Д. И. Менделеева и строение атома /Знак S, произносится "эс", № 16, Ar(S) =32, 3-ий период (малый), 6-ая группа, главная подгруппа; ядро атома серы состоит из 16 протонов и 16 нейтронов; 16 электронов распределены по 3-м уровням, на последнем энергетическом уровне - 6 электронов/.
Посмотрите на следующий слайд
Запишите строение атома серы, ее электронную формулу и характерные степени окисления.
Рассмотрим физические и химические свойства серы.
Одно из особенных физических свойств серы - флотация, способность мелкого порошка серы всплывать, тогда, как ее крупные кристаллы тонут в воде. Дело в том, что сера не смачивается водой, и ее частички держатся на поверхности воды за счет прилипших к ним мелких пузырьков воздуха. Это свойство используют при отделении самородной серы от примесей. Руду размалывают, заливают водой, а снизу продувают воздухом, сера всплывает, а примеси остаются на дне.
Приступим к изучению химических свойств серы. Мы уже достаточно долго изучаем химию и можем назвать некоторые химические свойства серы, исходя из её строения и положения в таблице, а также на основании знаний, полученных вами ранее.
К какому классу веществ относится сера? /Сера относится к неметаллам/.
Какие свойства и какую степень окисления она будет проявлять при реакциях с металлами? / Сера с металлами проявляет окислительные свойства и степень окисления -2/.
А в реакциях с неметаллами? /С менее электроотрицательными неметаллами - окислительные свойства, при этом степень окисления -2, однако с более электроотрицательными - восстановительные свойства и степени окисления +2, +4, +6/.
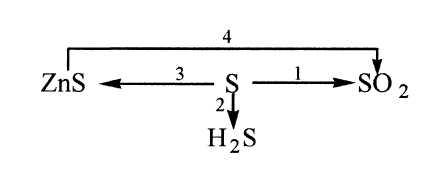
Запишите уравнения и дайте названия полученных продуктов реакций, укажите вещества, с которыми сера ни при каких условиях не вступает в реакции. Обратите внимание на реакцию демеркуризации, она применяется при нейтрализации пролитой ртути.
Очень интересны реакции серы с водородом и кислородом. Необходимо соблюдать условия для ее взаимодействия.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Конспект урока по химии «Сера и ее соединения» (31.85 КB)
Конспект урока по химии «Сера и ее соединения» (31.85 КB)
 1
1 2746
2746 572
572 Нравится
0
Нравится
0


