Конспект учебного занятия по теме «Типы химической связи. Ковалентная связь»
Предмет Химия
Тема урока: Ковалентная связь
Тип урока: Освоение новых знаний.
Цели:
-образовательная: раскрыть сущность образования химической связи между атомами, сформировать понятие о ковалентной связи.
-развивающая: формировать умение записывать схемы образования ковалентной связи, продолжить развитие умений анализировать, выделять главное в изучаемом учебном материале, делать выводы;
-воспитательная: воспитывать интерес к предмету, самостоятельность, умение работать в коллективе.
Планируемый результат:
1. Предметные УУД: конкретизировать понятие «химическая связь», ознакомить учащихся понятием «ковалентная связь», научиться записывать схемы образования ковалентной химической связи;
2. МетапредметныеУУД:
- познавательные УУД: давать определение понятиям, обобщать понятия, осуществлять сравнение и классификацию; строить логические рассуждения, устанавливать причинно-следственные связи, создавать обобщения, делать выводы, понимать, обобщать информацию, представленную в рисунках , схемах и таблицах.
-регулятивные УУД: планировать учебную деятельность в соответствии с учебным заданием, осуществлять само- и взаимоконтроль и коррекцию своей деятельности в процессе достижения результата .
-коммуникативные УУД: организовывать учебное сотрудничество и совместную деятельность с учителем и с одноклассниками, устанавливать рабочие отношения в группе, планировать общие способы работы, строить понятные для собеседника речевые высказывания, уметь слушать собеседника, адекватно и осознанно использовать устную и письменную речь, формировать опыт взаимодействия в условиях групповой работы.
3. Личностные УУД: понимать единство естественнонаучной картины мира и значимость естественнонаучных знаний для решения практических задач в повседневной жизни, уметь управлять своей познавательной деятельностью, самоконтроль и самооценка.
Формы работы: словесные, групповые.
Оборудование:
периодическая система химических элементов Д.И.Менделеева;
учебник;
таблицы «Механизмы образования ковалентной химической связи», презентация
ХОД УРОКА:
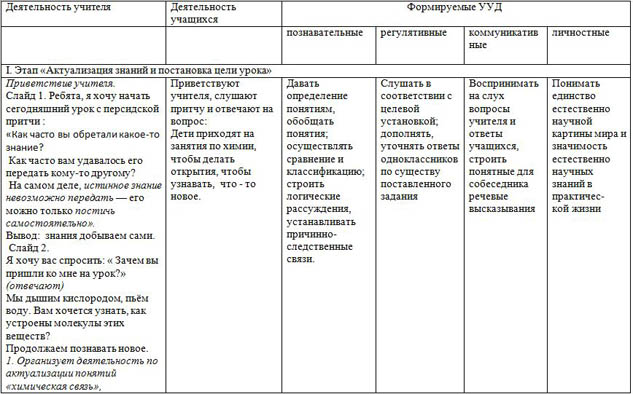
Деятельность учителя
Деятельность учащихся
Формируемые УУД
познавательные
регулятивные
коммуникатив
ные
личностные
I. Этап «Актуализация знаний и постановка цели урока»
Приветствие учителя.
Слайд 1. Ребята, я хочу начать сегодняшний урок с персидской притчи :
«Как часто вы обретали какое-то знание?
Как часто вам удавалось его передать кому-то другому?
На самом деле, истинное знание невозможно передать — его можно только постичь самостоятельно».
Вывод: знания добываем сами.
Слайд 2.
Я хочу вас спросить: « Зачем вы пришли ко мне на урок?» (отвечают)
Мы дышим кислородом, пьём воду. Вам хочется узнать, как устроены молекулы этих веществ?
Продолжаем познавать новое.
1. Организует деятельность по актуализации понятий «химическая связь», «валентность», «ковалентная связь.
Слайд 3.
Учитель спрашивает: Ребята, а кто помнит, что такое атом?
Из чего состоит атом?
Какие вещества относятся к простым, а какие к сложным ?
Некоторые вещества существуют в виде молекул, которые состоят из атомов. Слайд 4.
Между ними возникает химическая связь.
-Что такое химическая связь?
-Что такое валентность?
Определите валентность: HCl, H2O, CH4.
Приветствуют учителя, слушают притчу и отвечают на вопрос:
Дети приходят на занятия по химии, чтобы делать открытия, чтобы узнавать, что - то новое.
Вспоминают изученный ранее материал. Слушают вопросы учителя, во фронтальном режиме отвечают на вопросы, контролируют правильность ответов учащихся. Ответы:
- Атом - электронейтральная и химически неделимая частица, состоящая из положительно заряженного ядра и движущихся вокруг него отрицательно заряженных электронов;
- Атом состоит из протонов, нейтронов и электронов.
Простые вещества образованы атомами одного химического элемента, а сложные атомами разных химических элементов.
химическая связь - это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
валентность-способность атома элемента образовывать разное число химических связей друг с другом.
Давать определение понятиям, обобщать понятия; осуществлять сравнение и классификацию; строить логические рассуждения, устанавливать причинно-следственные связи.
Слушать в соответствии с целевой установкой; дополнять, уточнять ответы одноклассников по существу поставленного задания
Воспринимать на слух вопросы учителя и ответы учащихся, строить понятные для собеседника речевые высказывания
Понимать единство естественно
научной картины мира и значимость естественно
научных знаний в практичес-
кой жизни
2. Создает проблемную ситуацию:
Слайд 5.
На доске: О2, Н2,Н2О, НCl, H3N
«Как вы думаете, ребята, каким образом атомы удерживаются друг возле друга в молекулах простых и сложных веществ?»
Слайд 1.
Прежде чем перейти к рассмотрению новой темы, давайте вспомним еще раз, а что же такое химическая связь?
Какие типы химической связи вам известны?
Правильно. Кто озвучит тему сегодняшнего урока?
Слайд 6.
Дети вступают в диалог с учителем, высказывают свои предположения о связи между атомами.
Отвечают: химическая связь - это такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы
Ковалентная и ионная.
Пользуясь учебником, называют тему «Ковалентная химическая связь», записывают ее в рабочие тетради.
Осуществлять самоконтроль процесса и результата выполнения задания
3.Учитель совместно с учащимися формулируют цели урока.
Слайд 7.
В процессе диалога обсуждают цели:
сформировать понятие о ковалентной связи,
механизме её образования.
Устанавливают причинно-следственные связи.
Постановка цели и анализирование условий достижения цели.
Коллектив
ное обсуждение проблемы.
II. Этап «Изучение нового материала»
1. Побуждает учащихся к теоретическому объяснению фактов. Стимулирует активное участие всех детей в поисковой деятельности:
Слайд 8.
Сегодня на уроке нам нужно подумать над вопросом – почему атомы вступают в химическую связь?
Все ли валентные электроны будут участвуют в образовании химической связи?
Слайд 9.
-Как определяется число валентных электронов и неспаренных электронов?
Слайд 4.
Обнаруживают закономерности, обобщают результаты наблюдения, составляют план действий – алгоритм.
ответ:
только неспаренные
Фиксируют результаты, устанавливают причинно-следственные связи.
Принимают и сохраняют учебную задачу
строят логические рассуждения.
Осуществляют учебное сотрудничество с учителем и сверстниками.
Строят монологичес-
кое высказывание, используют устную и письменную речь.
2. Организует работу в группах, предлагает по ходу работы составить краткий план – конспект, консультирует работу учащихся.
Слайд 10.
Дети делятся на группы по 4 человека, обсуждают в группах варианты решения учебной задачи, обосновывают выбор общего решения или несогласие с мнением других.
Работая с текстом учебника стр 48-49 §16 учащиеся узнают как определить число неспаренных электронов и заполняют таблицу
| Группа | Валентные | Неспар енные |
| 5 | 5 | 3 |
| 7 | 7 | 1 |
| 6 | 6 | 2 |
составляют план – конспект и делают пометки, если что-то не понятно.
Осуществляют поиск информации с использованием ПСХЭ и текста параграфа 16, делают выводы и умозаключения.
Дополняют, уточняют ответы одноклассников по существу поставленного задания.
Корректно ведут диалог, участвуют в дискуссии.
3. На первичном этапе осмысления учитель контролирует усвоение новых понятий:
- предлагает определить, сколько неспаренных электронов у атомов IV, V, VI , VII группы (несколько примеров)?
Слайд 11.
Слайд 12
- Составить электронные формулы: J2, H2, N2, HF.
Взаимопроверка.
Оцените себя. Есть ребята, которые не справились с этим заданием?
-дать определение ковалентной связи;
Слайд 13.
| гр | IV | V | VI | VII |
| Чис.неспар. элек. |
4 |
5 |
6 |
7 |
Проводят взаимопроверку, оценивают друг друга.
Связь, образованная между двумя неметаллами, называется ковалентной. Она осуществляется за счет образования общих электронных пар между двумя атомами неметаллов. (Например: H2, HCl, H2O).
Анализ, синтез, сравнение информации. Извлечение из текста необходимой информации.
Выполнение пробного учебного действия. Фиксирование индивидуального затруднения в пробном действии.
Учет разных мнений, координирование разных позиций в сотрудничест-
ве.
Осознание ответственнос-
ти за общее дело.
4. Учитель предлагает вниманию учащихся алгоритм составления схемы
образования ковалентной связи (на примере молекулы Cl2 ).
Слайд14.
1.Определить валентные электроны .
2.Определить количество неспаренных электронов
2. Валентные электроны каждого атома обозначить точками вокруг символа элемента. В атоме хлора один электрон находится в неспаренном состоянии.
Cl
Сколько электронов не хватает атому хлора до завершения внешнего электронного слоя ?
Учитель объясняет поэтому при сближении двух атомов хлора каждый из них предоставляет по одному неспаренному электрону на образование общей электронной пары, т.е. образуется ковалентная связь
3.Показать взаимодействие атомов,
Cl Cl
Электронная формула молекулы.
Объясняет , что если в формуле вещества электронную пару изобразить черточкой , то получится структурная формула вещества.
Слайд15.
Пользуясь этим алгоритмом, работая в группах, попробуем составить cхемы образования ковалентных связей в молекулах кислорода и азота.
Вводит понятие одинарная, двойная, тройная связь.
Вопрос детям : чем определяется количество связей между атомами в молекуле?
Слайд 16.
4.Учитель ставит задачу. Мы сейчас рассмотрели случай, когда образуется молекула простого вещества. Но вокруг нас множество веществ сложного строения. Как в этом случае происходит образование связи?
Попробуйте самостоятельно изобразить схему образования связи в молекуле хлороводорода HCl и объясните , что произошло с электронными слоями у водорода и хлора в результате образования ковалентной связи.
Слайд 17.
Дети определяют , что их 7.
Дети определяют , что -1
Дети записывают алгоритм в тетрадь и составляют подобные задания. После обсуждают и дискутируют.
Дети определяют , что
до завершения внешнего электронного слоя атому хлора не хватает одного электрона.
Дети, работая в группах
составляют схемы , сталкиваются с проблемой : у кислорода два неспаренных электрона, а у азота три.
Ответ: определяются числом электронов недостающих до завершения электронного слоя атома.
Составляют схему строения.
Объясняют, что у атома водорода появился завершенный двухэлектронный слой, а у атома хлора завершенный восьмиэлектронный слой.
III. РЕФЛЕКСИЯ.
Слайд18.
1.Организует обсуждение результатов:
Какую задачу ставили?
Чем занимались на уроке?
Какие сложности возникли?
Как оцениваете свою работу?
Работу класса в целом?
Трудно делать какие либо открытия. Но это интересно, приятно, так как ваши открытия – это ваши победы, а из этих маленьких побед складываются большие открытия. Вы уже знаете, как устроена молекула кислорода, молекула воды, на следующем уроке расширим понятие ковалентной связи и узнаем какие типы ковалентной связи существуют.
Слайд 19.
Предлагаются задания для закрепления.
Составьте электронную схему строения атома серы. Подчеркните валентные электроны и обозначьте их точками вокруг символа элемента. Укажите, сколько электронов атома серы могут участвовать в образовании связей с атомами водорода. Какой тип связи при этом образуется?
-Обобщают результаты своей деятельности по достижению цели.
Парная работа с последующим комментированием
-Выстраивание причинно- следственных связей.
-Осуществление сравнения обобщения и классификации.
-Контроль и оценка процесса и результатов деятельности.
- Слушают, задают вопросы на понимание и уточнение.
-Участвуют в обсуждении
-Выражают собственное мнение о работе и полученном результате.
-Монологическая, диалогическая речь.
- Контроль, коррекция, оценка действий партнера.
- Умение участво-
вать в обсужде-
нии проблемы.
-Умение выражать свои мысли.
Анализируют правильность выполненных действий и уровень усвоения.
- Развитие способности к волевому усилию.
Осознание качества и уровня усвоения
IV. ДОМАШНЕЕ ЗАДАНИЕ
| Подводит итог урока, отмечает наиболее активных учащихся, выставляет отметки по результатам работы на уроке. Слайд 20. Организует объяснение выполнения домашнего задания: 1. § 16 учебника. 2. Ответить на вопросы после текста параграфа. 3. Выполнить задания на стр.54 № 1,2,3 (по выбору учащегося) | Слушают учителя.
Записывают домашнее задание |
| Адекватно воспринимать оценку учителя
|
|
|

 Получите свидетельство
Получите свидетельство Вход
Вход












 Конспект учебного занятия по химии «Типы химической связи. Ковалентная связь» (37.09 КB)
Конспект учебного занятия по химии «Типы химической связи. Ковалентная связь» (37.09 КB)
 0
0 967
967 78
78 Нравится
0
Нравится
0


