
ФОСФОР.
ЕГО СТРОЕНИЕ, СВОЙСТВА, ПРИМЕНЕНИЕ. СОЕДИНЕНИЯ ФОСФОРА

Фосфор открыт гамбургским алхимиком Хеннигом Брандом в 1669 году
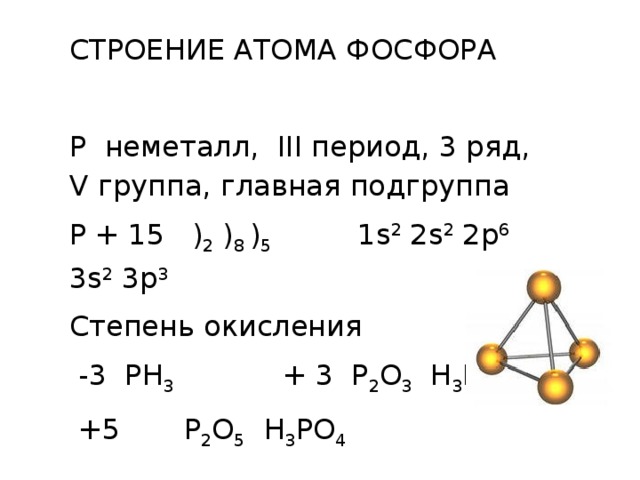
СТРОЕНИЕ АТОМА ФОСФОРА
Р неметалл, III период, 3 ряд, V группа, главная подгруппа
Р + 15 ) 2 ) 8 ) 5 1s 2 2s 2 2p 6 3s 2 3p 3
Степень окисления
-3 PH 3 + 3 P 2 O 3 H 3 PO 3
+5 P 2 O 5 H 3 PO 4

НАХОЖДЕНИЕ В ПРИРОДЕ
В свободном виде не встречается, из-за высокой химической активности.
Входит в состав более 200 минералов. Важнейшие: фосфориты и аппатиты.
Организм человека содержит до 1,5 кг

АЛЛОТРОПНЫЕ ВИДОИЗМЕНЕНИЯ
БЕЛЫЙ ФОСФОР- кристаллическое вещество , ρ – 1,8 г/см3, в воде не растворяется, бесцветен с желтоватым оттенком, в темноте светится, сильный яд. Самовозгорается на воздухе. Химически активен.
КРАСНЫЙ ФОСФОР – кристаллический порошок красного цвета, без запаха, не ядовит, ρ = 2,3 г/см3, в воде не растворяется, не светится, ṭ воспламенения 260 С о химически инертен.
ЧЕРНЫЙ ФОСФОР – похож на графит, образуется из белого при ṭ 200 С о ρ = 2,7 г/см 3 полупроводник.


ХИМИЧЕСКИЕ СВОЙСТВА
С кислородом 4 P + 5O 2 = 2P 2 O 5
C водородом 2 P + 3H 2 = 2PH 3
C металлами
3Ca + 2P = Ca 3 P 2
5Ca + 2P = Ca 5 P 2
C неметаллами
2P + 5CI 2 = 2 PCI 5
2P + 5S = P 2 S 5

СПОСОБЫ ПОЛУЧЕНИЯ
Ca 3 (PO 4 ) 2 + 5C + 3SiO 2 = 3 CaSiO 3 + 2P + 5CO
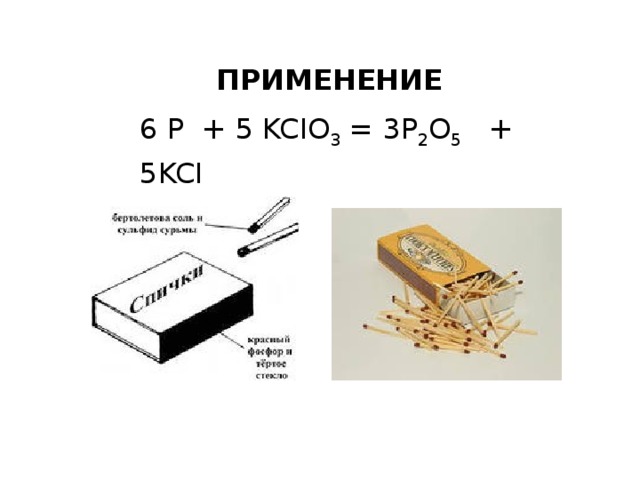
ПРИМЕНЕНИЕ
6 P + 5 KCIO 3 = 3P 2 O 5 + 5KCI

ФОСФИН
Ядовитый газ, самовоспламеняется.
PH 3 + O 2 = H 3 PO 4
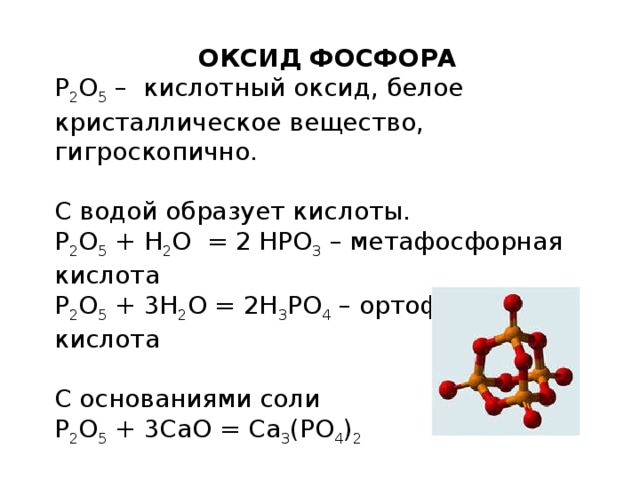
ОКСИД ФОСФОРА
P 2 O 5 – кислотный оксид, белое кристаллическое вещество, гигроскопично.
С водой образует кислоты.
P 2 O 5 + H 2 O = 2 HPO 3 – метафосфорная кислота
P 2 O 5 + 3H 2 O = 2H 3 PO 4 – ортофосфорная кислота
С основаниями соли
P 2 O 5 + 3CaO = Ca 3 (PO 4 ) 2
С основаниями
P 2 O 5 + 6 NaOH = 2Na 3 PO 4 + 3 H 2 O

ФОСФОРНАЯ КИСЛОТА
Получение
P 2 O 5 + 3H 2 O = 2H 3 PO 4
Ca 3 (PO 4 ) 2 + 3H 2 SO 4 = 3 CaSO 4 + 2H 3 PO 4
Диссоциирует ступенчато образуя соли
H 3 PO 4 = H + + H 2 PO 4 - дигидрофосфат
NaH 2 PO 4 Ca(HPO 4 ) 2
H 2 PO 4 - = H + + HPO4 2- гидрофосфат
Na 2 HPO 4 CaHPO 4
HPO 4 2- = H + + PO 4 3- фосфат
Na 3 PO 4 Ca 3 (PO 4 ) 2

Качественная реакция на фосфат – соль серебра
3AgNO 3 + H 3 PO 4 = AgPO 4 + HNO 3

ПРИМЕНЕНИЕ
- производство спичек, удобрений, топливо, взрывчатых веществ, умягчителей воды

 Получите свидетельство
Получите свидетельство Вход
Вход











 Фосфор и его соединения. (1.69 MB)
Фосфор и его соединения. (1.69 MB)
 0
0 2025
2025 141
141 Нравится
0
Нравится
0







