
Электрический ток в жидкостях
Урок изучения нового материала
.

Домашнее задание
- § 113 (учебник физики 10 класс, Г.Я.Мякишев, Б.Б.Буховцев, Н.Н.Соцкий, М. Просвещение, 2016)
- ЕГЭ с. 379 устно
- Задачи для самостоятельного решения № 8, 9 с. 388 решить

По электрическим свойствам все жидкости можно разделить на 2 группы
ПРОВОДЯЩИЕ
НЕПРОВОДЯЩИЕ
Содержащие свободные заряженные частицы - электролиты
Не содержащие свободные заряженные частицы - неэлектролиты
К ним относятся дистиллированная вода, спирт, минеральное масло, растворы сахара, спирта, глюкозы
К ним относятся водные растворы и расплавы солей, кислот, оснований
Проводимость разных веществ

Электролитическая диссоциация
Na Cl
NaCl Na + + Cl -
поваренная соль
При диссоциации ионы металлов и водорода всегда заряжены положительно, а ионы кислотных радикалов и группы ОН - отрицательно
Cl -
Na +
Электролитической диссоциацией называется распад нейтральных молекул вещества в растворителе на + и - ионы

Электролитическая диссоциация
Электролиты обладают ионной проводимостью.
Степень диссоциации – отношение числа молекул, диссоциировавших на ионы, к общему количеству молекул данного вещества.
Рекомбинация – процесс объединения ионов разных знаков в нейтральные молекулы.
В установившемся режиме между процессами ионизации и рекомбинации сохраняется динамическое равновесие .
Интенсивность электролитической диссоциации зависит:
- 1.От температуры раствора.
- 2.От концентрации раствора.
- 3.От рода раствора (его диэлектрической проницаемости)
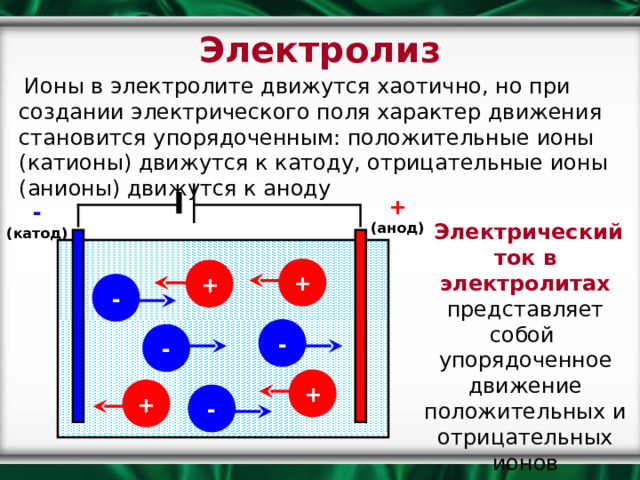
Электролиз
Ионы в электролите движутся хаотично, но при создании электрического поля характер движения становится упорядоченным: положительные ионы (катионы) движутся к катоду, отрицательные ионы (анионы) движутся к аноду
+ (анод)
- (катод)
Электрический ток в электролитах представляет собой упорядоченное движение положительных и отрицательных ионов
+
+
-
-
-
+
+
-

Электролиз
Рассмотрим, что происходит, когда ионы достигают электродов (на примере С uCl 2 )
CuCl 2 Cu 2 + + 2 Cl -
На катоде:
Положительные ионы меди, подходя к катоду, получают недостающий электрон, восстанавливаясь до металлического натрия
- (катод)
Катион
восстановительная
реакция
Cu 2 + + 2 е Cu 0
+
В процессе протекания тока через электролит на катоде происходит оседание слоя меди – электролиз раствора С uCl 2
Cu 2 +
+
Cu 2 +
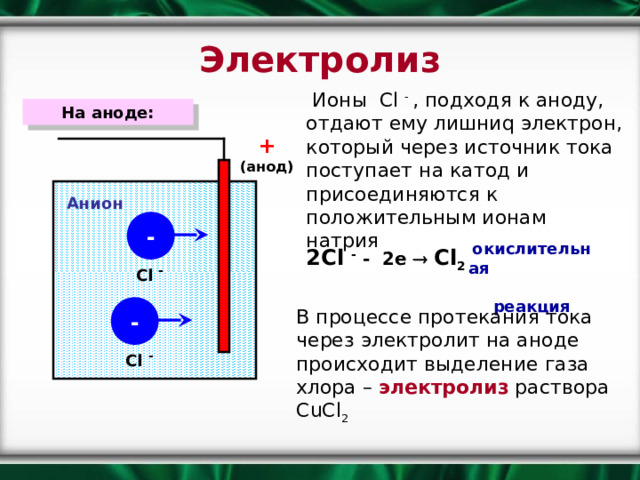
Электролиз
Ионы С l - , подходя к аноду, отдают ему лишни q электрон, который через источник тока поступает на катод и присоединяются к положительным ионам натрия
На аноде:
+ (анод)
Анион
-
окислительная реакция
2Cl - - 2 е Cl 2
Cl -
-
В процессе протекания тока через электролит на аноде происходит выделение газа хлора – электролиз раствора С uCl 2
Cl -

Электролиз
- При ионной проводимости прохождение тока связано с переносом вещества.
- Выделение вещества на электродах вследствие окислительно – восстановительных реакций при прохождении тока через электролит называется электролизом
Явление электролиза было открыто в 1800 г английскими физиками Вильямом Никольсом и Антони Карлейлем .
У.Никольс
А.Карлейль

Закон Ома для электролитов
- Закон Ома справедлив при неизменной концентрации раствора и температуре.
- Сопротивление растворов электролитов
уменьшается с повышением температуры (При t возрастает степень диссоциации, то есть возрастает концентрация ионов. Сила тока в электролите возрастает, сопротивление уменьшается )
R
Сопротивление
растворов электролитов
t

Законы электролиза
Этот закон был открыт опытным путем в 1833 году английским ученым Майклом Фарадеем.
Закон Фарадея
Масса вещества, выделившегося на электроде, при прохождении тока пропорциональна силе тока и времени
1791 - 1867
К – электрохимический эквивалент вещества

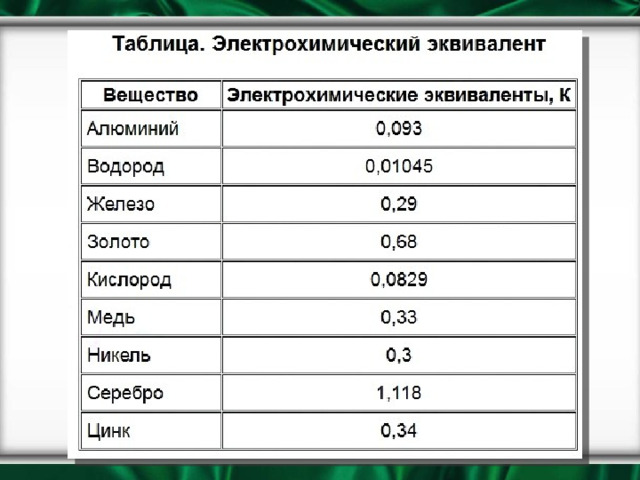
Электрохимический эквивалент вещества
- Электрохимический эквивалент вещества зависит от рода вещества (от молярной массы вещества «М» и валентности « n »)
- Физический смысл k – численно равен массе вещества, выделившегося на электроде при прохождении через электролит заряда в 1 Кл.
- Физический смысл k – численно равен отношению массы иона к его заряду

Определение заряда электрона с помощью электролиза
- Зная массу выделившегося вещества при прохождении заряда, молярную массу, валентность атомов и постоянную Авогадро можно найти значение модуля заряда электрона.
- е=1,6 · 10 -19 Кл

Постоянная Фарадея
F = 9,65•10 4 Кл/моль
- Физический смысл: F – численно равна заряду, который надо пропустить через раствор электролита, чтобы выделить на электроде 1 моль одновалентного вещества.

Применение электролиза
- Гальваностегия – декоративное или антикоррозийное покрытие металлических изделий тонким слоем другого металла (никелирование, хромирование, омеднение, золочение, серебрение)


Применение электролиза
- Гальванопластика – электролитическое изготовление металлических копий, рельефных предметов
- Точность копирования формы предмета очень высокая, т.к. процесс идет на ионном (молекулярном) уровне


Применение электролиза
- Гальванотехника - это отрасль прикладной электрохимии.
- Основателем гальванотехники и ее широчайшего применения является Борис Семенович Якоби , который в 1836 году изобрел гальванопластику.
(1801 – 1874)

Применение электролиза
- Электрометаллургия – получение чистых металлов ( Al , Na , Mg , Be ) при электролизе расплавленных руд


Применение электролиза
- Рафинирование металлов – очистка металлов от примесей с помощью электролиза, когда неочищенный металл является анодом, а на катоде оседает очищенный.
При плотности тока 0,3 А/дм 2 процесс идет несколько дней


Применение электролиза
- Получение оксидных защитных пленок на металлах (анодирование);
- Электрохимическая обработка поверхности металлического изделия (полировка);
- Электрохимическое окрашивание металлов (например, меди, латуни, цинка, хрома и др.);
- Очистка воды - удаление из нее растворимых примесей. В результате получается так называемая мягкая вода (по своим свойствам приближающаяся к дистиллированной);
- Электрохимическая заточка режущих инструментов (например, хирургических ножей, бритв и т.д.).

 Получите свидетельство
Получите свидетельство Вход
Вход












 Электрический ток в жидкостях (2.1 MB)
Электрический ток в жидкостях (2.1 MB)
 0
0 349
349 29
29 Нравится
0
Нравится
0


