Занятие № 6
Валентность
Сегодня разговор у нас с тобой пойдет о валентности. Эту тему необходимо хорошо понять, так как в дальнейшем могут быть проблемы с составлением формул химических веществ. Итак, начнем рассуждать.
Запишем формулы нескольких веществ:
HCl H2O NH3 CH4
В каждом из этих веществ имеются атомы Гидрогена. В первом веществе 1 атом, во втором – два и т.д. У тебя должен возникнуть вопрос: «А почему атом Гидрогена в первой формуле – один, во второй – их уже два и т.д.?»
Оказывается, что, например, в молекуле воды H2O атомов Гидрогена два не просто так, а по определенной причине. И причина эта – валентность. Читаем в учебнике определение: «Валентность – это способность атома соединяться с определенным количеством таких же или других атомов». Получается, что в первой формуле HCl атом Хлора может удержать возле себя только один атом Гидрогена, в молекуле воды H2O атом Оксигена может удержать два атома Гидрогена. Атом Нитрогена в молекуле NH3 может удержать три атома Гидрогена, а атом Карбона в молекуле CH4 удерживает целых четыре атома Гидрогена. Все это зависит от валентностей атомов химических элементов, которые входят в состав молекул этих четырех веществ. Для начала тебе придется запомнить следующее:
Гидроген во всех соединениях одновалентен.
Оксиген почти во всех соединениях двухвалентен.
Валентность обычно обозначают римскими цифрами: I, II, III, IV и т.д., которые проставляют над символом химического элемента, например,
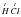
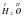
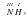
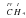
Почему я над Хлором поставила I, а над Оксигеном – II?
Давай с тобой напишем предложенные формулы по-другому:
H H
ǀ ǀ
H – Cl H – O – H H – N – H H – C – H
ǀ
H
Кстати, такие формулы называются графическими. От каждого атома Гидрогена исходит одна черточка, значит, он одновалентен. От Оксигена исходит две черточки. Он –двухвалентен. Нитроген получается трехвалентным, а Карбон в соединении CH4 проявляет валентность, равную IV.
Давай поучимся определять валентности атомов элементов по формулам химических соединений. Для примера возьмем вещество HF. Рассуждаем так: Гидроген в соединениях всегда одновалентен, а поскольку он связан только с одним атомом Флуора, то и Флуор – одновалентный. Записывается это следующим образом 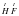 .
.
Возьмем вещество H2S. Здесь Гидроген одновалентный. В молекуле два атома Гидрогена. Их суммарная валентность равна 2. Следовательно, атом Сульфура будет двухвалентным 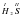 . Общая валентность Гидрогена (она равна 2) равна валентности Сульфура (тоже 2).
. Общая валентность Гидрогена (она равна 2) равна валентности Сульфура (тоже 2).
Рассмотрим еще один пример: PH3. Ставим валентность над Гидрогеном: 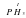 .
.
Атомов Гидрогена три штуки в молекуле PH3 (нужно смотреть на циферку справа внизу, которая называется индексом). Суммарная валентность Гидрогена будет равна трем. Поскольку эти три атома Гидрогена связаны с одним атомом Фосфора, то выходит, что его валентность равна трем 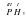 .
.
Рассмотрим теперь соединение Кальция с Оксигеном. Это CaO. Рассуждаем так: валентность Оксигена равна 2. Атом Оксигена связан с одним атомом Кальция. Значит, и Кальций тоже двухвалентный 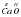 .
.
Возьмем соединение Al2O3. Оксиген в нем двухвалентный. Атомов Оксигена в молекуле 3 штуки. Общая их валентность равна шести (3x2=6). Общая валентность Алюминия должна быть тоже равна 6. Однако атомов Алюминия в молекуле два. Каждый атом алюминия будет трехвалентным (6/2=3). 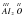 3.
3.
В соединении P2O5 рассчитываем валентность таким же образом. Общая валентность всех пяти атомов Оксигена равна 10 (5x2=10). Такой же должна быть валентность двух атомов Фосфора. Тогда получается, что валентность каждого атома Фосфора будет равной пяти 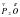 5.
5.
Для бинарных соединений, содержащих атомы Гидрогена или Оксигена, определять валентность совсем не сложно. Сложнее определить валентность атомов химических элементов в соединениях, где нет атомов Оксигена и Гидрогена. Например, в Al2S3. В этом случае следует помнить, что для элементов I-III групп периодической системы Д.И. Менделеева валентность каждого элемента совпадает с номером группы. Алюминий расположен в третьем вертикальном столбце, т.е. группе. Следовательно, его валентность равна III. Атомов Алюминия – три штуки в молекуле Al2S3. Их общая валентность равна 6 (2x3=6). У Сульфура общая валентность также будет равняться 6, а их два атома. Следовательно, каждый атом Сульфура двухвалентен (6/3=2). 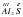 3.
3.
Существует еще одно правило: значение валентности неметаллического элемента (в нашем случае Сульфур – неметаллический элемент) в соединении с Гидрогеном или металлическим элементом (а в нашем случае Алюминий – металлический элемент) равно 8 минус номер группы, в которой размещен элемент. Сульфур располагается в VI группе. Считаем: 8-6=2. Значит, это еще одно подтверждение, что Сульфур в соединении Al2S3 будет двухвалентным.
Мы с тобой учились определять валентности атомов элементов по готовой формуле, но задание может быть и иным, когда, зная валентность атомов химических элементов, нужно составить формулу соединения. Например, валентность Хлора в соединении равна VII. Составить формулу соединения Хлора (VII) с Оксигеном.
Напишем рядом стоящие символы элементов Хлора и Оксигена: ClO.
Поставим над символом Хлора его валентность: VII. А так как валентность атома Оксигена (это нужно помнить) равна двум, то получим: 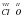 .
.
Валентность всех атомов Хлора и всех атомов Оксигена должны быть равны между собой. Валентность Хлора – VII, Оксигена – II. Для чисел 7 и 2 находим наименьшее общее кратное, т.е. наименьшее число, которое нацело поделится на 7 и 2 без остатка. Этим числом будет 14. Рассуждаем так: чтобы общая валентность всех атомов Хлора в молекуле была равной 14, таких атомов должно быть два, а чтобы общая валентность всех атомов Оксигена была равной 14 – их должно быть семь атомов.
Напишем формулу 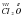 7.
7.
Проверим. Атомов Хлора 2, каждый семивалентен. Общая валентность – 14. Атомов Оксигена семь, каждый двухвалентен. Общая валентность 14. Формула составлена правильно.
Для закрепления материала рекомендую выполнить упражнение № 76-83 из учебника. Не поленись и выполни все упражнения. Если тебе понятны мои объяснения, то много времени на домашнее задание ты не потратишь.


 Получите свидетельство
Получите свидетельство Вход
Вход



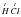
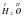
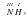
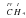
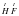 .
.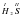 . Общая валентность Гидрогена (она равна 2) равна валентности Сульфура (тоже 2).
. Общая валентность Гидрогена (она равна 2) равна валентности Сульфура (тоже 2). 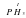 .
.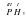 .
.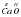 .
.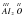 3.
3.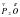 5.
5.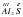 3.
3.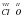 .
. 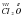 7.
7.








 Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 6) (36.46 КB)
Дистанционный материал по химии на тему "Первоначальные химические понятия" (часть 6) (36.46 КB)
 0
0 521
521 11
11 Нравится
0
Нравится
0


