
Азотная кислота
и соли
азотной кислоты
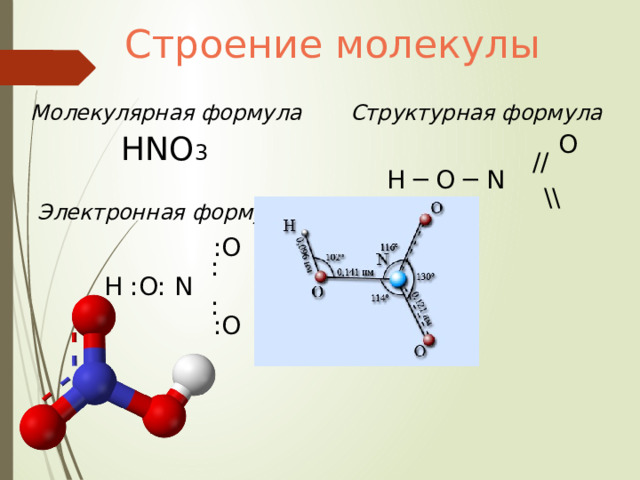
Строение молекулы
Молекулярная формула
Структурная формула
O
//
H ─ O ─ N
\\
O
HNO 3
Электронная формула
:O
:
H :O: N
:
:O

Характеристика кислоты
По основности:
одноосновная
По содержанию «О»:
кислородсодержащая
По растворимости в воде:
растворимая
По стабильности:
нестабильная
По летучести:
летучая
По степени диссоциации:
сильная

Физические свойства
- Бесцветная жидкость, дымящая на воздухе.
- Едкий запах.
- Желтый цвет концентрированной кислоты (разложение с образованием NO2).
4HNO 3 = 4NO 2 ↑ + 2H 2 O + O 2 ↑
Плотность 1,52 г/см3.
- Температура кипения – 860С.
- Температура затвердевания – -41,60С.
- Гигроскопична.
- С водой смешивается в любых соотношениях.

Химические свойства
I. Разбавленная азотная кислота проявляет свойства, общие для всех кислот:
- Диссоциация в водном растворе :
HNO 3 → H + + NO 3 -
- Реакция с основаниями:
NaOH + HNO 3 = NaNO 3 + H 2 O
Cu(OH) 2 + 2HNO 3 = Cu(NO3) 2 + 2H 2 O
- Реакция с основными оксидами:
СaO + 2HNO 3 = Ca(NO3) 2 + H 2 O
- Реакция с солями:
Na2CO 3 + 2HNO 3 = 2NaNO 3 + H 2 O + CO 2 ↑
Химические свойства
II. Азотная кислота – сильный окислитель
Окисление металлов:
Продукты восстановления
зависят от активности металла и разбавленности азотной кислоты.
Конц.
Разб.
HNO 3
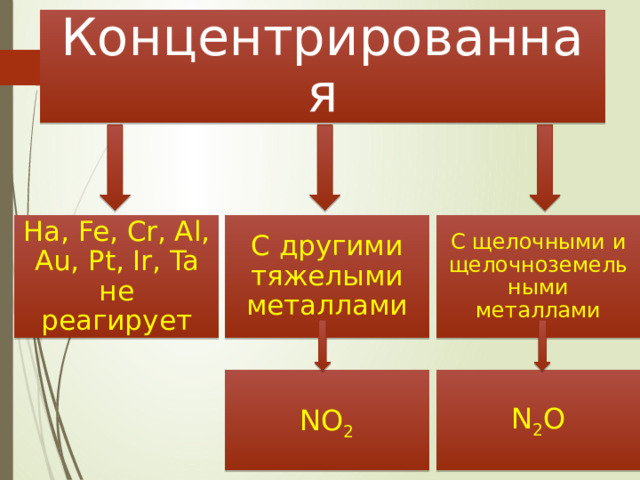
Концентрированная
Ha, Fe, Cr, Al, Au, Pt, Ir, Ta не реагирует
С другими тяжелыми металлами
С щелочными и щелочноземельными металлами
N 2 O
NO 2
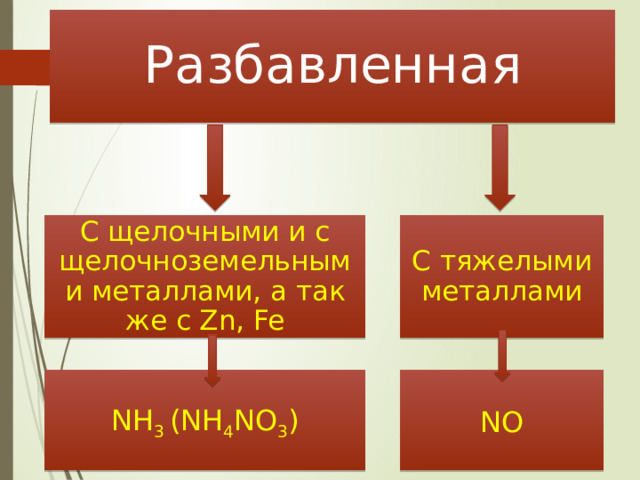
Разбавленная
С щелочными и с щелочноземельными металлами, а так же с Zn, Fe
С тяжелыми металлами
NH 3 (NH 4 NO 3 )
NO
 60% Разбавленная кислота Средней активности Li - Zn NO, NO 2 HNO 3 от 30 % до 60% Очень разбавленная кислота Малоактивные Cr - Sn Не реагируют (пассивируют) NO 2 , N 2 HNO 3 NН 3 N 2 O NO, NO 2 Благородные NO 2 Pb - Ag Соли аммония Au, Pt NO - NO, NO 2 N 2 O, NН 3 - - N 2 O, NН 3 - " width="640"
60% Разбавленная кислота Средней активности Li - Zn NO, NO 2 HNO 3 от 30 % до 60% Очень разбавленная кислота Малоактивные Cr - Sn Не реагируют (пассивируют) NO 2 , N 2 HNO 3 NН 3 N 2 O NO, NO 2 Благородные NO 2 Pb - Ag Соли аммония Au, Pt NO - NO, NO 2 N 2 O, NН 3 - - N 2 O, NН 3 - " width="640"
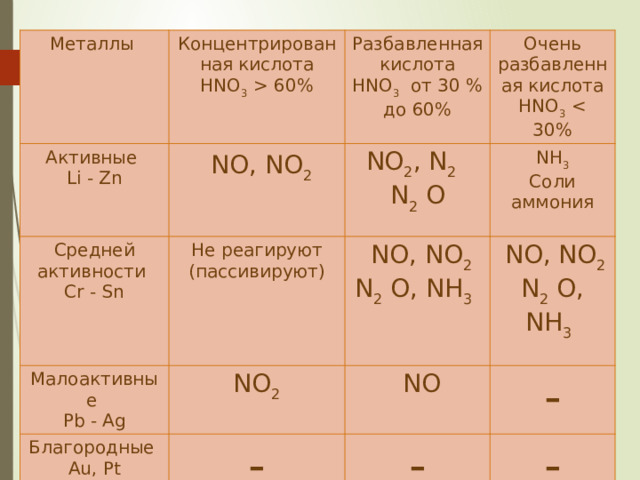
Металлы
Концентрированная кислота
Активные
HNO 3 60%
Разбавленная кислота
Средней активности
Li - Zn
NO, NO 2
HNO 3 от 30 % до 60%
Очень разбавленная кислота
Малоактивные
Cr - Sn
Не реагируют (пассивируют)
NO 2 , N 2
HNO 3
NН 3
N 2 O
NO, NO 2
Благородные
NO 2
Pb - Ag
Соли аммония
Au, Pt
NO
-
NO, NO 2
N 2 O, NН 3
-
-
N 2 O, NН 3
-

Нитраты – соли азотной
кислоты (cелитры)
Получаются при взаимодействии азотной кислоты с металлами, оксидами металлов, основаниями, аммиаком и некоторыми солями.
Физические свойства. Это твердые кристаллические вещества, хорошо растворимые в воде.

Химические свойства. Сильные электролиты, проявляют все свойства солей.
NaNO 3 = Na + + NO 3 -
Cu(NO 3 ) 2 + 2KOH = Cu(OH) 2 ↓ + 2KNO 3
AgNO 3 + NaCl = AgCl ↓ + NaNO 3
Pb(NO 3 ) 2 + Zn = Pb + Zn(NO 3 ) 2
Ba(NO 3 ) 2 + H 2 SO 4 = BaSO 4 ↓ + 2HNO 3

Качественные реакции на
азотную кислоту и ее соли
NaNO 3 + H 2 SO 4 = NaHSO 4 + HNO 3
4HNO 3 + Cu = Cu(NO 3 ) 2 + 2NO 2 ↑ +2H 2 O
Твердые нитраты. Щепотку соли бросают в огонь горелки. Происходит яркая вспышка.
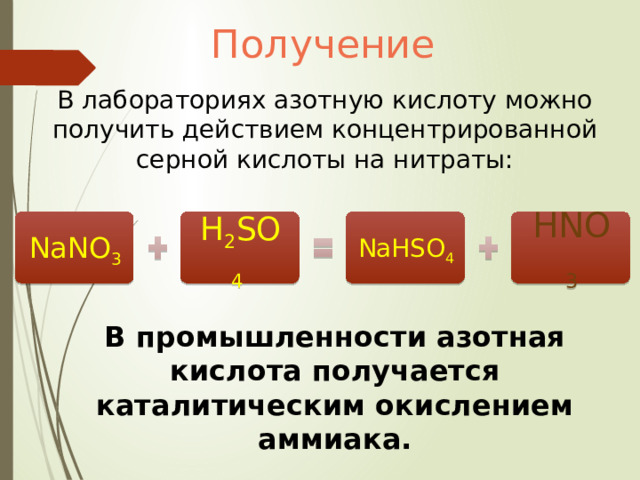
Получение
В лабораториях азотную кислоту можно получить действием концентрированной серной кислоты на нитраты:
NaNO 3
H 2 SO 4
NaHSO 4
HNO 3
В промышленности азотная кислота получается каталитическим окислением аммиака.

 Получите свидетельство
Получите свидетельство Вход
Вход












 "АЗОТНАЯ КИСЛОТА" презентация к уроку химии в 9 классе (415.99 KB)
"АЗОТНАЯ КИСЛОТА" презентация к уроку химии в 9 классе (415.99 KB)
 0
0 1747
1747 131
131 Нравится
0
Нравится
0





