Как известно, традиционное деление элементов на металлы и неметаллы исторически сложилось из-за того, что металлы, как правило, находятся в твёрдом агрегатном состоянии, имеют металлический блеск, тепло- и электропроводны, ковки и пластичны, а неметаллы при обычных условиях этими свойствами не обладают.

К неметаллам относятся 23 химических элемента, все неметаллы являются элементами главных групп.

Условная граница между металлами и неметаллами находится на линии в направлении от бора к астату. Таким образом, элементы, расположенные начиная с третьей А группы и заканчивая восьмой А группой, являются неметаллами. К неметаллам относится и водород, расположенный в первой A группе.
Число элементов неметаллов в группе увеличивается с номером группы.
В третьей A группе находится только один элемент неметалл – бор, а восьмая A группа полностью состоит из неметаллов.
Для некоторых неметаллов используют групповые названия. Элементы восьмой A группы называются благородными, или инэртными газами, элементы седьмой A группы называются галогенами, элементы шестой A группы – халькогенами.
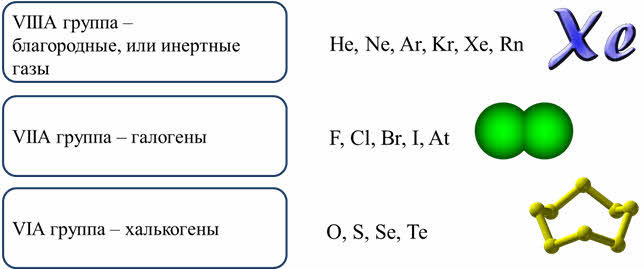
Наиболее типичными неметаллами являются: водород, кислород, углерод, азот, фосфор, сера, а также галогены – фтор, хлор, бром, йод.
Элементы, расположенные вдоль условной разграничительной линии: бор, кремний, германий, мышьяк, селен, тэллур, астат, являются неметаллам, но могут проявлять и металлические свойства, поэтому их называют полуметаллами.
У атомов большинства неметаллов, кроме водорода, гелия и бора, на внешнем энэргетическом уровне от четырёх до восьми электронов. У атома водорода на внешнем уровне содержится только один электрон, у гелия – два и его электронный слой полностью заполнен, у бора на внешнем энергетическом уровне находится три электрона.
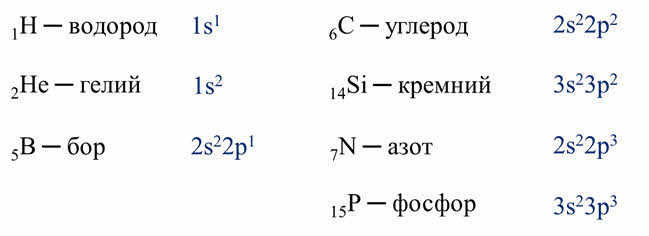
Число электронов на внешнем уровне численно равно номеру группы. Так, углерод и кремний – элементы четвёртой A группы содержат четыре электрона на внешнем энэргетическом уровне, а азот и фосфор – элементы пятой A группы содержат пять электронов на внешнем слое.
Атомы водорода и гелия относятся к эс-элементам, а все остальные атомы неметаллов – к пэ-элементам.
Электроотрицательность неметаллов гораздо выше, чем металлов.
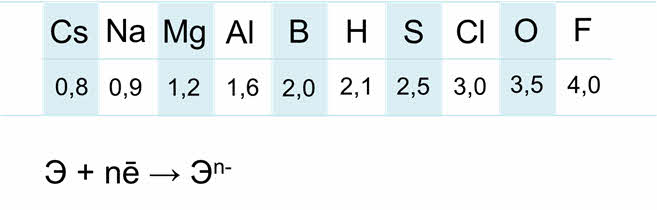
Электроны внешнего энэргетического уровня прочно связаны с ядром, поэтому для атомов неметаллов характерна способность присоединять электроны до завершения внешнего слоя.
Для атомов неметаллов возможны различные степени окисления. Максимальная положительная степень окисления, кроме кислорода и фтора, равна номеру группы. Например, у углерода и кремния плюс четыре, у азота и фосфора — плюс пять, у хлора — плюс семь, у серы — плюс шесть.
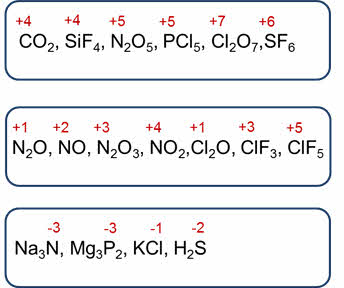
Некоторые неметаллы проявляют несколько положительных степеней окисления. Например, азот может кроме плюс пяти иметь такие степени окисления, как плюс один, плюс два, плюс три, плюс четыре, а хлор, кроме степени окисления плюс семь, имеет степени окисления плюс один, плюс три, плюс пять.
Минимальная отрицательная степень окисления равна номер группы минус восемь. У азота и фосфора минимальная отрицательная степень окисления равна минус трём, у атомов галогенов — минус один, у серы — минус два.
Таким образом, атомы неметаллов в их соединениях с атомами металлов, водорода и других менее электроотрицательных элементов проявляют отрицательные степени окисления, а в соединениях с более электроотрицательными элементами для атомов неметаллов характерны положительные степени окисления.
Благородные газа – ксенон и в меньшей степени криптон – в своих соединениях со фтором и кислородом также способны проявлять положительные степени окисления плюс два, плюс четыре, плюс шесть и плюс восемь.
Исключение составляет фтор, который в соединениях может проявлять только степень окисления минус один.
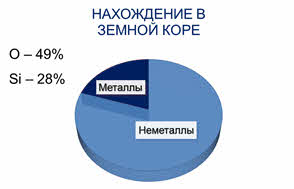
Массовая доля неметаллов в земной коре составляет почти 80%, а во вселенной достигает девяноста девяти процентов (в основном за счёт водорода и гелия). На долю кислорода в земной коре приходится более 49%, на долю кремния – около 28%, а на долю брома, йода, селена и тэллура – сотые доли процента.
Неметаллы входят и в состав живых организмов. Эти элементы называются органогенными. К ним относятся: углерод, кислород, водород, азот, фосфор, сера.
Несмотря на незначительное содержание селена, брома, йода в живых организмах, эти элементы относятся к жизненно необходимым.
В последние годы учёные установили, что селен оберегает клетки от вредного воздействия ультрафиолетового и радиоактивного облучения. Селен содержится в таких грибах, как лисички, опята, маслята, но значительно больше этого элемента содержится в ядовитых грибах: бледной поганке, мухоморе.

По мнению учёных, большие концентрации селена в грибах способствуют их быстрому росту. Но следует помнить, что употребление продуктов, содержащих селен в больших количествах, больше пяти миллиграмм на один килограмм пищи, приводит к острому отравлению организма человека.
В природе неметаллы встречаются как в виде простых веществ, так и в виде сложных соединений. Большая часть неметаллов входит в состав минералов и горных пород, в состав органических соединений.

Молекулы неметаллов могут быть одноатомными (благородные газы), двухатомными (галогены, кислород, азот и водород), а также содержать большее число атомов (как озон, фосфор и сера).
Атомы некоторых неметаллов могут образовывать цепи, например, атомы углерода образуют цепи неограниченной длины, а атомы кремния – недлинные цепи (до шести атомов).
Неметаллы образуют вещества молекулярного строения (кислород, азот, сера, благородные газы) и немолекулярного строения (углерод в виде алмаза и графита).
Для неметаллов характерно разнообразие в физических свойствах. Как вы знаете, при обычных условиях кислород, водород, азот, фтор, хлор – газы, как и элементы благородные, или инэртные газы.
Единственной жидкостью среди неметаллов является бром. Все остальные неметаллы – твёрдые вещества, которые имеют атомную кристаллическую решётку, как у бора и кремния, так и молекулярную, как у йода, фосфора, серы.
Многие неметаллы обладают окраской: графит – серо-чёрной, бром – красно-бурой, сера – жёлтой, хлор – жёлто-зелёной, йод – фиолетово-чёрной.

Очень различаются и другие физические свойства неметаллов: так температура плавления графита составляет 3850 градусов по Цэльсию, а у гелия — минус 272 градуса по Цэльсию.
Плотность газообразных неметаллов также различна: самая маленькая – у водорода, а самая большая – у радона.
Твёрдые неметаллы не обладают пластичностью.
В воде неметаллы нерастворимы или малорастворимы. Некоторые из них, как галогены, сера лучше растворяются в органических растворителях, а белый фосфор – в сероуглероде.
Различаются неметаллы и по электропроводности. Большинство неметаллов – это изоляторы.
Графит – является хорошим проводником электрического тока. Кремний, селен и тэллур обладают полупроводниковыми свойствами.
Интересно, что радиоактивный радон используется в медицине для лечения опорно-двигательного аппарата, сердечных и нервных заболеваний. Но в тоже время в литературе часто упоминается термин «радоновая проблема», который означает достаточно высокое облучение, вызванное радоном, который выделяется через разломы в земной коре.
Для неметаллов характерно явление аллотропии.
Аллотропия (от греч. аллотропия – другое свойство) явление существования элементов в виде нескольких простых веществ. Так, химический элемент кислород в природе существует в виде двух простых веществ – кислорода и озона. Различный состав и строение молекул определяют различие в их свойствах.
Кислород – газ без цвета и запаха, озон – газ светло-голубого цвета с резким характерным запахом. Они различаются также температурами плавления и кипения, реакционной способностью.
В природе озон образуется при грозовых разрядах и при окислении смолы хвойных деревьев. Озон в верхних слоях атмосферы образует озоновый слой, который защищает живые организмы от ультрафиолетового излучения.
Небольшое количество озона в воздухе оказывает целебное действие на людей с заболеванием лёгких, но сильное обогащение воздуха озоном может стать опасным для здоровья. Источником озона служат работающие ксероксы, лазерные принтеры, источники ультрафиолетового и рентгеновского излучения. Поэтому помещения, в которых находятся такие приборы необходимо часто проветривать.
Химический элемент углерод также встречается в нескольких аллотропных модификациях: графит, алмаз, карбин, фуллерен, но наиболее распространены алмаз и графит, которые отличаются по своим свойствам. Графит – мягкое, серо-чёрное вещество, хорошо проводит электрический ток, а алмаз – прозрачный кристалл, самое твёрдое природное вещество, является изолятором.
Простые вещества неметаллы различаются и по химической активности. Наиболее химически активны галогены и кислород. Сера, фосфор, углерод и кремний вступают в химические реакции, как правило, только при нагревании.
Для неметаллов характерны и восстановительные, и окислительные свойства. Способность неметаллов проявлять те или иные свойства определяется положением их в ряду электроотрицательности. Электрооотрицательность уменьшается от фтора к водороду.
В качестве окислителей неметаллы взаимодействуют с металлами. Например, при горении магния в кислороде образуется оксид магния, кислород понижает свою степень окисления с нуля до минус двух, поэтому он вступает в роли окислителя, при горении железа в хлоре образуется хлорид железа три, хлор понижает степень окисления с нуля до минус единицы, поэтому хлор является окислителем.
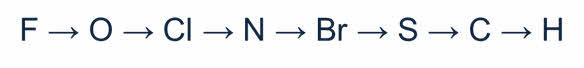
В реакции с водородом неметаллы выступают в качестве окислителей, а водород – в качестве восстановителя. Например, в реакции водорода с серой образуется сероводород. Сера понижает свою степень окисления с нуля до минус двух, поэтому сера – окислитель.
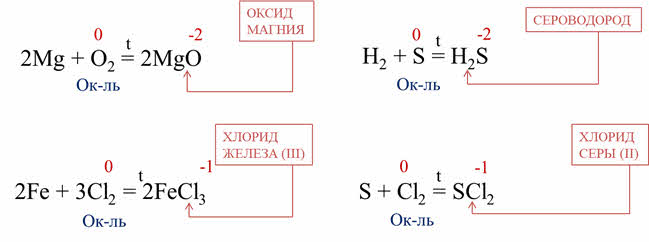
Неметаллы выступают в роли окислителей при взаимодействии с другими неметаллами, имеющими более низкую электроотрицательность. Так, в реакции серы с хлором образуется хлорид серы два, хлор понижает свою степень окисления с нуля до минус единицы, поэтому хлор – окислитель.
Неметаллы реагируют и со сложными веществами: в реакции хлора с йодидом калия образуется хлорид калия и йод. В этой реакции хлор понижает свою степень окисления с нуля до минус единицы, поэтому в данной реакции хлор является окислителем.
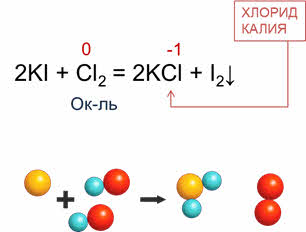
В качестве восстановителей неметаллы выступают в реакциях с неметаллами, атомы которых имеют более высокое значение электроотрицательности. Например, в реакции горения серы образуется оксид серы четыре, в данной реакции сера повышает свою степень окисления с нуля до плюс четырёх, поэтому в этой реакции сера – восстановитель.
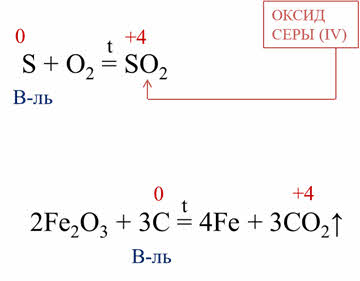
Восстановительные свойства неметаллы проявляют и в реакциях со сложными веществами. Например, в реакции углерода с оксидом железа три углерод повышает свою степень окисления с нуля до плюс четырёх, выступая в роли восстановителя.
В реакциях диспропорционирования один и тот же неметалл является одновременно и окислителем, и восстановителем.
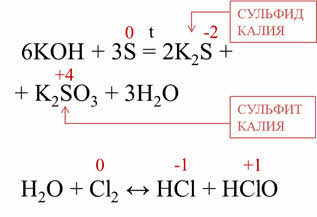
Например, в реакции серы с гидроксидом калия образуется сульфид калия, сульфит калия и вода. Сера, таким образом, изменила свою степень окисления с нуля до мину двух и плюс четырёх. В реакции хлора с водой хлор также изменяет свою степень окисления с нуля до минус единицы и плюс единицы.
Таким образом, все неметаллы являются элементами главных групп. Атомы неметаллов могут проявлять как отрицательные, так и положительные степени окисления. Простые вещества неметаллы существенно различаются между собой физическими и химическими свойствами. Для неметаллов характерно явление аллотропии. В химических реакциях неметаллы могут проявлять окислительные и восстановительные свойства.

 Получите свидетельство
Получите свидетельство Вход
Вход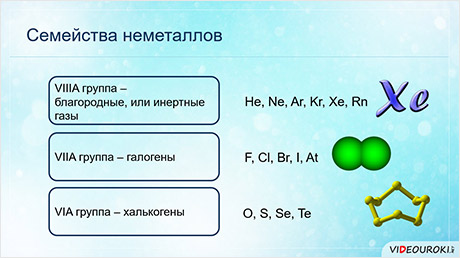




 7218
7218

