Первым дэ-элементом является скандий, он расположен в четвёртом периоде, третьей бэ группы.

Валентными электронами у скандия являются электроны предвнешнего дэ-подуровня и внешнего эс-подуровня.
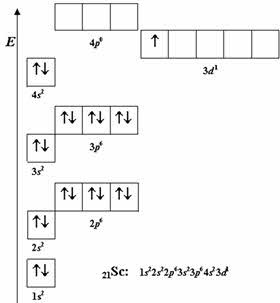
Следующие за скандием девять химических элементов также относятся к дэ–элементам, в атомах которых происходит заполнение три-дэ-подуровня.
Дэ-элементы расположены в побочных подгруппах, которые начинаются с четвёртого периода, их называют переходными элементами, к эф-элементам относятся лантаноиды и актиноиды, они вынесены отдельно и расположены внизу периодической системы Дмитрия Ивановича Менделеева. Лантаноиды находятся вместе с лантаном в шестом периоде в третьей бэ группе, а актиноиды в седьмом периоде третьей бэ группы.
Как было сказано, третья B группа начинается скандием, у которого один электрон на три-дэ-орбитале, у иттрия, лантана и актиния также по одному электрону на дэ-орбитале, так как это элементы третьей бэ группы, и максимальная степень окисления их в соединениях равна плюс трём.

Кроме степени окисления плюс три, для них характерна и степень окисления плюс два.
Лантаноиды – элементы третьей бэ группы, они расположены в шестом периоде, у них начинается заполнение четвёртого-эф-подуровня. Актиноиды – это элементы седьмого периода третьей бэ группы, у них идёт заполнение пятого-эф-подуровня. Они представляют собой радиоактивные элементы, не имеющие стабильных нуклидов. Актиноиды – это редкие элементы.
У элементов четвёртой B группы появляется второй электрон на дэ-подуровне.

К этим элементам относятся: титан, цирконий, гафний. Для этих элементов в соединениях характерны степени окисления: плюс два, плюс три и плюс четыре.
К пятой B группе относятся ванадий, ниобий, тантал.

У них на дэ-подуровне появляется третий электрон, поэтому для них характерны такие степени окисления, как плюс два, плюс три, плюс четыре, плюс пять.
К элементам шестой B группы относятся хром, молибдэн, вольфрам.

У них на дэ-подуровне должно быть по четыре электрона, но у хрома и молибдэна наблюдается такое явление, как «проскок электрона», потому что энергетически более выгодно, когда орбитали наполовину или полностью заполнены. Именно поэтому, у хрома и молибдэна по пять электронов на дэ-подуровне. Для этих элементов возможны степени окисления: плюс два, плюс три, плюс шесть.
Марганец, технеций, рений являются элементами седьмой B группы.

Из них наиболее распространён марганец, а технеций и рений являются редкими элементами. У них на дэ-подуровне по пять электронов, поэтому для них возможны степени окисления: плюс два, плюс три, плюс четыре, плюс шесть, плюс семь.
Восьмая B группа состоит из триады железа – железа, кобальта, никеля и все последующие триады – это платиновые металлы.

На дэ-подуровне у этих элементов от 6 до 8 электронов, поэтому в соединениях для них возможны следующие степени окисления: плюс два, плюс три, плюс четыре, плюс шесть, плюс восемь.
Свойства железа, кобальта и никеля будут очень похожи, а также схожи свойства и у платиновых металлов. Для никеля наиболее характерна степень окисления плюс два, плюс три – для железа и кобальта, плюс четыре – для платины, плюс шесть – для родия и иридия, а плюс восемь – только для осмия.
У элементов первой B группы появляется ещё один электрон.

К этим элементам относятся: медь, серебро, золото. Для элементов этой группы возможны степени окисления плюс один, плюс два, плюс три.
У элементов второй B группы дэ-подуровень полностью заполнен.

Это такие элементы, как цинк, кадмий, ртуть. Для них возможны степени окисления плюс один и плюс два.
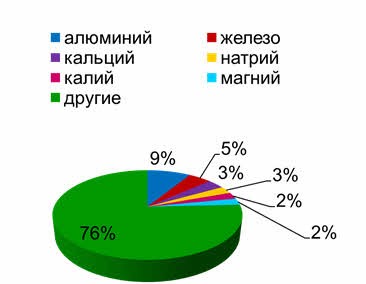
Среди дэ-элементов наиболее распространённым является железо, он занимает четвёртое место после кислорода, кремния и алюминия.

Среди соединений железа наиболее распространены магнетит, или магнитный железняк, гематит, или кровавник, лимонит, пирротин, пирит, сидерит.

Широко распространён такой металл, как титан. Известно около семидесяти минералов титана, к наиболее распространённым относятся ильменит, или титанистый железняк, рутил, анатаз.

Содержание марганца в земной коре составляет одну десятую процента по массе. К наиболее распространённым соединениям марганца относятся: пиролюзит, марганцевая обманка, марганцевый колчедан, родохрозит, или малиновый шпат.

У хрома тоже есть свои минералы. Например, хромистый железняк, или хромит и другие.

У цинка наиболее распространённым соединением является цинковая обманка, или сфалерит. Медь встречается как в самородном состоянии, так и в виде соединений. Таких как медный колчедан, халькозин, или медный блеск.

Наиболее распространёнными соединениями кобальта являются каролит, линнеит, кобальтин.

У молибдэна известно около двадцати минералов, наиболее известные это: молибдэнит, повеллит и др.

А вот вольфрамовые минералы обычно вкраплены в гранитные породы и содержание вольфрама там от одного до двух прооцентов.

Элементы, которые не способны концентрироваться в земной коре и которые не образуют собственных минералов, называются рассеянными. К ним относятся гафний, рений, кадмий, лантаноиды.
Ртуть встречается в природе в большинстве сульфидных минералов. Наибольшее промышленное значение имеет киноварь.

Серебро, как и золото, в основном встречаются в самородном состоянии.

Платиновые металлы встречаются в природе в рассеянном состоянии. Платина, иридий, палладий встречаются как в самородном состоянии, так и в составе интэрметаллидов.
Самым редким дэ-элементом на Земле является технеций, он встречается в урановых рудах.
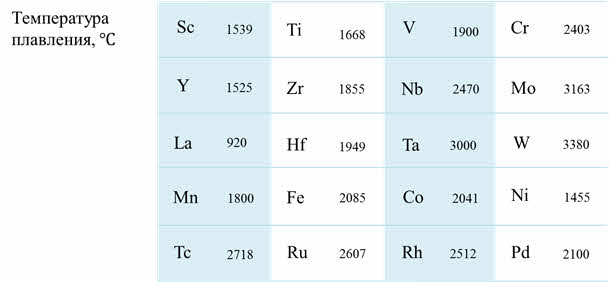
Если сравнивать физические свойства дэ-элементов, то можно заметить следующую закономерность: по периоду слева направо от скандия до хрома температура плавления увеличивается, у марганца температура плавления понижается, и в ряду от марганца до цинка идёт последовательное уменьшение температуры плавления.
По группе сверху вниз также увеличиваются температуры плавления, самым тугоплавким металлом, как известно, является вольфрам.

Плотность от скандия к ванадию увеличиваются, вниз по группе сверху вниз плотность также увеличивается, тяжелыми являются вольфрам, золото, платина, а самым тяжёлым является осмий.

В образовании химической связи могут участвовать электроны эс, пэ, дэ-орбиталей. Но на внешнем энергетическом уровне небольшое число электронов, поэтому в химических реакциях они отдают электроны. Таким образом, все дэ-элементы являются металлами.
Изменение физических свойств d-элементов
Из-за большого числа валентных электронов все дэ-элементы проявляют переменные степени окисления. В отличие от элементов главных подгрупп, устойчивость соединений дэ-элементов в высшей степени окисления возрастает вниз по группе. В отличие от эс- и пэ-элементов для дэ–элементов характерен более широкий набор степеней окисления их атомов в соединениях.
Например, для скандия: плюс три, для титана – плюс три и плюс четыре, для ванадия – плюс два, плюс три, плюс четыре и плюс пять, для хрома – плюс два, плюс три и плюс шесть, для марганца – плюс два, плюс три, плюс четыре, плюс шесть и плюс семь, для железа – плюс два, плюс три, плюс шесть, для кобальта – плюс два и плюс три, для никеля – плюс два, плюс три, для меди – плюс один, плюс два, для цинка – плюс два.

У каждого дэ-металла есть соединения с различными кислотно-основными свойствами. Например, соединения хрома в степени окисления плюс два проявляют основные свойства, в степени окисления плюс три – амфотэрные, а в степени окисления плюс шесть – кислотные.
Так как у дэ-элементов идёт заполнение предвнешних орбиталей, то это приводит к близости химических свойств у ряда элементов, их ещё называют элементами-близнецами. Это от циркония до гафния, от ниобия до тантала, от молибдэна до вольфрама.
Ещё большее сходство обнаруживается у эф-элементов – лантаноидов и актиноидов.
Таким образом, к дэ-элементам относятся 32 элемента периодической системы от четвёртого до седьмого периодов. В третьей-бэ-группе у атомов появляется первый электрон на дэ-орбитали, в последующих бэ-группах дэ-подуровень заполняется до 10 электронов.
С увеличением порядкового номера свойства дэ-элементов изменяются незначительно. У дэ-элементов медленно происходит возрастание атомного радиуса, также они имеют переменную валентность, связанную с незавершенностью предвнешнего дэ-электронного подуровня.
В низших степенях окисления дэ-элементы обнаруживают металлические свойства, при увеличении порядкового номера в бэ группах они уменьшаются.
В растворах дэ-элементы с высшей степенью окисления обнаруживают кислотные и окислительные свойства, при низших степенях окисления – наоборот. Элементы с промежуточной степенью окисления проявляют амфотэрные свойства.
У химических элементов бэ-групп валентными являются электроны как внешнего, так и предвнешнего и даже третьего снаружи уровня, как у эф-элементов. Если у атомов эс-, пэ-элементов увеличение на единицу заряда ядра приводит к добавлению одного электрона на внешний энергетический уровень, то в атомах элементов бэ-групп электроны добавляются не на внешний уровень, а на предвнешний или третий снаружи уровень.

 Получите свидетельство
Получите свидетельство Вход
Вход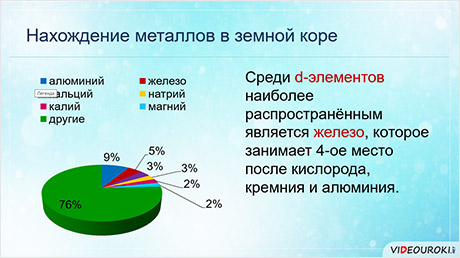



 0
0 3933
3933


