Химические свойства металлов во многом зависят от строения его внешнего или предвнешнего электронного слоя. Для металлов, расположенных в одной группе периодической системы и имеющих одинаковое строение внешней электронной оболочки, следует ожидать определённые сходства в химических свойствах.
В атоме металлов на внешнем энергетическом уровне небольшое количество электронов и очень большой радиус атома, что способствует быстрой отдаче электронов атомами металлов в результат их взаимодействия с другими соединениями.

Металлы окисляются, сами при этом выступают в роли восстановителя.
Кроме этого, положение металла в ряду активности характеризует свойства металла и его катионов в водных растворах и связано с его химической активностью.
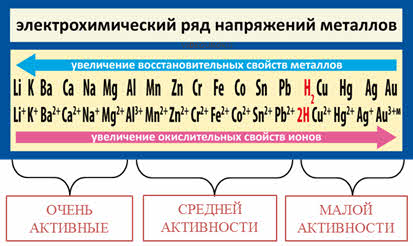
Как известно, самые активные металлы расположены в начале ряда (слева), а самые малоактивные – в конце (справа).
На основании восстановительной способности металлов в ряду напряжений металлы условно можно разделить на три группы: от лития до алюминия – очень активные металлы, от алюминия до водорода – металлы средней активности, от водорода до золота – малоактивные металлы.
Следует отметить, что высокая электрохимическая активность металла не всегда означает его химическую активность и наоборот. Обратите внимание на расположение лития и натрия в ПС и в ряду активности металлов. На основании положения в ПС натрий активнее лития, так как радиус у натрия больше, на основании положения их в ряду активности видно, что литий стоит левее натрия, то есть его восстановительная способность выше, так как здесь учитывается не только радиус атома, но и энергия отрыва электрона, энергия разрушения кристалла и энергия гидратации ионов металла.
Например, с кислородом активно при комнатной температуре реагируют только щелочные металлы, при этом образуются оксиды или пероксиды. Так, в реакции лития с кислородом образуется оксид лития, а в реакции натрия с кислородом – пероксид натрия.
4Li + O2 = 2Li2O
2Na + O2 = Na2O2
Металлы средней активности реагируют с кислородом при нагревании. Например, проведём эксперимент горения магния в кислороде. В результате данной реакции образуется оксид магния, магний горит яркой вспышкой. Эта реакция сопровождается выделением большого количества и света и ранее использовалась фотографами в качестве вспышки при съёмке.
2Mg + O2 = 2MgO
Алюминий в порошке также горит ослепительным пламенем с образованием оксида алюминия. Эта способность используется в фейерверках, салютах, бенгальских огнях.

Такие металлы, как Au, Pt не реагируют с кислородом и поэтому на воздухе практически не изменяют своего блеска.
Большинство металлов, кроме Au, Pt реагируют при нагревании с серой, при этом образуются соответствующие сульфиды.

Так, в реакции цинка с серой образуется сульфид цинка, в реакции серебра с серой образуется сульфид серебра (I).

Проведём эксперимент, для этого на асбестовой сетке поместим цинк с серой, подожжём эту смесь горящим магнием, в результате у нас образуется сульфид цинка.

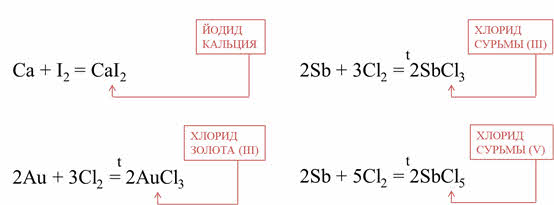
Практически все металлы реагируют с галогенами. Условия протекания этих реакций зависит от активности металла и галогена. Например, кальций реагирует с йодом при комнатной температуре, при этом образуется йодид кальция, а золото реагирует с хлором при сильном нагревании, при это образуется хлорид золота (III). Очень красиво горит сурьма в хлоре, при этом образуется смесь хлоридов: хлорид сурьмы (III) и хлорид сурьмы (V).
С металлами реагируют соединения всех классов – оксиды (в том числе вода), кислоты, основания и соли.
При нагревании металлы реагируют и с другими неметаллами. Так, в реакции алюминия с азотом, образуется нитрид алюминия, в реакции кальция с форфором, образуется фосфид кальция, в реакции алюминия с углеродом – карбид алюминия, в реакции магния с кремнием – силицид магния.

С водородом реагируют только активные металлы. Например, в реакции натрия с водородом образуется гидрид натрия.

Так, активные металлы бурно реагируют с водой при комнатной температуре. Например, в реакции лития с водой образуется гидроксид лития и водород, в реакции бария с водой образуется гидроксид бария и водород.

Проведём эксперимент, для этого в воду добавим фенолфталеин и опустим туда кусочек натрия. Натрий начинает бегать по поверхности из-за выделения водорода, раствор приобретает малиновую окраску, вследствие образования щёлочи. Таким образом, в реакции натрия с водой образуется щёлочь – гидроксид натрия и газ – водород.
Поверхность таких металлов, как магний и алюминий, защищена плотной плёнкой соответствующего оксида. Это препятствует протеканию реакции с водой.

Но если убрать эту плёнку, то эти металлы активно будут вступать в реакцию. Например, порошкообразный магний реагирует с горячей водой, при этом образуется гидроксид магния и водород.
При повышенной температуре с водой реагируют и менее активные металлы, но в данном случае образуется окси д и водород. Например, в реакции цинка с водой образуется оксид цинка и водород.

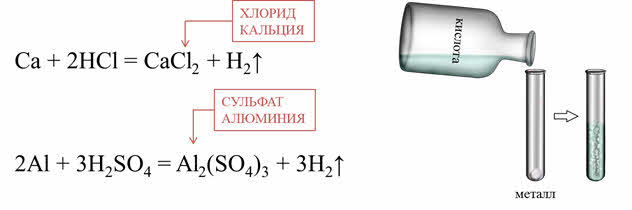
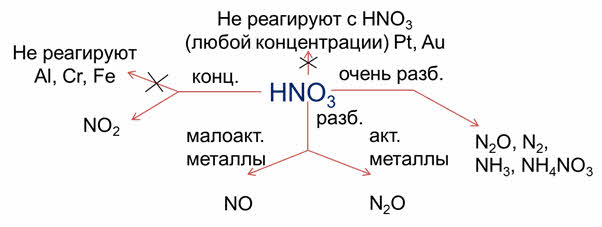
Металлы, стоящие в ряду активности до водорода, реагируют с кислотами (кроме HNO3 любой концентрации и H2SO4 концентрированной) с образованием солей и водорода. Активные металлы реагируют с растворами кислот очень быстро. Например, в реакции кальция с соляной кислотой образуется соль – хлорид кальция и водород, в реакции алюминия с разбавленной серной кислотой образуется соль – сульфат алюминия и водород.
Малоактивные металлы часто практически не растворяются в кислотах. Это обусловлено образованием на их поверхности плёнки нерастворимой соли. Например, свинец, стоящий в ряду активности до водорода, практически не растворяется в разбавленной серной и соляной кислотах вследствие образования на его поверхности плёнки нерастворимых солей (PbCl2, PbSO4).

В азотной кислоте растворяются металлы, стоящие и до, и после водорода. При этом образуются нитраты, а также различные продукты восстановления азотной кислоты.
Концентрированная серная кислота также может вступать в реакции с металлами, расположенными в ряду активности после водорода. Например, в реакции серебра с концентрированной серной кислотой образуется сульфат серебра (I), сернистый газ и вода, а в реакции магния с концентрированной серной кислотой образуется сульфат магния, сероводород и вода.

Al, Cr, Fe при комнатной температуре не вступают в реакцию и с концентрированной серной кислотой из-за образования на их поверхности оксидной плёнки. Это явление называется пассивацией. Благодаря этому становится возможным транспортировать концентрированную азотную серную кислоты в стальных цистернах.
Проведём эксперимент, поместим в четыре пробирки металлы: в первую – магний, во вторую – цинк, в третью – железо, а в четвёртую – медь и прильём в каждую пробирку соляной кислоты.

Интенсивнее всего выделение наблюдается в первой пробирки, где находится цинк, кроме этого, реакция сопровождается выделение теплоты, во второй и третье пробирке интенсивность выделения водорода меньше, а в четвёртой пробирке водород вообще не выделяется.
Mg + 2HCl = MgCl2 + H2↑ + Q
Zn + 2HCl = ZnCl2 + H2↑
Fe + 2HCl = FeCl2 + H2↑
Cu + HCl ≠
Тоже самое сделаем в другом опыте, но использовать здесь будем уксусную кислоту. Получается, что при комнатной температуре с уксусной кислотой реагирует только магний, цинк и железо реагирует с уксусной кислотой только при нагревании, а медь не вступает во взаимодействие с уксусной кислотой.
Mg + 2CH3COOH = (CH3COO)2 Mg + H2↑
Zn + 2CH3COOH = (CH3COO)2 Zn + H2↑
Fe + 2CH3COOH = (CH3COO)2 Fe + H2↑
Cu + CH3COOH ≠
Таким образом, металл реагирует с раствором кислоты, если он стоит в ряду активности левее водорода, при этом должна образоваться растворимая соль, концентрированная серная и азотная кислота иначе реагируют с кислотами, щелочные металлы для данных реакций лучше не использовать из-за их высокой химической активности.
Некоторые металлы, такие, как Be, Zn, Al, легко растворяются в водных растворах щелочей с образованием комплексных соединений.
Например, в реакции бериллия с раствором гидроксида натрия образуется комплексная соль – тетрагидроксобериллат натрия, а в реакции цинка с водным раствором гидроксида калия образуется комплексная соль – тетрагидроксоцинкат калия.
Be + 2H2O + 2NaOH = Na2[Be(OH)4] + H2↑
Zn + 2H2O + 2KOH = K2[Zn(OH)4] + H2↑
Металлы, оксиды и гидроксиды которых амфотерны, взаимодействуют также с расплавами щелочей при нагревании. Например, в реакции цинка с расплавом гидроксида натрия образуется соль – цинкат натрия и водород.
Zn + 2NaOH (тв.) = Na2ZnO2 + H2↑
Активные металлы вытесняют малоактивные из растворов их солей. Так, в реакции железа с хлоридом меди (II) железо замещает медь в его хлориде и образуется хлорид железа (II) и медь, в реакции меди с нитратом серебра (I) образуется соль – нитрат меди (II) и серебро.
Fe + CuCl2 = FeCl2 + Cu↓
Cu + 2AgNO3 = Cu (NO3)2 + 2Ag↓
Проведём эксперимент, опустим железный гвоздь в раствор сульфата меди (II), через некоторое время на железном гвозде осела медь и раствор стал жёлтого цвета, если опустить медную платину в раствор сульфата железа (II), то в данной случае признаков реакции не наблюдается, ведь медь менее активный металл, чем железо.

Fe + CuSO4 = FeSO4 + Cu↓
Cu + FeSO4 ≠
В данных реакциях нужно соблюдать следующие условия: щелочные металлы брать нельзя, так как они будут взаимодействовать с водой, металл должен находится левее того металла, который входит в состав соли, в данных реакциях должна образоваться растворимая соль.
Металлы могут реагировать и с органическими веществами. Например, в реакции фенола с натрием, образуется фенолят натрия, в реакции этанола с натрием образуется этилат натрия.
2C6H5OH + 2Na → 2C6H5ONa + H2↑
2C2H5OH + 2Na → 2C2H5ONa + H2↑
Кроме этого, натрий вступает в реакцию Вюрца с галогеналканами. Так, в реакции хлорметана с натрием образуется хлорид натрия и этан.
2H3CCl + 2Na  C2H6
+ 2NaCl
C2H6
+ 2NaCl
Соединение Pb(C2H5)4 – тетраэтилсвинец – применяется как антидетонатор в моторном топливе. Это сильно ядовитое соединение, если бензин содержит тетраэтилсвинец, тогда его называют «этилированным».
Таким образом, о химической активности металлов можно примерно судить по их расположению в электрохимическом ряду напряжений металлов. Чем левее расположен металл, тем выше его химическая активность в водном растворе. Активные металлы размещаются вначале вытеснительного ряда, а малоактивные – в конце. Металлы реагируют как с простыми веществами – неметаллами, так и со сложными: оксидами, кислотами, основаниями и солями.

 Получите свидетельство
Получите свидетельство Вход
Вход




 4529
4529

