Для всех металлов известны их оксиды и гидроксиды, а у d-элементов различные степени окисления, поэтому они образуют множество оксидов и гидроксидов. Свойства этих оксидов и гидроксидов зависят от положения металла в периодической системе, от его активности и степени окисления металла. Таким образом, все металлы образуют солеобразующие оксиды.
Известно, что чем ярче выражены металлические свойства, тем сильнее основные свойства оксидов и гидроксидов.
Для s- и p-элементов слева направо по периоду уменьшаются металлические свойства, а значит и основные свойства оксидов и гидроксидов металлов. В IA группе сверху вниз увеличиваются радиусы атомов, при отдаче электронов с внешнего уровня образуются катионы. Естественно, что степень окисления у этих элементов не изменяется, а основный характер оксидов усиливается.

Если рассмотреть изменение свойств оксидов элементов по периоду на примере элементов 3 периода, то следует отметить, что в атомах этих элементов количество энергетических уровней одинаковое, но степень окисления изменяется, то есть она возрастает, а радиус иона уменьшается, поэтому характер оксидов изменяется от основного через амфотерные к кислотному.

Например, оксиды и гидроксиды щелочных и щелочноземельных металлов проявляют ярко выраженные основные свойства, а уже оксид алюминия проявляют амфотерные свойства.
Так, оксид натрия – это основный оксид, поэтому он будет реагировать с кислотными и амфотерными оксидами, с кислотами. Например, в реакции оксида натрия с оксидом углерода (IV) образуется соль – карбонат натрия, в реакции оксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.

По группе сверху вниз металлические свойства s- и p-элементов усиливаются, поэтому усиливаются и основные свойства их оксидов.

Например, в группе II A оксид бериллия проявляет амфотерные свойства, поэтому он легко растворяется в растворах кислот и щелочей. Например, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции оксида бериллия с раствором гидроксида натрия образуется комплексная соль – тетрагидроксобериллат натрия.

Соединения бария и радия имеют уже ярко выраженные основные свойства, поэтому они будут реагировать с кислотными и амфотерными оксидами, а также с кислотами. Так, в реакции оксида бария с азотной кислотой образуется соль – нитрат бария и вода.

Характер гидроксида зависит также от степени окисления и радиуса иона. Чем больше степень окисления, тем меньше радиус иона.

Поэтому в ряду от гидроксида натрия до гидроксида алюминия идёт ослабление основных свойств и усиление кислотных, так как возрастает степень окисления и уменьшается радиус иона.

Например, в I A группе сверху вниз увеличивается радиус иона, степень окисления не изменяется, поэтому усиливаются основные свойства. В ряду от гидроксида лития до гидроксида цезия основные свойства будут усиливаться.

Переходные элементы, расположенные в малых периодах – это Be, Al образуют оксиды и гидроксиды, проявляющие амфотерные свойства.
Получим гидроксид алюминия и исследуем его свойства. Сначала в растворимую соль алюминия добавим щелочь, в результате у нас образуется осадок – это гидроксид алюминия.

Затем разделим этот осадок на две части: к первой части добавим соляную кислоту, осадок растворяется из-за образования растворимой соли – хлорида алюминия. Ко второй части осадка добавим гидроксид калия – осадок также растворяется, потому что образуется растворимая соль – тетрагидроксоалюминат калия.
Al(OH)3 + 3HCl = AlCl3 + 3H2O
Al(OH)3 + KOH = K[Al(OH)4]
Амфотерные оксиды и гидроксиды вступают в реакции не только с растворами щелочей, но и с твёрдыми основаниями при сплавлении.
Например, при сплавлении гидроксида хрома (III) с гидроксидом калия образуется соль – метахромит калия и вода, при сплавлении гидроксида хрома (III) с оксидом калия образуется метахромит калия и вода, при сплавлении гидроксида хрома (III) с карбонатом калия также образуется соль метахромит калия, вода и углекислый газ.

Аналогично оксид и гидроксид алюминия ведёт себя: при сплавлении оксида алюминия и гидроксида калия образуется соль – металюминат калия и вода, при сплавлении гидроксида алюминия и гидроксида калия образуется соль – метаалюминат калия и вода.
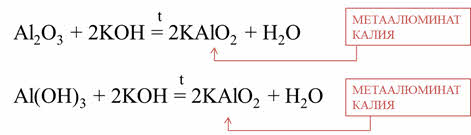
Оксид и гидроксид бериллия также проявляет амфотерные свойства, потому что они реагирует с кислотами, щелочами. Так, в реакции оксида бериллия с соляной кислотой образуется соль – хлорид бериллия и вода, в реакции гидроксида бериллия и серной кислоты образуется соль – сульфат бериллия и вода.

Большое влияние на кислотно-основные свойства оксидов и гидроксидов d-элементов оказывает степень окисления металла, поэтому с увеличением степени окисления металла кислотные свойства соответствующего оксида и гидроксида усиливаются. Например, хром образует оксиды и гидроксиды, в которых атомы хрома проявляют степени окисления +2, +3 и +6.

В оксиде CrO и гидроксиде Cr(OH)2 степень окисления хрома +2, поэтому этот оксид и гидроксид будут проявлять основные свойства. В оксиде Cr2O3 и гидроксиде Cr(OH)3 окисления хрома +3, поэтому оксид и гидроксид в этой степени окисления будут проявлять амфотерные свойства, в оксиде CrO3 и гидроксиде H2CrO4 степень окисления хрома +6 – это высшая степень окисления для атома хрома, поэтому этот оксид и гидроксид проявляют кислотные свойства.

Тоже самое наблюдается и в соединениях марганца. Например, в оксиде MnO и в гидроксиде Mn(OH)2 степень окисления марганца +2 – это низшая степень оксиления, поэтому эти соединения проявляют основные свойства, в оксиде MnO2 и гидроксиде Mn(OH)4 марганец имеет степень окисления равную +4 – это промежуточная степень окисления, поэтому эти соединения будут проявлять амфотерные свойства. Если у марганца будет степень окисления +6 или +7, то его оксиды и гидроксиды будут проявлять кислотные свойства. Это такие оксиды, как MnO3 и Mn2O7, а также их гидроксиды H2MnO4 и HMnO4.

Таким образом, с увеличением степени окисления металла происходит уменьшение радиуса иона металла, свойства оксидов и гидроксидов металлов изменяются от основных через амфотерные к кислотным.

 Получите свидетельство
Получите свидетельство Вход
Вход




 11838
11838