Как известно, из 118 химических элементов 95 относится к металлам.
В периодической системе металлы располагаются левее и ниже условной линии, проходящей от бора к астату, а также в побочных подгруппах V, VI, VII, VIII группы. К металлам относятся почти все s-элементы, кроме H, He, половина p-элементы, d- и f-элементы (лантаниды и актиниды).
Металлы s- и p-семейства – это металлы главных подгрупп, а d- и f-семейства – это металлы побочных подгрупп.
У большинства атомов металлов на внешнем энергетическом уровне содержится небольшое число (до 3) электронов, только у некоторых p-элементов, как Sn, Pb, Bi, Po их больше (4-6). Валентные электроны атомов металлов слабо связаны с ядром, что и отличает их от атомов неметаллов. Кроме этого, атомы металлов имеют сравнительно большие радиусы атомов и небольшую электроотрицательность.

Поэтому металлы относительно легко отдают электроны другим атомам, выступая в химических реакциях только в качестве восстановителей и превращаясь при этом в положительно заряженные катионы.
У металлов побочных подгрупп с увеличением заряда ядра радиус атома изменяется незначительно, так как заполняется предвнешний энергетический уровень. Поэтому электроны сильнее притягиваются к ядру и восстановительные свойства ослабевают.
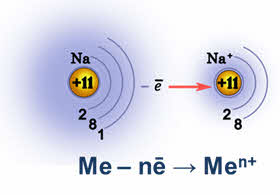
В отличие от неметаллов для атомов металлов характерны только положительные степени окисления от +1 до +8. Степень окисления металлов определяется валентными электронами внешнего и предвнешнего энергетического уровня.

Например, степень окисления натрия в соединениях только +1, у магния ― +2, а вот у марганца – элемента d-семейства – возможны степени окисления +2, +4, +6 и +7.
Чем легче атом металла отдаёт свои электроны, тем он более сильный восстановитель.
Если расположить в ряд металлы в порядке уменьшения их восстановительной способности в водных растворах, мы получим известный нам вытеснительный ряд металлов, который называется также электрохимическим рядом напряжений (или рядом активности) металлов.

К наиболее распространённым металлам в земной коре относятся алюминий (8,8%), железо (4,65%), кальций (3,38%), натрий (2,64%), калий (2,41%), магний (2,35%) остальная часть приходится на другие металлы.

Элементы, массовая доля которых в земной коре составляет менее 0,01%, называются редкими. К числу редких металлов относятся лантаниды. Если элемент не способен концентрироваться в земной коре, то есть не образует собственных руд, а встречается в качестве примеси с другими элементами, то его относят к рассеянным элементам. Это такие элементы, как Sc, Ga, In, Tl, Hf.
В 40-х годах 20 века немецкие учёные Вальтер и Ида Ноддак высказали мысль о том, что в каждом булыжнике на мостовой присутствуют все химические элементы периодической системы.
Вначале эти слова были встречены их коллегами далеко не с единодушным одобрением. Однако по мере появления все более точных методов анализа учёные всё больше убеждались в справедливости этих слов.
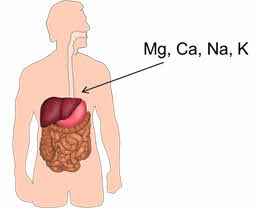
Например, в организме взрослого человека массовая доля неорганических веществ составляет 6%. Из металлов здесь присутствуют Mg, Ca, Na, K.
В составе многих ферментов, и иных биологически активных веществ в нашем организме содержатся V, Mn, Fe, Cu, Zn, Co, Ni, Mo, Cr и некоторые другие металлы.
В организме взрослого человека содержится в среднем около 140 г ионов калия и около 100 г ионов натрия. С пищей мы ежедневно потребляем от 1,5 г до 7 г ионов калия и от 2 г до 15 г ионов натрия.

Как известно, у металлов металлическая химическая связь, которая предопределяет ряд свойств металлов. При обычных условиях почти все металлы (кроме ртути) представляют собой твёрдые вещества, имеющие кристаллическое строение.
В металлическом кристалле атомы и катионы металлов располагаются в строго определённых местах пространства – узлах кристаллической решётки.

Кристаллическая решётка каждого металла имеет свою повторяющуюся во всех направлениях пространства характерную структуру – элементарную ячейку.
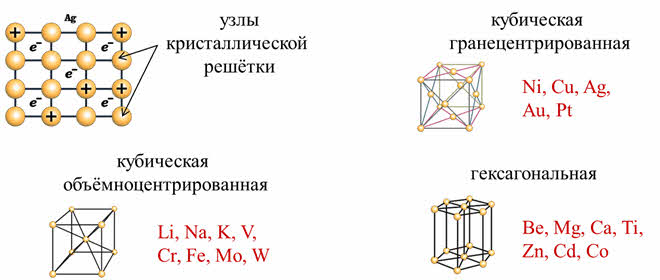
Известно много типов элементарн6ых ячеек, но наиболее распространёнными являются кубическая объёмноцентрированная, как у Li, Na, K, V, Cr, Fe, Mo, W, кубическая гранецентрированная, как у Ni, Cu, Ag, Au, Pt и гексагональная, как у Be, Mg, Ca, Ti, Zn, Cd, Co.
Для металлов характерна высокая электро- и теплопроводность, ковкость и пластичность, способность образовывать сплавы, металлический блеск.

По температуре плавления различают металлы тугоплавкие, у которых температура плавления больше 1000 0С и легкоплавкие, у которых температура плавления меньше 1000 0С. Самым тугоплавким металлом является W (3400 0C), а самым легкоплавким – Hg (-39 0C). Это свойство вольфрама позволяет использовать его в нитях ламп накаливания.

Самым электропроводным является серебро (Ag), вслед за ним идут Cu и Al.

Наиболее низкая электропроводность среди металлов у Mn. При понижении температуры электропроводность металлов возрастает, при абсолютном нуле у большинства металлов появляется сверхпроводимость.

Лучшим проводником теплоты является Ag, а худшим – Bi. Теплопроводность металлов позволяет использовать их для изготовления металлической посуды.

По твёрдости металлы очень сильно различаются. Самыми твёрдыми среди металлов являются Mo и Cr. Твёрдость щелочных металлов крайне низкая и не превышает твёрдости пластилина – их легко можно резать ножом.
По плотности металлы делят на лёгкие и тяжёлые. Если плотность металла меньше 5 г/см3, то этот металл является лёгким, если плотность металла больше 5 г/см3, то этот металл считается тяжёлым. Лёгкими считаются такие металлы, как Al, Ti, Mg, а тяжёлыми Fe, Cu, Pb, Hg.

Такое свойство металлов, как пластичность выражается в их способности деформироваться под действием механической нагрузки. Поэтому металлы можно ковать, вытягивать в проволоку, прокатывать. Наиболее пластичными металлами являются золото, серебро и медь.

Например, из золота можно изготовить фольгу толщиной 0,003 мм. Такие тонкие листы фольги можно использовать при золочении. Вспомните Янтарную комнату или изделия из золота, которые дошли до нас спустя не одно тысячелетие.

Металлы имеют металлический блеск. Наибольше светоотражающей способностью обладает ртуть, поэтому ранее её использовали для изготовления знаменитых венецианских зеркал.

В настоящее время для изготовления зеркал, прожекторов и фар используют алюминий, палладий и серебро, потому что они имеют также высокую светоотражающую способность и неядовиты, в отличие от ртути.
Многие металлы в порошке теряют блеск и приобретают чёрную или серую окраску, только магний и алюминий сохраняют её. Поэтому алюминий используют для изготовления краски «серебрянка».

Большинство металлов имеют серебристо-белый цвет, только золото имеет жёлтый цвет, а медь – красный цвет, а стронций – светло-жёлтый.

Некоторые металлы, в зависимости от условий, могут кристаллизоваться в двух и более кристаллических формах. Такое явление называется полиморфизмом (аллотропия).
Например, белое олово, или β-олово устойчиво при температуре 13,2 0С, серое олово, или α-олово, устойчиво при температуре ниже 13,2 0С.
Железо имеет четыре кристаллические модификации: α, β, γ, δ.
Металлы также отличаются и по их отношению к магнитному полю: металлы ферромагнитные – намагничиваются, как никель и α-железо, парамагнитные – слабо намагничиваются – это алюминий, хром и диамагнитные, которые не притягиваются к магниту, а отталкиваются – это олово и медь.
Для d-элементов характерно образование ковалентных связей, как для вольфрама, молибдена, хрома, осмия, поэтому они тугоплавкие, твёрдые и тяжёлые.
Поэтому, по степени близости физических, химических свойств выделяют группы металлов: щелочные и щелочноземельные.
Познание человеком металлов своими корнями уходит в глубокую древность. Полагают, что первыми металлами. С которыми столкнулся человек и которые он начал использовать на практике, были медь, золото и серебро.

Причина заключается в том, что именно эти металлы встречаются в природе в самородном состоянии и легко могли быть случайно найдены нашими предками. Древние медные изделия были найдены при раскопках на Анатолийском плоскогорье в Турции и датируются 6,5 – 5,5 тыс. лет до н.э.
Одним из наиболее важных этапов в использовании человеком металлов стало освоение процесса получения железа из его природных руд. Но для получения железа из руд необходима высокая температура, поэтому получать железо стали примерно к 1500 г до н. э.
История открытия алюминия связана с фамилией А. Маргграфа, который в 1754 году получил оксид алюминия из «квасцовой земли».

А. Маргграф
(1709 – 1782 гг.)
Только в 1825 году в виде металла алюминий был получен Г. Эрстедом. В то время стоимость алюминия превышала стоимость золота из-за чрезвычайной сложности его получения.
Таким образом, атомы металлов всегда выступают в химических реакциях в качестве восстановителей, заряд ядра атома, радиус атома оказывает влияние на восстановительные свойства металлов, в вытеснительном ряду металлов их восстановительная активность уменьшается слева направо, в отличие от неметаллов для атомов металлов характерны только положительные степени окисления. Для металлов характерна металлическая химическая связь, которая определяет физические свойства металлов.

 Получите свидетельство
Получите свидетельство Вход
Вход




 5888
5888