Исследуем электропроводность уксусной кислоты.
Уксусная кислота – слабый электролит, поэтому электропроводность невысокая. При разбавлении раствора водой электропроводность увеличивается.
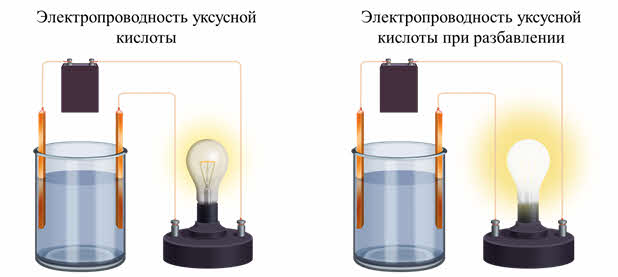
Как же изменяется электропроводность раствора при увеличении концентрации? Например, при растворении хлорида натрия в воде ионы двигаются хаотично, при увеличении концентрации раствора ионов становится больше. Движение ионов становится затруднённым, поэтому электропроводность уменьшается.

Свойства электролитов – это свойства образующих их ионов.
А если вещества имеют одни и те же ионы? Сходны ли они по свойствам?
Раствор каждого вещества обладает определёнными свойствами. Обычно, в растворах электролитов преобладают ионы, на которые диссоциируют электролиты, поэтому свойства растворов – это свойства данных ионов.
В растворах кислот всегда присутствуют гидратированные ионы водорода.

Общие свойства щелочей определяют гидроксид-ионы.

При смешивании щёлочи и кислоты получим соль. Свойства растворов солей обусловлены катионами металлов и анионами кислотных остатков.

Кислоты – это электролиты, при диссоциации которых в качестве катионов образуются только катионы водороды.
Составим уравнение электролитической диссоциации азотной, серной и сернистой кислоты. Азотная и серная кислоты являются сильными электролитами, поэтому они диссоциируют полностью с образованием катионов водорода и анионов кислотных остатков.

Сернистая кислота – двухосновная кислота и является слабым электролитом, поэтому диссоциирует ступенчато.

Число ступеней диссоциации зависит от основности кислоты. У сернистой кислоты будет две ступени диссоциации. Первая ступень диссоциации – отщепление одного иона водорода. На второй ступени диссоциации идёт отщепление иона водорода от сложного гидрокарбоната иона.

Обнаружить ионы водорода в растворах кислот можно с помощью индикаторов. Лакмус в растворах кислот меняет фиолетовый цвет на красный, метилоранж оранжевый цвет – на красный.

Кислоты вступают в химические реакции с металлами, стоящими в ряду активности до водорода. Например, в реакции цинка с соляной кислотой образуется соль – хлорид цинка и водород.

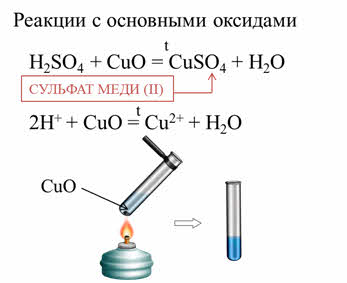
Кислоты реагируют с основными оксидами с образованием солей и воды. Так, в реакции серной кислоты с оксидом меди два образуется соль – сульфат меди два и вода.
Кислоты реагируют с основаниями. В реакции соляной кислоты со щёлочью – гидроксидом калия образуется соль – хлорид калия и вода.
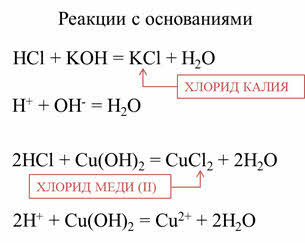
В реакции соляной кислоты с гидроксидом меди два образуется соль – хлорид меди два и вода.
Кислоты также реагируют с солями, образованными более слабыми кислотами. Например, в реакции соляной кислоты с карбонатом натрия образуется соль – хлорид натрия, углекислый газ и вода.

Таким образом, свойства кислот обусловлены наличием в их растворах катионов водорода.
Основания – это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид-ионы.
Составим уравнение электролитической диссоциации гидроксида калия и гидроксида кальция. Эти вещества являются сильными электролитами и дисоциируют полностью по одной ступени. При диссоциации этих оснований образуются катионы металлов и гидроксид-ионы.

Слабые многокислотные основания диссоциируют ступенчато и число ступеней диссоциации определяется кислотностью слабого основания.

Так, у слабого двухкислотного основания гидроксида железа два две ступени диссоциации. На первой ступени отщепляется один гидроксид-ион, а на второй ступени отщепляется гидроксид-ион от сложного катиона.

Присутствие растворимых оснований – щелочей в растворах обнаруживается при помощи индикаторов.
Фенолфталеин в растворах щелочей малиновый, лакмус – синий, а метиловый оранжевый – жёлтый.

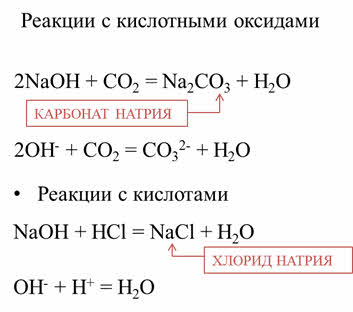
Щёлочи – активные вещества. Они реагируют с кислотными оксидами. Так, в реакции гидроксида натрия с оксидом углерода четыре образуется соль – карбонат натрия и вода, в реакциях щелочей с кислотами образуется также соль и вода. Например, в реакции гидроксида натрия с соляной кислотой образуется соль – хлорид натрия и вода.
Щёлочи также реагируют с солями. Например, в реакции гидроксида калия с хлоридом меди два образуется нерастворимое основание – гидроксид меди два и соль – хлорид калия.

Таким образом, свойства щелочей обусловлены наличием в их растворах гидроксид-ионов.
Амфотэрные гидроксиды – это слабые электролиты, которые при диссоциации образуют одновременно катионы водорода и гидроксид-ионы, то есть они диссоциируют по типу кислоты и по типу основания.
К амфотэрным гидроксидам относятся гидроксид бериллия, гидроксид цинка, гидроксид олова два, гидроксид алюминия, гидроксид хрома три и другие.
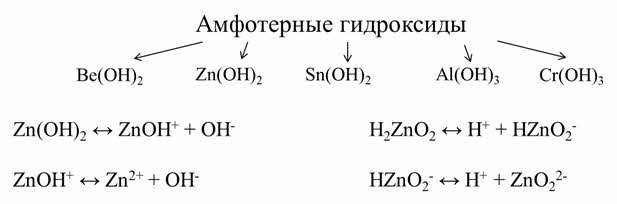
В амфотэрных гидроксидах имеются связи между атомами металла и кислорода и между атомами кислорода и водорода. Эти связи сравнимы по своей прочности. Поэтому может происходить как разрыв связей между металлом и кислородом с образованием гидроксид-ионов (это диссоциация по типу основания), так и разрыв связей между кислородом и водородом с образованием катионов водорода (это диссоциация по типу кислоты).
Соли – это электролиты, при диссоциации которых образуются катионы металлов и анионы кислотных остатков.
Средние соли – сильные электролиты, образующие при диссоциации катионы металла и анионы кислотного остатка. Например, при диссоциации карбоната калия образуются катионы калия и карбонат-ионы, при диссоциации сульфата алюминия образуются катионы алюминия и сульфат-ионы.

Кислые соли – сильные электролиты, диссоциирующие на катион металла и сложный анион, в состав которого входят атомы водорода и кислотный остаток.

Так, при диссоциации гидрокарбоната натрия на первой ступени образуется катион натрия и гидрокарбонат-ион, на второй ступени гидрокарбонат-ион частично диссоциирует на катион водорода и карбонат-ион.
Основные соли – это электролиты, которые при диссоциации образуют анионы кислотного остатка и сложного катиона, состоящего из атомов металла и гидроксогруппы.
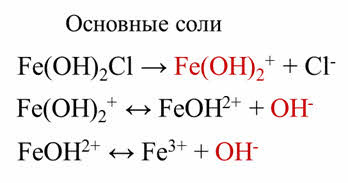
Например, при диссоциации дигидроксохлорида железа три на первой ступени диссоциации образуется сложный катион и хлорид-ион. Затем сложный катион частично диссоциирует с образование гидроксид-иона.
Свойства солей обусловлены способностью катионов металлов и анионов кислотных остатков связываться с ионами, противоположными по заряду, с образованием осадков, то есть нерастворимых солей и оснований или более слабых кислот.
Соли реагируют с металлами более активными, чем металлы, образующие соли. Так, в реакции сульфата меди два с железом образуется соль – сульфат железа два и медь.

Соли также реагируют с кислотами, которые являются более сильными, чем те, которые входят в состав соли. Например, в реакции карбоната калия с азотной кислотой образуется соль – нитрат калия, углекислый газ и вода.

Соли реагируют с другими солями. При этом в реакцию должны вступать две растворимые соли. Так, в реакции хлорида бария с сульфатом натрия образуется соль – сульфат бария в виде осадка и соль – хлорид натрия.

Соли реагируют и со щелочами. Например, в реакции хлорида железа три и гидроксида натрия образуется осадок – гидроксид железа три и соль – хлорид натрия.

Таким образом, свойства солей обусловлены наличием в их растворах катионов металлов и анионов кислотных остатков, их образующих.
Следовательно, свойства растворов электролитов обусловлены ионами, образующимися при их диссоциации. Свойства кислот обусловлены ионами водорода, образующимися при диссоциации кислот, свойства оснований обусловлены гидроксид-ионами, а свойства солей обусловлены катионами металла и анионами кислотного остатка, которые образуются при диссоциации солей.

 Получите свидетельство
Получите свидетельство Вход
Вход




 3691
3691

