Природная вода при всём её многообразии не бывает химически чистой. В ней растворены различные вещества. Всё, что мы называем обычной водой на самом деле – водные растворы.

При изучении проводимости водных растворов было обнаружено, что некоторые из них проводят электрический ток.
Вещества, растворы и расплавы которых проводят электрический ток, называются электролитами. К электролитам относятся соли, кислоты, основания. В этих веществах имеются ионные или ковалентные сильно полярные химические связи.
Неэлектролитами называются вещества, растворы и расплавы которых не проводят электрический ток. К ним относятся вещества, у которых ковалентные неполярные, или малополярные связи. Например, кислород, водород, многие органические вещества: сахар, эфиры, бензол и другие.
Какова же природа проводимости растворов электролитов?
Для объяснения этого в 1877 году Свантэ Аррениусом была предложена теория электролитической диссоциации.

С. Аррениус
(1859–1927)
Согласно этой теории электролиты обладают способностью при растворении или расплавлении диссоциировать, то есть распадаться на заряженные частицы – ионы.

Ионы – это атомы или группы атомов, имеющие положительный или отрицательный заряд. Ионы бывают простыми, которые состоят из одного вида атомов (например, ион натрия, магния, серы, хлора) и сложными, которые состоят из атомов разных видов (нитрат-ион, ион аммония, сульфат-ион, фосфат-ион).

В растворе или расплаве электролитов ионы движутся хаотически. При пропускании через раствор или расплав электрического тока положительные ионы движутся к отрицательно заряженному электроду – катоду, а отрицательно заряженные ионы движутся к положительно заряженному электроду – аноду. В растворе любого электролита общая сумма зарядов катионов равна общей сумме зарядов анионов, поэтому растворы электролитов электронейтральны.
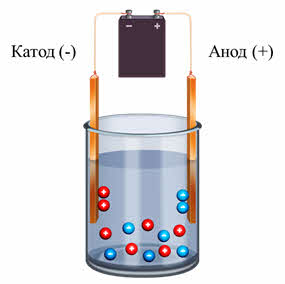
В чём же суть процесса распада электролита на ионы?
Раствор неэлектролита, например сахара, не проводит электрический ток. В отличие от него, раствор поваренной соли, проводит электрический ток.

Как происходит при этом процесс диссоциации?
Кристаллическая решётка хлорида натрия состоит из ионов натрия и хлора. Притяжение между этими ионами обеспечивает устойчивость кристалла.

Чтобы разрушить кристаллическую структуру соли и перевести ионы в раствор необходимо затратить энергию, превышающую энергию кристаллической решётки.
Вода – универсальный растворитель. Она активно участвует в процессе диссоциации. Молекула воды соединяется с ионами в кристалле, при этом положительные полюсы молекулы воды притягиваются к хлорид-ионам, а отрицательные полюсы – к положительным ионам натрия.

В результате этого взаимодействия между молекулами растворителя и ионами электролита притяжение между ионами в кристалле ослабевает. Кристаллическая решётка разрушается и ионы переходят в раствор. Таким образом, образуются гидратированные ионы. Образование гидратированных ионов сопровождается выделением энергии, равной энергии гидратации, которая расходуется на разрушение кристаллической решётки соли.
Диссоциация соляной кислоты идёт также в результате гидратации. В результате взаимодействия дипольных молекул электролита с дипольными молекулами воды изменяется характер связи в молекуле аш-хлор: сначала связь становится более полярной, а затем переходит в ионную.

При этом соляная кислота существует в растворе только в виде положительных ионов гидроксония и отрицательных ионов хлора. Раствор соляной кислоты проводит электрический ток.

И так, основной причиной диссоциации является эффект гидратации. Взаимодействие молекул воды с ионами в кристаллической решётки и полярными молекулами электролита приводит к образованию и существованию в растворе гидратированных ионов.
Нужно помнить, что ионы по свойствам отличаются от нейтральных атомов, из которых они образовались. Так, ионы натрия и ионы хлора не взаимодействуют с водой, не имеют цвета, запаха, неядовиты. Атом натрия энергично взаимодействует с водой, хлор является газом жёлто-зелёного цвета, ядовит, сильный окислитель. Ионы имеют различную окраску. Гидратированные ионы эс и пэ-элементов обычно бесцветны: ионы водорода, натрия, калия, бария, алюминия. Некоторые ионы дэ-элементов имеют окраску: например, негидратированные ионы меди − бесцветные, а гидратированные имеют голубую окраску.
Процесс распада электролита на ионы при растворении или расплавлении называется электролитической диссоциацией (ионизацией).

О распаде молекул электролита в растворе на ионы можно судить по степени электролитической диссоциации.
Степень электролитической диссоциации (ионизации) – это отношение числа молекул, распавшихся на ионы, к общему числу растворённых молекул.
По степени электролитической диссоциации различают сильные и слабые электролиты. Растворы слабых электролитов состоят из ионов и молекул. Например, раствор уксусной кислоты. Её степень диссоциации в дэцимолярном растворе одна целая тридцать шесть сотых процента.
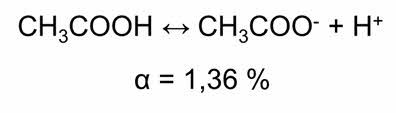
Это означает, что из десяти тысяч молекул уксусной кислоты 136 молекул распадается на ионы. Степень диссоциации зависит от природы растворителя и растворяемого вещества, концентрации раствора и температуры.

При разбавлении растворов электролитов электропроводность увеличивается за счёт усиления процесса диссоциации.
При описании свойств слабого электролита применяется закон действующих масс. Отношение произведения концентрации ионов в растворе к концентрации недиссоциировавших молекул равно константе диссоциации. Это величина постоянная и называется константой диссоциации или ионизации.

Константа диссоциации характеризует способность электролита диссоциировать на ионы. Она не зависит от концентрации раствора, но зависит от природы электролита и растворителя, а также от температуры.
Поваренная соль в растворе диссоциирует полностью, как и соляная кислота. Электролиты, растворы которых состоят из гидратированных ионов, называются сильными.

Наличие в растворе только ионов определяется высокими значениями электропроводности по сравнению с растворами слабых электролитов.
По мере концентрирования растворов сильных электролитов наблюдается уменьшение электропроводности. Создаётся впечатление, что в растворе меньше ионов.

К сильным электролитам относятся все соли, сильные кислоты: хлорная, азотная, серная, соляная, бромоводородная, йодоводородная и марганцовая кислота; щёлочи (гидроксид лития, гидроксид бария, гидроксид калия и другие). Процесс диссоциации сильных электролитов является необратимым.
Так, при диссоциации гидроксида бария образуются ионы бария и гидроксид-ионы, при диссоциации азотной кислоты образуются ионы водорода и нитрат-ионы, при диссоциации сульфата алюминия образуются ионы алюминия и сульфат-ионы.
К слабым электролитам относятся слабые кислоты (азотистая, угольная, хлорноватистая и другие), слабые нерастворимые в воде основания (гидроксид железа два, гидроксид меди два, гидроксид свинца два и другие), к слабым электролитам относится гидроксид аммония и вода. Диссоциация слабых электролитов – процесс обратимый. В растворах слабых электролитов одновременно идут процессы распада молекул на ионы (диссоциация, или ионизация) и соединение ионов в молекулы (ассоциация).
Таким образом, основные положения теории электролитической диссоциации можно представить следующим образом.
Первое. При растворении в воде электролиты диссоциируют на ионы (положительные и отрицательные). Раствор в целом остаётся электронейтральным.
Второе. Причиной диссоциации электролита является его гидратация, то есть взаимодействие электролита с молекулами воды и разрыв химической связи в нём.
Третье. Под действием электрического тока положительные ионы движутся к катоду, а отрицательные ионы – к аноду.
Четвёртое. Электролитическая диссоциация – это процесс обратимый для слабых электролитов.
Электролиты являются составной частью жидкостей и плотных тканей живых организмов. Они играют большое значение в физиологических и биохимических процессах.

 Получите свидетельство
Получите свидетельство Вход
Вход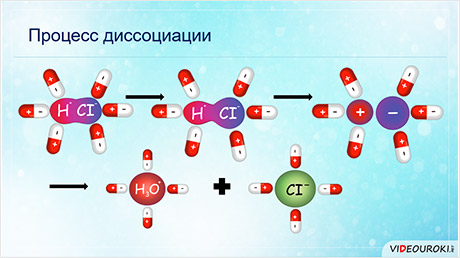




 5488
5488

