Растворы представляют собой гомогенные, или однородные системы переменного состава, которые содержат два или несколько компонентов. Растворы могут быть жидкими, газообразными (смесь газов: воздух), твёрдыми (сплавы металлов).

Наиболее распространены жидкие растворы. Они состоят из растворителя (жидкости) и растворённых веществ (газообразных, жидких, твёрдых).

Жидкие растворы могут быть водные и неводные. Водные растворы – это растворы, в которых растворителем является вода. Неводные растворы – это растворы, в которых растворителями являются другие жидкости (бензол, спирт, эфир).
Растворы – это не просто смеси частиц растворителя и растворённого вещества. Растворение представляет собой сложный физико-химический процесс. Происходит разрушение структуры растворяемого вещества и распределение его частиц между молекулами растворителя.
В этом заключается физическая сторона процесса растворения. Одновременно происходит взаимодействие молекул растворителя с частицами растворённого вещества, в этом состоит химическая сторона процесса растворения.

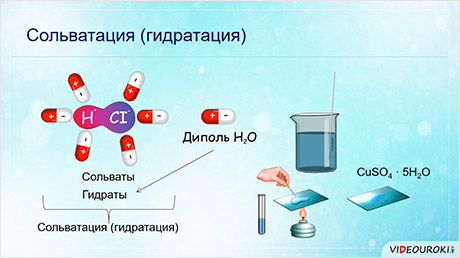
В результате этого взаимодействия образуются сольваты. Если растворителем выступает вода, то образовавшие сольваты называются гидратами. Сам этот процесс называется сольватацией, а если растворитель вода, то гидратацией.

Гидраты некоторых веществ можно выделить в кристаллическом виде при выпаривании растворов.

Например, при растворении в воде сульфата меди (II) происходит его диссоциация на ионы, эти ионы взаимодействуют с молекулами воды, при выпаривании раствора образуется кристаллогидрат сульфата меди (II) – СuSO4 · 5H2O.
CuSO4 → Cu2+ + SO42-
Cu2+ + SO42- + 5H2O → Cu2+ · 4H2O + SO42- · H2O
Эти кристаллические вещества, содержащие молекулы воды, называются кристаллогидратами. Вода, входящая в их состав, называется кристаллизационной. CuSO4 · 5H2O, Na2SO4 · 10H2O (глауберова соль), Na2CO3 · 10H2O (кристаллическая сода), FeSO4 · 7H2O (железный купорос), CaSO4 · 2H2O (гипс).

Впервые идею о химическом характере процесса растворения высказал Д. И. Менделеев в 1887 году в разработанной им химической (гидратной) теории растворов: «Растворы суть химические соединения, определяемые силами, действующими между растворителем и растворённым веществом».
Ещё алхимики заметили, что подобное растворяется в подобном. Взаимная растворимость веществ тем выше, чем ближе их химическая природа. Например, уксусная кислота хорошо растворима в воде, а масло в воде не растворяется.

Доказательством физико-химического характера процесса растворения являются тепловые эффекты при растворении, то есть выделение или поглощение теплоты. При растворении разрушаются химические связи между частицами вещества и образование связей между частицами растворённого вещества и растворителя.
Тепловой эффект растворения равен сумме тепловых эффектов физического и химического процессов. Физический процесс протекает с поглощением теплоты, а химический – с выделением.
Q (растворения) = -Q (разрыв химических связей) + Q (образование химических связей)
Если в результате гидратации выделяется больше теплоты, чем её поглощается, при разрушении структуры вещества, то растворение – экзотермический процесс. Выделение теплоты наблюдается при растворении NaOH, H2SO4, AgNO3.

Если для разрушения структуры вещества необходимо больше теплоты, чем её выделяется при гидратации, то растворение – эндотермический процесс. Это происходит при растворении в воде NaNO3, KCl, NH4Cl.
Одни вещества хорошо растворяются в воде, другие – плохо.
Если раствор содержит максимальное количество растворяемого вещества при данной температуре, то такой раствор называется насыщенным.
Если в растворе меньше растворенного вещества, чем в насыщенном, то этот раствор является ненасыщенным.

Количественной характеристикой растворимости является коэффициент растворимости. Он показывает, какая максимальная масса вещества может раствориться в 100 г растворителя при данной температуре.
По растворимости все вещества делятся на 3 группы: хорошо растворимые (в которых растворимость вещества больше 1 г на 100 г воды: сахар, уксусная кислота, гидроксид натрия, аммиак), малорастворимые (в которых растворимость вещества меньше 1 г на 100 г воды: гипс, бензол, кислород), практически нерастворимые (растворимость их меньше одной тысячной грамма на 100 г воды: хлорид серебра (I)).
Растворимость вещества зависит от природы растворителя, от природы растворённого вещества, температуры, давления (для газов).
Растворимость газов при повышении температуры уменьшается, при повышении давления – увеличивается. Растворимость многих твёрдых веществ при повышении температуры увеличивается.
Зависимость растворимости вещества от температуры можно определить по кривым растворимости.

По ним можно
также определить массу растворённого вещества, которое выпадает в осадок при
охлаждении раствора. Например, если приготовить насыщенный при 50  раствор нитрата
калия в 100 г воды, а затем охладить его до 20
раствор нитрата
калия в 100 г воды, а затем охладить его до 20  , то по кривой растворимости
видно, что из раствора выпадает 80 г – 30 г = 50 г соли.
, то по кривой растворимости
видно, что из раствора выпадает 80 г – 30 г = 50 г соли.
Процесс выпадение твёрдого вещества из раствора при понижении температуры называется кристаллизацией. Кристаллизация играет огромную роль в природе: приводит к образованию минералов, имеет большое значение в процессах, протекающих в почве.
Для качественной характеристики растворов используются понятия «разбавленный раствор», который содержит мало растворённого вещества, и «концентрированный раствор», в котором много растворенного вещества.

Количественный состав раствора выражается различными способами. Это массовая доля растворённого вещества, которая равна отношению массы растворённого вещества к массе раствора:

где ω – массовая доля растворённого вещества, m (в-ва) – масса растворённого вещества, m (р-ра) – масса раствора.
Например, если в растворе массой 200 г содержится растворённое вещество массой 40 г, то его массовая доля равна 40 г/200 г = 0,20, или 20 %.
Массовая доля – величина безразмерная, выражается или в долях единицы, или в процентах.
Массу раствора часто находят по произведения объёма раствора на плотность.

где V – объём раствора, мл, ρ – плотность раствора, г/мл.
Количественный состав раствора можно выразить также молярной концентрацией. Молярная концентрация показывает число молей растворённого вещества в одном литре раствора.

где, С – молярная концентрация, моль/л; n – количество растворённого вещества, моль; V – объём раствора, л.
Например, в растворе объёмом 4 л содержится гидроксид натрия массой 1,6 г. Нужно рассчитать молярную концентрацию гидроксида натрия в врастворе. Количество вещества гидроксида натрия будет равно отношению массы к молярной массе. Находим молярную массу гидроксида натрия. Она равна 40 г/моль. Подставляем это значение и находим количество вещества гидроксида натрия. Получаем 0,04 моль. Находим молярную концентрацию гидроксида натрия в растворе. Для этого количество вещества делим на объём раствора, получаем 0,01 моль/л.

Если молярная концентрация раствора 1 моль/л, то его называют одномолярным, или молярным, если молярная концентрация раствора 0,5 моль/л, то его называют полумолярным, 0,1 моль/л – децимолярным, 0,01 моль/л – сантимолярным, а 0,001 моль/л – миллимолярным.

Решим задачу. Плотность раствора серной кислоты с массовой долей кислоты 20% равна 1,15 г/мл. Вычислите молярную концентрацию серной кислоты в растворе. Предположим, что объём раствора равен 1 л. Сначала находит массу раствора. Для этого нужно умножить объём раствора на плотность. 1000 мл умножаем на 1,15 г/мл, получаем 1150 г. Вычисляем массу растворённого вещества, для этого умножаем массу раствора на массовую долю, получаем 230 г. Затем находим количество вещества серной кислоты: делим массу на молярную массу, так как молярная масса серной кислоты 98 г/моль, получаем 2,35 моль. Определяем молярную концентрацию серной кислоты в растворе, для этого 2,23 моль делим на 1 л, получаем 2,35 моль/л.

Ещё одним способом выражения состава растворов является массовая концентрация вещества в растворе – титр.
Массовая концентрация вещества в растворе (Т) (г/мл) – это величина, численно равная отношению массы растворённого вещества к объёму раствора.
T =  .
.
Например, определим массовую концентрацию азотной кислоты в растворе, в котором массовая доля азотной кислоты равна 15%, а плотность раствора составляет 1,012 г/мл.
Предположим, что объём раствора равен 1 л. Находим массу этого раствора, для этого нужно объём раствора умножить на плотность, получаем 1012 г. Вычисляем массу растворённого вещества в этом растворе: умножим массу раствора на массовую долю вещества, получаем приблизительно 152 г. А теперь определяем и массовую концентрацию азотной кислоты в растворе: делим массу вещества на объём раствора, получаем 0,152 г/мл.


 Получите свидетельство
Получите свидетельство Вход
Вход




 6212
6212

