Концентрация ионов водорода и гидроксид-ионов в воде и в любом водном растворе взаимосвязаны. Увеличение концентрации ионов водорода (например, при добавлении кислоты) вызывает уменьшение концентрации гидроксид-ионов и наоборот.

Растворы, в которых концентрация ионов водорода равна концентрации гидроксид-ионов, называется нейтральным. Если концентрация ионов водорода больше, чем гидроксид-ионов, то среда в растворе кислотная, если концентрация ионов водорода меньше, чем гидроксид-ионов, то раствор щелочной.
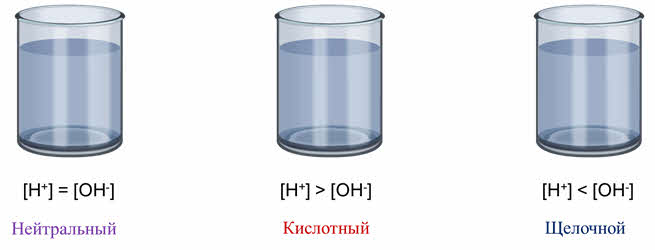
Как известно, молекулы воды диссоциируют на катионы водорода и гидроксид-ионы в соотношении один к одному.

Для воды выведена константа диссоциации, которая равна произведению концентрации ионов водорода и гидроксид-ионов, делённое на концентрацию воды. Эта константа равна одной целой восьми десятым на десять в минус шестнадцатой степени.

Константа диссоциации является постоянной величиной для данной температуры и называется ионным произведением воды.
Ионное произведение воды равно десяти в минус четырнадцатой степени. Если обозначить концентрацию ионов водорода и гидроксид-ионов за икс, то икс в квадрате равен десяти в минус четырнадцатой степени, корень из икса равен десяти в минус седьмой степени. Следовательно, концентрация ионов водорода и гидроксид-ионов равна десяти в минус седьмой степени моль на литр.

Однако выражать такими цифрами концентрацию ионов неудобно, поэтому применяют водородный показатель – пэ аш, который численно равен показателю степени концентрации (десятичному логарифму), взятому с противоположным знаком.
Понятие «водородный показатель» было введено датским химиком Сёренсеном в 1909 году. Буква пэ – начальная буква датского слова «потэнц», что означает сила, а буква аш – это символ водорода.

С. Сёренсен
(1868–1939)
Логарифм – это то, в какую степень нужно возвести десять, чтобы получить десять в минус седьмой степени, следовательно, десятичный логарифм десяти в минус седьмой степени равен мину семи.

Поэтому отрицательный десятичный логарифм концентрации ионов водорода в воде равен минус семи, значит пэ аш воды равно семи, то есть пэ аш воды является нейтральным. В ней одинаковая концентрация ионов водорода и гидроксид ионов.

Если пэ аш раствора меньше семи, то среда считается кислой, если пэ аш больше семи, то среда щелочная.

Приведём несколько примеров, как через пэ аш найти концентрацию ионов водорода. Если пэ аш равно четырём, то концентрация ионов водорода десять в минус четвёртой степени моль на литр, то есть одна десяти тысячная моль на литр, если пэ аш равно семи, то концентрация ионов водорода – десять в минус седьмой степени, то есть концентрация ионов водорода равна одной миллионной моль на литр.
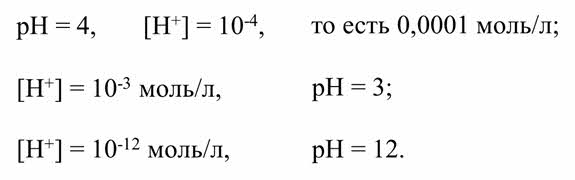
И наоборот, если концентрация ионов водорода равна десять в минус третьей степени моль на литр, то пэ аш равно трём, если концентрация ионов водорода десять в минус двенадцатой степени моль на литр, то пэ аш равно двенадцати.
Величина пэ аш играет большую роль в промышленности, химических и биохимических процессах. Большинство из них могут протекать только при определённой кислотности среды. Например, для нормального развития растений необходимо уменьшить повышенную кислотность почв их известкованием. На молочных комбинатах свежесть молока определяется также величиной пэ аш.
В человеческом организме различные жидкости имеют различную величину пэ аш. Желудочный сок – одна целая семь десятых (это сильнокислотная среда), кровь – семь целых четыре десятых (слабощелочная среда), слюна – шесть целых девять десятых, слёзы имеют пэ аш равный семи (это нейтральная среда). Величина пэ аш является показателем состояния здоровья человека.

Величина пэ аш измеряется в лаборатории при помощи индикаторов, их окраска потом сравнивается со специальной пэ-аш-шкалой.

В научных исследованиях, в производственной практике величину пэ аш определяют с помощью специальных приборов, которые называются пэ-аш-метры.

Разберём некоторые примеры решения задач.
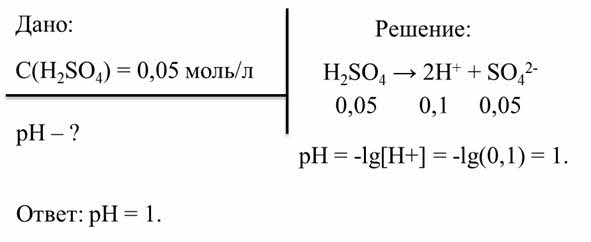
Первая задача. Принимая, что серная кислота диссоциирует в растворе на ионы полностью, определите пэ аш её ноль целых пяти сотых моль на литр раствора.
По условия задачи нам дана молярная концентрация серной кислоты. Определить необходимо пэ аш раствора. Серная кислота – это сильный электролит, который полностью диссоциирует с образованием ионов водорода и сульфат-ионов. Так как концентрация серной кислоты ноль целых пять сотых моль на литр, то концентрация ионов водорода будет в два раза больше, то есть ноль целых одна десятая моль на литр. Находим пэ аш раствора серной кислоты. Величина пэ аш – это отрицательный десятичный логарифм концентрации ионов водорода. Концентрация ноль целых одна десятая моль на литр – это десять в минус первой степени. Поэтому пэ аш раствора равен единице.
Задача вторая. Водородный показатель раствора гидроксида натрия равен двенадцати. Определите концентрацию гидроксида натрия в растворе. По условию задачи нам дан пэ аш раствора, а найти нужно концентрацию гидроксида натрия. Гидроксид натрия – это сильный электролит, который диссоциирует на катионы натрия и гидроксид-ионы. Так как сумма пэ аш и пэ –о-аш равна четырнадцати, то пэ-о-аш равно двум. Отсюда находим концентрацию гидроксид-ионов, учитывая, что пэ-о-аш – это отрицательный десятичный логарифм гидроксид-ионов. То есть если пэ-о-аш равен двум, то концентрация гидроксид ионов равна десяти в минус второй степени, а именно одной сотой моль на литр. По уравнению диссоциации видно, что концентрация гидроксид-ионов будет равна концентрации гидроксида натрия. Следовательно, концентрация гидроксида натрия равна одной сотой моль на литр.

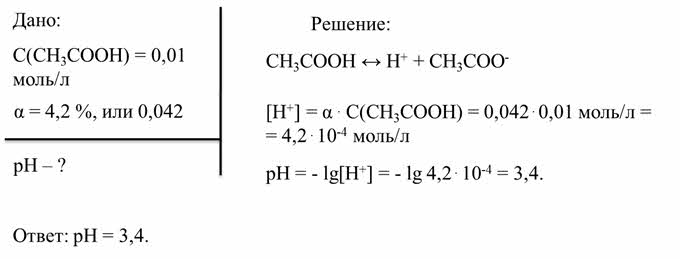
Разберём пример более сложной задачи. Уксусная кислота была единственной, которую знали древние греки. Отсюда и ее название: "оксос" - кислое, кислый вкус. Уксусная кислота - слабая (диссоциирует в водном растворе только частично). Тем не менее, поскольку кислотная среда подавляет жизнедеятельность микроорганизмов, уксусную кислоту используют при консервировании пищевых продуктов, например, в составе маринадов. Установлено, что в сантимолярном растворе уксусной кислоты степень диссоциации составляет четыре целых две десятых процента. Рассчитайте пэ аш этого раствора.
По условию задачи нам дана концентрация уксусной кислоты и степень её диссоциации. Найти нужно пэ аш раствора.
Так как уксусная кислота является слабым электролитом, концентрация ионов водорода равна произведению концентрации уксусной кислоты на степень её диссоциации. Получаем концентрацию ионов водорода равную четырём целым двум десятым на десять в минус четвёртой степени моль на литр. Затем определяем пэ аш. Для этого берём отрицательный десятичный логарифм концентрации ионов водорода, получаем три целых четыре десятых.

 Получите свидетельство
Получите свидетельство Вход
Вход




 5762
5762

