Вода является не только универсальным растворителем, но и активным реагентом, способным разлагать растворяемые вещества, действуя на них как кислота. Например, при гидролизе хлорида фосфора пять образуется фосфорная кислота и соляная кислота. При гидролизе сульфида железа три образуется гидроксид железа три и сероводород.
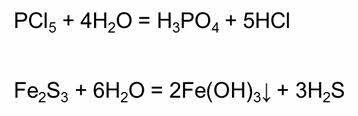
Гидролиз – это взаимодействие солей с молекулами воды, в результате которого образуется слабый электролит. Слово «гидролиз» происходит от греческих слов: «гидро» -- вода и «лизис» -- разложение. Гидролиз в переводе с греческого – «разложение водой».
Опыт показывает, что растворы средних солей могут иметь не только нейтральную среду, но и кислую, и щелочную, хотя в их составе нет ионов, обуславливающих такую среду. Эти факты объясняются взаимодействием солей с водой и это взаимодействие идёт по обменному механизму.
Так как соли в растворе находятся в виде ионов, то естественно, что с водой взаимодействуют именно ионы. Любую соль можно представить, как продукт процесса нейтрализации кислоты и основания.
Необходимым условием протекания реакции гидролиза является образование слабого электролита – слабой кислоты или слабого основания.
По теории гидролиза выделяют четыре типа солей:
Первый тип: это соль, образованная сильным основанием и сильной кислотой (гидролиз в данном случае не идёт, реакция среды нейтральная). К таким солям относятся: хлорид натрия, сульфат калия, нитрат кальция, йодид бария, бромид цэзия.
Второй тип солей – это соли, образованные сильным основанием и слабой кислотой (гидролиз идёт, реакция среды щелочная). К таким солям относятся: цианид калия, ацэтат натрия, нитрит бария, карбонат рубидия.
К третьему типу солей относятся соли, образованные слабым основанием и сильной кислотой (гидролиз этих солей идёт, реакция среды кислотная). К таким солям относятся: хлорид меди два, бромид аммония, сульфат железа два, нитрат марганца два, йодид кобальта.
К четвёртому типу солей относятся соли, образованные слабым основанием и слабой кислотой (в данном случае идёт необратимый гидролиз, реакция среды нейтральная). К таким соям относятся: сульфид аммония, ацэтат меди два, цианид аммония.

Рассмотрим пример: цианид калия: калий – металл, который входит в состав основания – гидроксида калия, а это сильное основание, цианид – кислотный остаток циановодородной кислоты – это слабая кислота, следовательно, гидролиз будет идти по аниону.

Таким образом, гидролизу подвергаются только растворимые соли, в состав которых входит либо катион слабого электролита, либо анион слабого электролита.
В зависимости от состава соли определяют реакцию среды.
Гидролиз – процесс обратимый.
Количественно гидролиз характеризуется степенью гидролиза.

Степень гидролиза зависит от природы соли, концентрации раствора, температуры. При разбавлении раствора, а также при повышении температуры степень гидролиза увеличивается.
Разберём примеры гидролиза солей.
Например, гидролизу подвергается нитрат аммония. Эта соль образована слабым основанием – гидроксидом аммония и сильной азотной кислотой. При диссоциации этой соли образуются ионы аммония и нитрат-ионы.
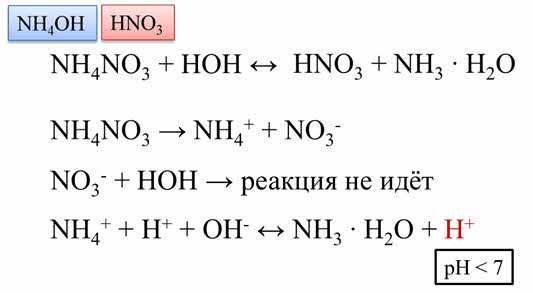
Из двух образовавшихся ионов нитрат-ионы взаимодействовать с водой не будут, потому что продуктом такого взаимодействия был бы сильный электролит – азотная кислота.
Поэтому гидролиз идёт по катиону. Ионы аммония при взаимодействии с водой образуют слабый электролит.
При этом высвобождаются ионы водорода, которые обуславливают кислую среду, следовательно, пэ аш раствора меньше семи, лакмус в растворе будет иметь красный цвет.
Таким образом, если гидролизу подвергается соль, образованная слабым основанием и сильной кислотой, то образуется слабый электролит – основание и реакция среды будет кислотная.
Рассмотрим гидролиз нитрита натрия. Эта соль образована сильным основанием – гидроксидом натрия и слабой азотистой кислотой. При растворении в воде эта соль диссоциирует на ионы натрия и нитрит-ионы.
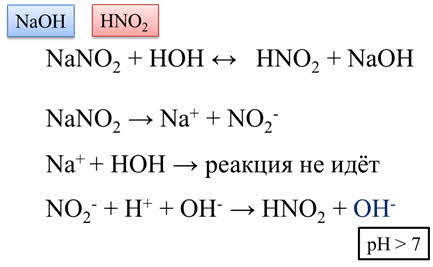
Из этих двух образовавшихся ионов ионы натрия взаимодействовать с водой не будут, так как продуктом такого взаимодействия был бы гидроксид натрия, который является слабым электролитом. Значит, гидролиз будет идти по аниону.
Нитрит-ионы при взаимодействии с водой образуют слабый электролит – азотистую кислоту.
В результате, освободившиеся гидроксид-ионы обуславливают щелочную среду, пэ аш раствора будет больше семи, лакмус в растворе этой соли будет синим.
Таким образом, если гидролизу подвергается соль, образованная сильным основанием и слабой кислотой, то в результате реакции образуется слабый электролит – слабая кислота и среда раствора будет щелочная.
Разберём гидролиз цианида аммония. Эта соль образована и слабым основанием – гидроксидом аммония и слабой циановодородной кислотой. При диссоциации этой соли образуются ионы аммония и цианид-ионы.

Гидролиз будет идти и по катиону, и по аниону. С водой реагирует и ион аммония с образованием слабого электролита и цианид-ион с образованием слабой кислоты. В растворе будут и ионы водорода, и гидроксид-ионы, поэтому реакция среды будет нейтральной.
Таким образом, если гидролизу подвергается соль, образованная слабым основанием и слабой кислотой, то образуются слабые электролиты – слабое основание и слабая кислота, пэ аш среды будет равно семи.
Если же соль образована и сильным основанием, и сильной кислотой, то она гидролизу не подвергается.

Рассмотрим гидролиз солей, содержащих многозарядные катионы и анионы.

Например, соль – хлорид алюминия образована слабым основанием и сильной кислотой. Между молекулами воды и катионами алюминия идёт взаимодействие с образованием сложного иона.
Гидролиз по второй и последующим ступеням практически не происходит из-за накопления в растворе ионов водорода.
Если возьмём пример гидролиза карбоната натрия, то гидролиз будет идти по аниону. Причём гидролиз по второй ступени практически не происходит из-за накопления в растворе гидроксид-ионов.
Таким образом, гидролиз соли – это обменное взаимодействие соли с водой, приводящее к образованию слабодиссоциирующих частиц. Соли, образованные сильным основанием и сильной кислотой, в реакции гидролиза не вступают. Продукты гидролиза и реакция среды раствора зависит от состава солей.

 Получите свидетельство
Получите свидетельство Вход
Вход




 6309
6309


