Конспект урока химии по теме: «Закон Авогадро. Молярный объем газов», 8 класс
учителя высшей категории МБОУ «СОШ № 37» города Чебоксары Чувашской Республики Грачевой Галины Вениаминовны.
Цель сформулировать закон Авогадро, ввести понятие молярного объема газов; вывести формулу для вычисления
количества вещества с использованием молярного объема газов;
рассмотреть решения задач с использованием объема газов
при нормальных условиях.
Задачи: образовательная: научить вычислять объём газов по известной массе,
количеству одного из реагентов или продуктов реакции;
развивающая: уметь применять и преобразовывать формулы для решения
решения задач;
воспитательная: воспитывать интерес к химии как науке, через примеры,
связанные с жизнью.
Тип урока: комбинированный.
Методы объяснительно-иллюстративные, репродуктивные,
обучения: частично-поисковые, практические.
Ход урока
Организационный этап
Проверяю готовность учащихся к уроку.
Проверка домашнего задания
Провожу анализ контрольной работы (устно).
Актуализация опорных знаний
Беседа
В каких агрегатных состояниях может находиться вещество?
Охарактеризуйте газообразное состояние вещества (не имеют собственной поверхности и собственного объема, принимают полностью объем сосуда)
— Как влияет на физическое состояние газов изменение температуры?
Как влияет на физическое состояние газов изменение давления?
Какие три количественные характеристики используют для измерения веществ?
Мотивация
При решении задач мы часто находим количество вещества или массу газообразных веществ (кислорода, азота, углекислого газа и других газов). Пересчитать количество молекул практически невозможно, но и взвесить газы на практике очень трудно. Для измерения газов принято использовать объемы. Итак, необходимо выяснить, как связаны между собой количество вещества и объем.
Сообщаю тему урока и прошу учеников сформулировать цель урока.
IV. Изучение нового материала
1. Закон Авогадро.
Рассказываю.
Итак, нас интересует, как связаны между собой объем газов и количество молекул, содержащихся в этом объеме? Этим вопросом заинтересовался в начале XIX столетия итальянской ученый Амедео Авогадро. После многочисленных экспериментов с газообразными веществами он в 1814 году сформулировал свой закон, который со временем получил название закона Авогадро:
В равных объемах любых газов, которые находятся в одинаковых условиях (температура и давление), содержится одинаковое число молекул.
С современной точки зрения это утверждение довольно легко объясняется. Как и большинство твёрдых и жидких веществ, газы состоят из отдельных молекул. Но в отличие от твердых и жидких веществ, в которых молекулы расположены очень плотно друг к другу, в газах молекулы расположены на больших расстояниях друг от друга. Эти расстояния значительно больше собственных размеров молекул. И хотя молекулы разных газов отличаются друг от друга размерами, формой и объемом, этими отличиями можно пренебречь, и рассматривать их как жесткие крошечные шарики.
Молекулы газа постоянно находятся в состоянии беспорядочного (хаотичного) движения и сталкиваются друг с другом с определенной частотой. Но при этом среднее расстояние между молекулами газа постоянно и зависит только от условий, в которых находится газ. Если разные газы находятся в одинаковых условиях (температура и давление), то расстояния между молекулами приблизительно одинаковы, и потому в одинаковых объемах должно содержаться одинаковое число молекул.
Следует акцентировать внимание учеников на том, что этот закон справедлив только для идеальных газов и не применяется для жидкостей.
Коллективно обсуждаем
Согласно закону Авогадро, в равных объемах разных газов при одинаковых условиях содержится равное число молекул. Какая еще величина характеризуется равным числом частичек? (Ответ: моль.)
Учитель предлагает объединить эти два суждения. Необходимо прийти к выводу о том, что 1 моль любого газа при одинаковых условиях занимает одинаковый объем. Это первое следствие, которое вытекает из закона Авогадро.
Как можно назвать объем 1 моль газа по аналогии с молярной массой?
Каким будет молярный объем любого газа при одинаковых условиях?
Молярный объем — это физическая величина, которая равняется отношению объема вещества к его количеству.
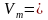
При нормальных условиях молярный объем любого газа составляет приблизительно 22,4л/моль.
Зная молярный объем газа, можно определить количество вещества л, которое содержится в объеме V при нормальных условиях:
v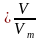 Vт = 22,4 л/моль.
Vт = 22,4 л/моль.
Если мы знаем, что в одном моле вещества содержится такое количество молекул, которое равняется числу Авогадро, то можем вычислить число молекул газа в определенном объеме при нормальных условиях:
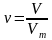 ; N
; N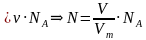
Задача 1. Вычислите объем и массу азота при нормальных условиях количеством вещества 1,2 моль.
Дано:
v (N2) = 1,2моль
V (N2) —?
m(N2) - ?
Решение:
V=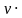 Vт=1,2 моль
Vт=1,2 моль  22,4 л/моль = 26,88 л.
22,4 л/моль = 26,88 л.
m = v M = 1,2
M = 1,2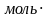 28 г/моль=33,6 г
28 г/моль=33,6 г
Ответ: V(N2) = 26,88 л
m(N2) = 33,6 г
Задача 2. Вычислите количество вещества, которое содержится при нормальных условиях в 5,6 л водорода.
Решение:
Дано:V(H2) = 5,6 л.
v (H2) —? v = 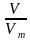 =
= 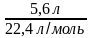 = 0,25 моль
= 0,25 моль
Задача 3. Вычислите число атомов и число молекул хлора, которые содержатся в 16,8 л хлора (при н.у.).
Дано:
V(Cl2) = 16,8л.
N (Cl2) - ?
N (Cl) —?
Решение: v (Cl2) = 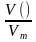 =
= 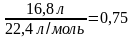 моль
моль
N (Cl2) = v  NА
NА 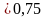 моль
моль  6,02
6,02 1023 моль-1=
1023 моль-1=
4.5  1023 (молекул)
1023 (молекул)
Каждая молекула хлора содержит в своем составе два атома хлора, поэтому число атомов будет вдвое больше числа молекул хлора:
N (Cl) = 2  N (Cl2) = 2
N (Cl2) = 2 4,5
4,5  1023 = 9
1023 = 9  1023.
1023.
Ответ: N(Cl2) = 4,5  1023 , N(Cl) = 9
1023 , N(Cl) = 9  1023.
1023.
Задача 4. Вычислите массу одного литра угарного газа (н.у.). Вычислите число молекул угарного газа и число атомов углерода и кислорода.
Дано: Решение
V(CО) = 1 л. Вычислим количество вещества угарного газа,
N (CO) - ? содержащегося в 1 литре:
N (О) —? v (CO) = 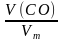 =
= 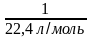 = 0,0446 моль
= 0,0446 моль
m (CO) - ? Масса такого количества угарного газа будет
N(C) - ? равняться:
Mr (СO) = 12 + 16 = 28
M(CO) = = 28 г/моль
m(CO) = v (CO)  M(CO) = 0,0446 моль
M(CO) = 0,0446 моль  28 г/моль = 1,25 г.
28 г/моль = 1,25 г.
N(CO) = v = 0,0446 моль
 6,02
6,02 1023 моль -1= 2,68
1023 моль -1= 2,68  1022
1022
v (С) = v(O)= v(СO)= 0,0446 моль
N(C) = N(O) = N(CO) = 2,68  1022
1022
Ответ: m(CO) = 1,25 г; N(C) = N(O) = 2,68  10 22 атомов; N(CO) = 2,68
10 22 атомов; N(CO) = 2,68  1022 молекул.
1022 молекул.
Закрепление знаний и умений обучающихся.
Вычислите объем, который занимают при нормальных условиях: а) азот количеством вещества 0,25 моль; б) фтор количеством вещества 0,2 моль; в) углекислый газ количеством вещества 0,3 моль; г) водород количеством вещества 5 моль.
Вычислите количество вещества, которое содержится при нормальных условиях в: а) 4,48 л кислорода; б) 11,2 л азота; в) 5,6 л водорода; г) 2,24 л аммиака.
Домашнее задание:
Выучить параграф 38, зад. 1,2,3
Подведение итогов урока.
Предлагаю ученикам определить важнейшие понятия, которые изучались на уроке, а также проанализировать результаты своей деятельности на уроке и оценить свои умения решать задачи с использованием понятия «молярный объем газов».
Задача 1. Рассчитайте количество вещества, массу и объем кислорода, образовавшегося при разложении 15,8 г перманганата калия.
Задача 2. Вычислите число молекул в 27 г воды, число атомов водорода и число атомов кислорода.
Задача 3. Вычислите плотность и относительную плотность по водороду, по кислороду и по воздуху.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Закон Авогадро. Молярный объем газов. (37.27 KB)
Закон Авогадро. Молярный объем газов. (37.27 KB)
 0
0 1246
1246 41
41 Нравится
0
Нравится
0









