Задания внутришкольной олимпиады по химии для 10 класса с решением.
Уважаемые участники олимпиады!
Вам предлагаются выполнить:
Задание 1. – 10 тестовых заданий с одним правильным ответом. Выберите ответ и занесите букву в лист ответов.
Задание 2. – Решить 4 текстовых задач. Решение с пояснением записывается в тетради.
Задание 3. – Осуществить цепочку превращений.
Внимание! Черновики не проверяются!
Работа рассчитана на 2 часа.
Желаем успеха.
Задание 1
1. Несколько аллотропных модификаций образует каждое вещество в паре:
а) хлор и кислород; б) азот и углерод; в) сера и магний; г) фосфор и сера.
2. Ион, имеющий в своем составе 18 электронов и 16 протонов, обладает зарядом, равным: а) + 18; б) - 18; в) + 2; г) – 2.
3. Степень окисления хрома в ионе Cr2O72- равна:
а) +2; б) +4; в) +6; г) +7.
4. Прочность связи в ряду молекул F2, O2, N2 увеличивается, потому что:
а) увеличивается валентный угол; б) увеличивается радиус атомов;
в) увеличивается число связей в молекуле; г) уменьшается электроотрицательность атомов.
5. Углеводород состава С5Н10 может быть гомологом:
а) этана; б) пентина-1; в) 2-метилбутена -2; г) циклогексана.
6. В соответствии с сокращенным ионным уравнением
Cu2+ + 2OH- =Cu(OH)2 взаимодействуют:
взаимодействуют:
а) CuSO4 и Mg(OH)2; б) CuSO3 и NaOH; в) CuSO4 и Ba(OH)2; г) CuCl2 и Ba(OH)2.
7. Наибольшую плотность (н.у.) имеет:
а) бутан; б) бромоводород; в) пентан; г) сероводород.
8. В кристаллогидрате Na2CO3*n H2O массовая доля безводной соли составляет 31,7%. Значение n равно:
а) 5; б) 7; в) 10; г) 12.
9. При растворении в виде оксида Mn2O7 образуется:
а) соль; б) кислота; в) оксид; г) основание.
10. Элемент образует оксид Э2О5, его водородное соединение содержит 3,85% водорода. Этим элементом является:
а) Р; б) V; в) As; г) Sb.
Задание 2
Задача №1. Неизвестный алкен массой 7 г присоединяет бромоводород, объём которого одинаков с объёмом метана массой 2 г (н.у.).
А) Найдите молекулярную формулу алкена.
Б) Напишите структурные формулы его изомеров и укажите их название.
Задача №2. В заливе Кара-Богаз-Гол Каспийского моря находятся богатейшие запасы минерала мирабилита – кристаллогидрата сульфата натрия. Каждый год в конце ноября, когда температура воды падает до 6 °С, вода оказывается насыщенной сульфатом натрия, и мирабилит начинает выделяться в виде бесцветных кристаллов, оседающих на дно залива и на его берегах. Эти кристаллы содержат в своем составе соль и воду.
Для определения формулы мирабилита растворили 3,22 г минерала в воде. К полученному раствору прилили избыток раствора хлорида бария. Выпавший осадок был отфильтрован, промыт и взвешен. Его масса оказалась равной 2,33 г.
А) На основе химического анализа определите формулу минерала мирабилита. Запишите уравнение реакции.
Б) Назовите полученный кристаллогидрат по систематической номенклатуре.
В) Рассчитайте число атомов водорода в порции кристаллогидрата химическим количеством 2 моль.
Задача №3. Цинк массой 13г сплавили с серой массой 3,2 г. Затем к смеси добавили избыток соляной кислоты.
А) Определите суммарный объем выделившихся газов.
Б) Определите молярную массу смеси газов.
Задача №4. При действии избытка воды на сплав натрия и калия общей массой 0,85 г выделилось 336 см3 газа.
А) Найти массовые доли металлов в смеси.
Б) Сколько атомов натрия приходится на один атом калия в этом сплаве?
Задание 3.
Составьте уравнения следующих химических превращений:
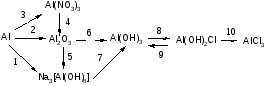
Не все переходы одностадийные!
Ответы
Общее количество баллов 50 . Тест – 10, задание 2 –30, задание 3 – 10.
Задание 1. За каждый правильный ответ 1 балл. Максимально 10 баллов.
Тесты.
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
| г | г | в | в | в | г | б | в | б | в |
Задание 2. Максимально за все задания баллов 30.
Задача №1. Максимально 8 баллов.
Неизвестный алкен массой 7 г присоединяет бромоводород, объём которого одинаков с объёмом метана массой 2 г (н.у.). А) Найдите молекулярную формулу алкена. (3 балла). Б) Напишите структурные формулы его изомеров и укажите их название. (5 баллов)
| Решение |
| А) По условию задачи V(HBr) = V(CH4), тогда по закону объемных отношений газов n(HBr) = n(CH4) = 2 / 16 = 0,125 моль (1 балл). Формула алкена СnH2n, тогда уравнение реакции CnH2n + HBr → CnH2n+1Br (1 балл). По уравнению реакции n(CnH2n) = n(HBr) = 0,125 моль. Молярная масса алкена 7 / 0,125 = 56 г/моль. Определим «n» в формуле CnH2n. Определим «n» в формуле CnH2n: 12n + 2n = 56, n = 4. Молекулярная формула алкена С4Н8. (1 балл) Б) Изомеры: бутен-1, 2-метилпропен-1, цис-бутен-2 или транс-бутен-2, циклобутан, 2-метилциклопропан. За структурные формулы -0,5 балла, за название -0,5 баллов.
|
Задача №2. Максимально 7 баллов.
В заливе Кара-Богаз-Гол Каспийского моря находятся богатейшие запасы минерала мирабилита – кристаллогидрата сульфата натрия. Каждый год в конце ноября, когда температура воды падает до 6 °С, вода оказывается насыщенной сульфатом натрия, и мирабилит начинает выделяться в виде бесцветных кристаллов, оседающих на дно залива и на его берегах. Эти кристаллы содержат в своем составе соль и воду.
Для определения формулы мирабилита растворили 3,22 г минерала в воде. К полученному раствору прилили избыток раствора хлорида бария. Выпавший осадок был отфильтрован, промыт и взвешен. Его масса оказалась равной 2,33 г.
А) На основе химического анализа определите формулу минерала мирабилита. Запишите уравнение реакции (4 балла).
Б) Назовите полученный кристаллогидрат по систематической номенклатуре (1 балл).
В) Рассчитайте число атомов водорода в порции кристаллогидрата химическим количеством 2 моль (2 балла).
Решение.
А) Na2SO4·xH2O + BaCI2 = 2NaCI + BaSO4↓ + xH2O (1балл)
ν(BaSO4) = ν(Na2SO4·xH2O) = 0,01 моль
М(Na2SO4·xH2O) = 3,22/0,01 = 322 г/моль
М(Na2SO4) = 142 г/моль
Разность молярных масс составляет 322–142 = 180
Х = 180г / 18г/моль = 10 моль
Формула мирабилита Na2SO4·10H2O (3балла)
Б) декагидрат сульфата натрия(1балл)
В) N(H)=Na*n=6,02*1023*2*20=240,8*1023=2,408*1021 атомов (2 балла)
Задача №3. Максимально 8 баллов.
Цинк массой 13г сплавили с серой массой 3,2 г. Затем к смеси добавили избыток соляной кислоты. А) Определите суммарный объем выделившихся газов (6 баллов). Б) Определите молярную массу смеси газов (2 балла).
Решение.
А) 1. Определим химические количества вступивших в реакцию веществ: n(Zn)=0,2 моль, n(S)=0,1 моль. Решаем по недостатку. Находим химическое количество сульфида цинка и химическое количество избыточного цинка: n(ZnS)=0,1 моль, причем химическое количество цинка равно 0,2-0,1=0,1 моль.
| х | 0,1 | у |
| Zn+ | S= | ZnS |
| 1 | 1 | 1 |
(1 балл за уравнение реакции, по 0,5 баллов за химическое количество сульфида цинка и оставшегося после реакции цинка)- всего 2 балла
При обработке конечной смеси избытком соляной кислоты протекают следующие реакции:
| 0,1 |
|
| х |
| ZnS + | 2HCl= | ZnCl2 | +H2S |
| 1 |
|
| 1 |
х=0,1 моль
| 0,1 |
|
| у |
| Zn + | 2HCl= | ZnCl2 | +H2 |
| 1 |
|
| 1 |
у=0,1 моль. (1 балл за уравнение реакции) - всего 2 балла.
Найдем объем выделившихся газов V=n*Vm=(0,1+0,1)*22,4=4,48 дм3 (2балла)
Б) Молярная масса смеси газов будет равна М(смеси)= 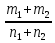 = =
= =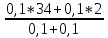 =18г/моль ( 2 балла)
=18г/моль ( 2 балла)
Задача №4. Максимально 7 баллов.
При действии избытка воды на сплав натрия и калия общей массой 0,85 г выделилось 336 см3 газа.
А) Найти массовые доли металлов в смеси (6 баллов).
Б) Сколько атомов натрия приходится на один атом калия в этом сплаве? (1 балл).
| Решение. А) Пусть химическое количество натрия – х моль, химическое количество калия – у моль, тогда масса смеси 23х+39у=0,85г (1 балл). Химическое количество водорода 0,336/22,4=0,015 моль (1 балл). Уравнения реакций:
|
| х 0,5х 2Na + 2H2O= 2NaOH +H2↑ (0,5 балл) 1 1 |
| у 0,5у 2К + 2H2O= 2КOH +H2↑(0,5 балл). Отсюда 0,5х+0,5 у=0,015 (1 балл). Решая систему уравнений, получаем х=0,02 моль, у= 0,01 моль. Тогда m(Na)=23*0,02=0,46 г, масса калия равна 0,85-0,46=0,39 г (2 балла). Б) отношение чисел атомов натрия и калия пропорционально отношению их химических количеств: N(Na)/N(K)=0,02/0,01=2:1 (1 балл) |
Задание 3.
Составьте уравнения следующих химических превращений:

Не все переходы одностадийные!
Баллы: 1 балл за 1 уравнение = 10 баллов.
2Al + 6NaOH + 6H2O = 2Na3 [Al(OH)6] + 3H2↑
4Al +3O2=2Al2O3
Al + 6HNO3 → Al(NO3)3 + 3NO2 ↑+ 3H2O
4) 4Al(NO3)3 =2 Al2O3 + 12NO2↑+ 3O2↑
5) Al2O3 + 6NaOH + 3H2O = 2Na3 [Al(OH)6]
6) Al2O3+ 6HCl=2AlCl3+3H2O
AlCl3+3NaOH= Al(OH)3+3NaCl
7) Na3 [Al(OH)6]+ 3HCl = Al(OH)3 +3NaCl+3H2O
8) Al(OH)3+HCl= Al(OH)2Cl+ H2O
9) Al(OH)2Cl+ NaOH= Al(OH)3 + NaCl
10) Al(OH)2Cl+ 2HCl= AlCl3+ 2H2O (могут быть и другие уравнения реакций).
Источники
https://repetitors.info/library.php?b=297
2. Врублевский А.И., Тренажер по химии. 3-е изд., перераб. и доп. - Мн.: 2009. - 656 с.
3. Резяпкин, В.И.Химия: Интенсивный курс подготовки к тестированию и экзамену. Издательство: Мн: ТетраСистемс. Переплет: мягкий; 256 страниц; 2006 г.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Задания внутришкольной олимпиады по химии для 10 класса с решением (41.8 KB)
Задания внутришкольной олимпиады по химии для 10 класса с решением (41.8 KB)
 0
0 3614
3614 135
135 Нравится
0
Нравится
0


