
«Влияние противогололедных реагентов на окружающую среду.»
Работу выполнила :
Ученица 10 «К» класса
Янчева Мария
Научный руководитель:
Колесова Ирина Андреевна

СОДЕРЖАНИЕ :
- ТЕОРЕТИЧЕСКАЯ ЧАСТЬ:
- Введение :
- Актуальность проекта__________________________________________________3
- Цель проекта___________________________________________________________3
- Задачи проекта________________________________________________________3
- Целевая аудитория проекта____________________________________________3
- Механизм реализации проекта :
- Виды реагентов_________________________________________________________4
- Плюсы и минусы антигалоледных реагентов____________________________5
- Способность реагентов плавить лед при низких температурах_________7
- Коктейль из химикатов__________________________________________________7
- Отрицательные аспекты влияния реагентов на окружающий мир______8
- Борьба с реагентами__________________________________________________9
- ПРАКТИЧЕСКАЯ ЧАСТЬ:
- Приборы_______________________________________________________________10
- Ход работы_____________________________________________________________10
- Таблицы________________________________________________________________14
- Выводы_________________________________________________________________16
- Заключение _____________________________________________________________17
- Результаты проекта _____________________________________________________18
- Перспективы развития проекта _________________________________________18
- Список литературы_____________________________________________________ 19

ТЕОРЕТИЧЕСКАЯ ЧАСТЬ

Введение:
- Актуальность данного проекта : В наше время к противогололедным реагентам прибегают практически во всех городах, как больших, так и малых. В них добавляют поверхностно-активные вещества. Потому что это - практически единственный способ уменьшить количество аварий и защитить граждан от падения, а автомобили - от столкновения. Загрязнение среды антигололедными веществами оказывает прямое и косвенное влияние на живую и неживую природу. Именно поэтому вопросы оценки этих средств в настоящее время стали очень актуальными.
- Цель проекта: Основной целью проекта является исследование влияния химических реагентов на живую и неживую природу и понять можно ли заменить используемые составы на менее вредные для окружающей среды, но также помогающие бороться с гололёдом .

Введение:
- Задачи проекта:
- Изучить учебную литературу.
- Изучить виды антигололедных реагентов и понять их различия.
- Определить положительные и отрицательные аспекты влияния противогололедных реагентов на среду нашего обитания (например, зелёные насаждения вдоль дорог, лапы домашних животных, подошвы обуви).
- Предложить альтернативную замену противогололедным реагентам, проверить теорию на практике.
- Сделать выводы по проведенной работе.
- Целевая аудитория проекта: всё население.

Виды реагентов:
- Согласно постановлению правительства Москвы №570-ПП, в городе могут использоваться три типа противогололедных реагентов: реагенты жидкого, твердого и смешанного типов .
- Жидкие реагенты — это растворы твердых, а комбинированные — смесь химикатов с так называемой фрикционной частью (например, щебнем или мраморной крошкой).
- Как правило, твердые реагенты на основе технической соли и хлористого кальция могут применяться при температуре воздуха до -12ºC, а вот жидкие (например, растворы солей кальция и натрия) рекомендуется использовать до -5ºC, так как иначе они просто-напросто замерзнут и создадут на дорогах дополнительный слой льда.
- Самые распространенные твердые реагенты, которыми в России посыпают дороги, — это Бишофит – хлорид магния (MgCl2*6Н2О), хлорид кальция (СаCl2), хлорид натрия (NaCl) и ацетат калия (СН3СООК).

У этих реагентов есть и иные сферы их использования:
- Хлорид натрия — это обычная поваренная соль, которую все мы употребляем в пищу. На улицах используется хлорид натрия с низкой степенью очистки, который может содержать примеси песка или других солей — так называемая техническая соль.
- Хлорид кальция — это кальциевая соль соляной кислоты, зарегистрированная как пищевая добавка Е509. Эта добавка применяется для консервирования овощей и фруктов, для смягчения мяса, используется при ферментации молочных продуктов (например, при производстве творога).
- Хлорид магния — это неорганическое соединение, достаточно часто встречающееся в природе. В производстве продуктов питания хлорид магния выступает в качестве отвердителя и загустителя (Е511).
- Ацетат калия — это кристаллы без цвета, либо белые, обладающие вкусовыми характеристиками слабой щелочи. В сфере производства пищевых продуктов раствор калия ацетата и его кристаллы применяются в роли консервантов, а также регуляторов кислотности.

Хлорид кальция (СаCl2):
- «Плюсы»:
- быстрее и эффективнее растапливает лед и предотвращать образование гололеда
- можно использовать не только во время снегопада, но и до и после него в качестве профилактики
- проникая в почву, кальций улучшает ее состояние, а расход этого реагента и экологическая нагрузка намного ниже поваренной соли
- «Минусы»:
- непродолжительный срок действия, равный в среднем 3 часам
- на 30 процентов уменьшает коэффициент сцепления шин с дорогой
- вызывает аллергию не только у людей, но и у животных
- разъедает металл
- агрессивен по отношению к обуви из натуральных материалов
- известный своими отбеливающими свойствами, изменяет цвет обуви
Хлорид кальция
СаCl 2

Бишофит – хлорид магния (MgCl2*6Н2 О):
- «Плюсы»:
- эффективен даже при низких температурах и предотвращает образование гололеда в течение нескольких дней, что существенно сокращает нормы его расхода
- не образует скользкой пленки на дорожном покрытии при таянии льда
- способен впитывать в себя влагу из окружающей среды
- «Минусы»:
- оказывает губительное влияние на почву
- возможны аллергические реакции как у людей, так и у животных
- накапливает анионы магния в почвах и природных водах
- вызывает ожоги лап у животных
Бишофит – хлорид магния MgCl 2 *6Н 2 О

Ацетат калия (СН3СООК):
- «Плюсы»
- не теряет свои свойства даже при температуре -60 градусов
- срок его действия длится вплоть до 3-7 суток с момента нанесения.
- не вызывает коррозии металлов
- коэффициент сцепления при обработке этим реагентом остается высоким
- минеральные свойства входящих в состав веществ удобряют почву
- не разъедает резину и металл
- «Минусы»
- вызывает аллергию
- дорогой противогололедный реагент
- пагубно влияет на кожаную обувь
Ацетат калия СН 3 СООК

Хлорид натрия (NaCl):
- «Плюсы»
- самый дешевый способ борьбы с гололедом
- моментально растапливает лед
- не замерзает от 0 до 16° С и действует постоянно
- «Минусы»
- забивает водяные стоки
- загрязняет газоны
- пары солей натрия разъедают вставки электропроводов
- соль разъедает кузова, колеса автомобилей, обувь прохожих
- происходит засоление почв, погибают зеленые растения
Хлорид натрия
NaCl

Коктейль из реагентов:
- Например раствор хлористого кальция или хлористый натрий сначала превращает лед в воду, а затем происходит обратный химический процесс, гидролиз соли, в результате чего образуется малорастворимый в воде осадок. А это в свою очередь приводит не только к грязи, но и уменьшению коэффициента сцепления шин с дорожным покрытием. Кроме того, входящие в состав реагентов химические вещества вызывают неспецифические реакции кожи, слизистых и бронхов людей и животных. Обостряются заболевания у аллергиков и астматиков.
- Происходит это в первую очередь потому, что
- на дорогах реагенты смешиваются с другими веществами, источниками которых является целый ряд факторов.
- Во-первых, автомобильные покрышки выделяют значительное число химических компонентов (например, углерода или серы), кроме того, в результате трения от них отделяются мелкие каучуковые частицы, которые смешиваются с хлоридами солей натрия и кальция.
- Во-вторых, днища автомобилей обрабатываются антикоррозийными покрытиями, которые также вступают в химическую реакцию с антигололедными реагентами. Еще одним источником дополнительных химикатов служат жидкости для омывания автомобильных стекол, часть которых попадает на дорогу. Четвертым источником компонентов для химического «коктейля» является само дорожное покрытие.
- Кроме того, сам реагент — хлорид кальция или хлорид натрия — не используется в чистом виде. Хлорид служит основой реагента, к которой добавляется песок или гранитная крошка, кроме того, компоненты реагентов могут содержать примеси (магний, медь, кобальт, свинец, мышьяк, ртуть, молибден). Нетрудно представить, какая гремучая смесь веществ, вступающих в активные химические реакции между собой, попадает в почву, на нашу обувь, лапы домашних животных, а также растущие в городе растения.

Отрицательные аспекты влияния реагентов на окружающий мир:
Борьба с реагентами:
- Химические реагенты для борьбы со льдом на дорогах используются не только в России — в США и Канаде дороги посыпают хлоридом магния.
- Однако помимо агрессивных химических соединений можно использовать и другие методы борьбы со льдом: так, в Австрии, Финляндии или Швеции наряду с химикатами используется фрикционный метод: дороги посыпаются песком или каменной крошкой. Плюс этого способа в том, что никаких химических реакций не происходит, а минус заключается в недолговечности такого покрытия. Песок и крошка сдуваются с дорог ветром, разносятся колесами машин и ногами пешеходов, а также царапают обувь.
- В Швеции применяется и еще один непривычный для нас метод, названный в честь исследователя Торгейра Ваа. Ученый выяснил:
- если мелкий песок смешать с горячей (90–95ºC) водой в пропорции 7 к 3 и затем разбрызгивать эту смесь на снег и лед, то песчинки будут «вплавляться» в лед, тем самым делая поверхность шероховатой. Песок при этом не сдувается ветром, а сцепление автомобильных колес и обуви пешеходов с поверхностью увеличивается.
- Такой обработки хватает примерно на неделю (даже при достаточно интенсивном движении), затем ее необходимо повторять.
- В Норвегии пошли еще дальше — там строят автомобильные трассы с подогревом. Такой радикальный (и дорогой) метод позволяет вообще забыть о снеге и льде на дорогах. Япония также не использует для борьбы со льдом никаких средств, в том числе и теплых дорог.
- Японцы пошли по одному из самых простых путей — они просто-напросто чистят дороги. Для этой страны характерные мощные и непродолжительные снегопады, поэтому такое решение проблемы вполне эффективно.
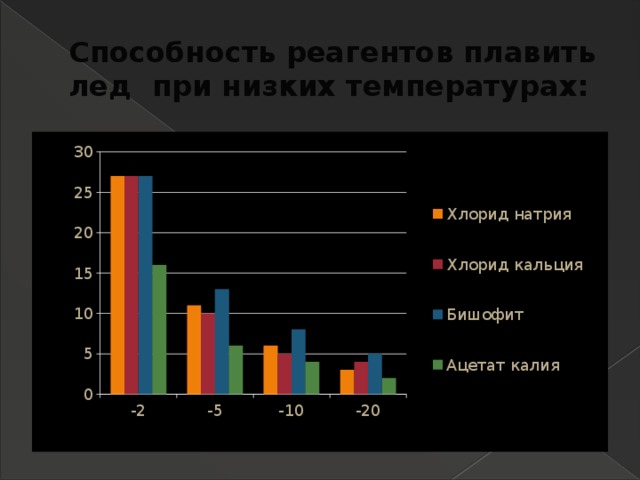
Способность реагентов плавить лед при низких температурах:

ПРАКТИЧЕСКАЯ ЧАСТЬ

ПРАКТИЧЕСКАЯ ЧАСТЬ
- При выполнении практической части мы работали с растворами реагентов, так как в реальных условиях, попадая на лед, реагенты образуют раствор, который в свою очередь эффективно расплавляет лед.
- Так же в презентации представлена тормозная колодка нового автомобиля, которая всего лишь за один сезон пришла в негодность

Приборы:
- Весы
- Мерная колба
- Четыре вида реагентов
- Кожа
- Алюминивые пластинки
- Фиалки
- Вода

Ход работы: Подготовить все необходимые приборы .

При помощи весов, воды и мерной колбы сделать концентрированные растворы реагентов.

Опустить в растворы заранее подготовленные кусочки кожи и алюминия.

С помощью тех же приборов сделать слабо концентрированные растворы реагентов.

Поливать посаженые в землю фиалки слабо концентрированными растворами реагентов.

По истечению трехнедельного срока эксперимента сделать выводы по полученным результатам.

Результаты эксперимента:
- Хлорид кальция (СаCl2):

Бишофит – хлорид магния (MgCl2*6Н2 О):

Ацетат калия (СН3СООК):

Хлорид натрия (NaCl):
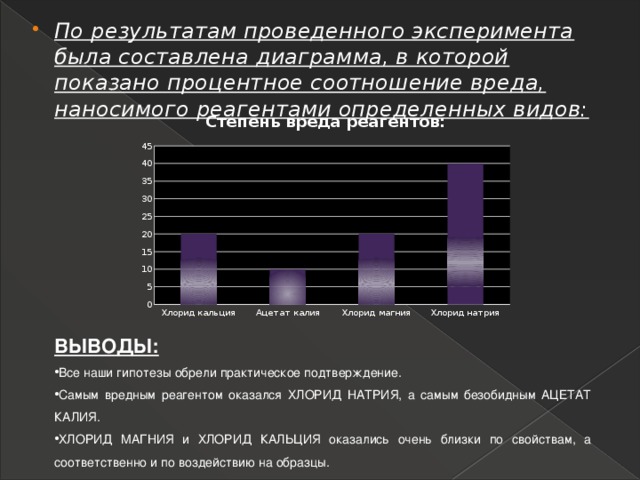
- По результатам проведенного эксперимента была составлена диаграмма, в которой показано процентное соотношение вреда, наносимого реагентами определенных видов:
ВЫВОДЫ:
- Все наши гипотезы обрели практическое подтверждение.
- Самым вредным реагентом оказался ХЛОРИД НАТРИЯ, а самым безобидным АЦЕТАТ КАЛИЯ.
- ХЛОРИД МАГНИЯ и ХЛОРИД КАЛЬЦИЯ оказались очень близки по свойствам, а соответственно и по воздействию на образцы.

ЗАКЛЮЧЕНИЕ:
- Все применяемые противогололедные средства должны удовлетворять следующим основным требованиям:
- снижать точку замерзания воды при отрицательных температурах;
- быстро взаимодействовать и плавить снежно-ледяные отложения;
- не повышать скользкость дорожного покрытия до опасных значений;
- не вызывать вредного воздействия на дорожные покрытия;
- не угнетать зеленые насаждения;
- не оказывать отрицательного влияния на металл, резину и кожу;
- быть безвредными для здоровья человека и экологии

ПЕРСПЕКТИВЫ РАЗВИТИЯ ПРОЕКТА:
- Изобретение наиболее безвредных противогололедных средств.
- Улучшение качества жизни.
- Возможность улучшения экосистемы.
- Спасение многих особей птиц и видов растений.
- Возможность улучшить экономическое положение страны, за счет уменьшения трат на дорогие и вредные реагенты.
- Внедрение новых технологий (дороги с подогревом и т. д.).
СПИСОК ЛИТЕРАТУРЫ:
- http ://stateykino.ru/publ/ehkologija/vred_reagentov/3-1-0-162
- http :// www . o 8 ode . ru / article / krie / noice / article . htm
- http://ria.ru/spravka/20121016/903105508.html
- http://www.gazeta.ru/science/2016/01/18_a_8023121.shtml
- http://carclub.ru/articles/reviews/zapret_dorozhnyh_reagentov_mif_ili_realnost.html
- http://www.autogazeta29.ru/ekspluatatciia/bezopasny-li-reagenty-dlia-dorozhnogo-dvizheniia
- http :// vesvladivostok . ru / publ / biznes / ehkonomika / bezopasny _ li _ reagenty _ dlja _ dorozhnogo _ dvizhenija /57-1-0-37174
- http ://150 gimnasium . ru / child / project /008/ site 5. html

 Получите свидетельство
Получите свидетельство Вход
Вход











 Влияние противогололедных реагентов на окружающую среду. (10.73 MB)
Влияние противогололедных реагентов на окружающую среду. (10.73 MB)
 0
0 4721
4721 99
99 Нравится
0
Нравится
0




