Материал на украинском языке.
Мета:
освітньо-виховні завдання:
створити комфортні умови навчання, за яких кожен учень відчує свою успішність, інтелектуальну спроможність, самостійність;
навчальна:
розглянути будову молекули амоніаку, його хімічні і фізичні властивості, а також його одержання і застосування, удосконалювати вміння складати рівняння хімічних реакцій;
розвиваюча: розвивати логічне мислення учнів, розвивати мовні і слухову пам’ять;
виховна:
виховувати в учнів самостійність, мислення, кмітливість;
Структура та хід уроку.
І. Організаційний момент.
1) Представлення вчителя.
2) Розподіл учнів по групах (перед уроком ви мали можливість обрати цукерку, тобто ви таким чином розподілилися по групах).
3) Давайте пригадаємо правила роботи в групах (учні називають правила).
4) Для роботи на уроці кожен з вас отримає робочий зошит, який залишиться у вас на згадку про цей урок.
- Та група, яка дасть правильну відповідь, буде отримувати по «атому».
ІІ. Повідомлення теми та мети уроку.
- Тема нашого уроку «Амоніак, його властивості та застосування». Епіграфом до уроку я обрала слова М. В. Ломоносова"Широко простягає хімія руки свої у справи людські. Куди не подивимось, куди не оглянемось скрізь обертаються перед очима нашими успіхи її старанності... . »
В кінці уроку ви зрозумієте і поясните, чому саме ці слова Михайла Васильовича Ломоносова стали епіграфом до цього уроку.
ІІІ. Вивчення нового матеріалу.
Тож розпочнемо наш урок. Ця речовина застосовується в медицині для повернення людини до свідомості, без цієї речовини знижується врожайність сільськогосподарських культур, вона є незамінною для роботи промислових холодильників, а також завдячуючи їй людство уникнуло голоду. Це – амоніак.

Отже, мета нашого уроку це ознайомлення з будовою молекули амоніаку, його фізичних та хімічних властивостей і застосування.
Отож, до роботи.
1. Будова молекули амоніаку.
Назвіть положення елементів Нітрогена та Гідрогена в ПС. За місцем положення елемента розкрийте будову атома. Запишіть електронні та графічні формули атомів (робота біля дошки). Атом Нітрогену за рахунок трьох неспарених електронів утворює три спільні електронні пари з трьома атомами Гідрогену.
При цьому зовнішній енергетичний рівень кожного з атомів став завершений. Тип зв’язку – ковалентний зв’язок (спільні електроні пари зміщенні у бік більш електронегативного атома Нітрогену). Отже, амоніак (гідроген нітрид) – бінарна сполука, летка воднева сполука.
Виходячи з електронної формули, напишемо структурну формулу.
Отже, Нітроген у леткій водневій сполуці виявляє валентність – 3.
2. Фізичні властивості амоніаку.
Історична довідка. Амоніак своєю назвою зобов’язаний оазису Амона в Північній Африці, розташованому на перехресті караванних шляхів. У жаркому кліматі сечовина (NH2) 2CO, що міститься у продуктах життєдіяльності тварин, розкладається особливо швидко. Одним із продуктів розкладання її в амоніак.
За іншими відомостями, амоніак одержав свою назву від давньогрецького слова амоніак. Так називали людей, що поклоняються богу Амону. Вони під час своїх ритуальних обрядів нюхали нашатир NH4Cl, який при нагрівання пахне амоніаком.
То які ж фізичні властивості ви можете називати?
- Газ.
- Без кольору.
- З різким специфічним запахом, токсичний.
Знайдіть у роздатковому матеріалі інформацію про дію амоніаку на людину.
(Короткочасне вдихання його в малих дозах допомагає вивести людину зі стану непритомності. Дози, що перевищують гранично допустимі (у повітрі 0, 04 мг/м3) викликають ураження очей і набряк легень, ушкоджують нервову систему).
Легший чи важчий амоніак за повітря? (Обрахунок).
Як потрібно тримати пробірку при збиранні амоніаку?
Пригадаємо правила ТБ на уроках хімії. Представники від команд підійдіть до столу та виберіть ті правила, що стосуються ТБ при роботі з амоніаком та розмістіть на плакаті.
Формулюємо правила:
- працювати в халаті;
- досліди проводити під витяжкою і т. д.
Весь материал - в документе.

 Получите свидетельство
Получите свидетельство Вход
Вход








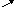 2NH3↑
2NH3↑ 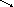 NH4Cl + Ca (OH)2 = CaCl2 + 2NH4OH
NH4Cl + Ca (OH)2 = CaCl2 + 2NH4OH 














 Урок з хімії "Амоніак, його властивості та застосування" (36.2 MB)
Урок з хімії "Амоніак, його властивості та застосування" (36.2 MB)
 0
0 956
956 121
121 Нравится
0
Нравится
0




