Тема: Валентность. Валентные возможности и размеры атомов химических элементов.
Цели урока:
Личностные: содействовать осознанию ценности совместной деятельности.
Метапредметные:
Создать условия для развития умений сравнивать, выделять главное в тексте, структурировать, общаться, слушать и вступать в диалог, планировать свою деятельность, осуществлять самоконтроль, самооценку.
Оборудование урока: маршрутные листы, текст, учебники.
Структура урока:
Организационный момент (наведение на тему урока, постановка цели урока, сообщение правил работы в группе – запись на доске). Обратить внимание на регламент времени.
Запомни и соблюдай простые правила:
Уважай своего товарища.
Умей каждого выслушать.
Не согласен – предлагай!
План действий:
Выберите лидера группы.
Обсудите пути достижения целей, распределите задания для каждого из членов группы.
Убедитесь, что члены группы понимают цели и задачи, стоящие перед ними.
Учитесь находить контакты в группе.
2.Проверка домашнего задания (работа в группе с маршрутным листом – 5 минут)
3.Изучение нового материала :
Теория –7 минут на подготовку, выполнение по маршрутному листу в группах.
По 5 минут – выступление 3 групп.
Практика – выполнение в группах 5 минут.
4.Самооценка и рефлексия. Индивидуально.
Обсуждение достижения/не достижения цели урока.
5. Домашнее задание.
Тема: _____________________________________________________________________________________________________________________
Цель: ______________________________________________________________________________________________________________________
| Проверка домашнего задания | Теория | Практика | Оценивание |
| Запишите молекулярные уравнения реакций: H2 + Cl2 =
CuO + H2 =
CuCl2+H2=
Ca+H2=
Подчеркните ошибки в тексте: Лантаноиды и актиноиды в короткой форме Периодической системы Д.И. Менделеева вынесены в три последних ряда. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4s- и 5s-подуровней. Лантаноиды не сходны по химическим свойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало сказывается на состоянии валентных электронов. В образовании химической связи 4f-электроны лантаноидов обычно не принимают участия. Электроны заполняют 5d-, а не 4f- подуровень потому, что в этом случае они обладают меньшей энергией. Благодаря этому один из 4f -электронов (а в некоторых случаях, например, у церия, два 4f--электрона) легко возбуждается, переходя на 5d-подуровень, и становится, таким образом, валентным электроном. | Напишите определение : валентность – это
Дополните схему примерами:
Постоянная Переменная
______________ _____________ Определите валентность всех элементов в соединениях, подпишите валентность:
HCl, HNO3, H3РО4, H2SO4
Объясните, составьте алгоритм определения валентности и представьте его одноклассникам
1)
2)
3)
4) | Выполните задания: Укажите 5 химических элементов, имеющих постоянную валентность
_______________________ Укажите 5 химических элементов, имеющих переменную валентность Определите валентность хим.элементов в следующих хим. соединениях: NaCl, СаSO4, СаCl2 Постройте графическую формулу серы, укажите валентные возможности атома. Количество валентностей, образуемых атомом серы.
| Оцените свою работу по разделу «Теория»: Разобрался в материал полностью, все было понятно (2б) Во время работы возникали затруднения, но к концу урока они были преодолены (1,5б) Активно принимал участие на всех этапах урока (2 б) Принимал участие не на всех этапах урока (1б) Выступал у доски (2 б) Создавал продукт (плакат, алгоритм, схему на доске, рисунок, модель) (2б) Наибольшее затруднение вызвал раздел «Проверка домашнего задания» Д.з. Наибольшее затруднение вызвал раздел «Теория» Т. Наибольшее затруднение вызвал раздел «Практика» П. Достиг ли цели урока? Фамилия, имя – количество баллов ___________________________ |
Тема: _____________________________________________________________________________________________________________________
Цель: ______________________________________________________________________________________________________________________
| Проверка домашнего задания | Теория | Практика | Оценивание |
| Запишите молекулярные уравнения реакций: H2 + Cl2 =
CuO + H2 =
CuCl2+H2=
Ca+H2=
Подчеркните ошибки в тексте: Лантаноиды и актиноиды в короткой форме Периодической системы Д.И. Менделеева вынесены в три последних ряда. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4s- и 5s-подуровней. Лантаноиды не сходны по химическим свойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало сказывается на состоянии валентных электронов. В образовании химической связи 4f-электроны лантаноидов обычно не принимают участия. Электроны заполняют 5d-, а не 4f- подуровень потому, что в этом случае они обладают меньшей энергией. Благодаря этому один из 4f -электронов (а в некоторых случаях, например, у церия, два 4f--электрона) легко возбуждается, переходя на 5d-подуровень, и становится, таким образом, валентным электроном. | Внимательно прочтите текст «Валентные возможности атома» Ознакомьтесь с графическими формулами азота и фосфора, почему фосфор может быть в нескольких валентных состояниях
Объясните на примере фосфора возможность образовывать разные валентности. (выступление у доски) Напишите графическую формулу распределения электронов в атоме кремния, укажите варианты возможной валентности. | Выполните задания: Укажите 5 химических элементов, имеющих постоянную валентность
_______________________ Укажите 5 химических элементов, имеющих переменную валентность Определите валентность хим.элементов в следующих хим. соединениях: NaCl, СаSO4, СаCl2 Постройте графическую формулу серы, укажите валентные возможности атома. Количество валентностей, образуемых атомом серы.
| Оцените свою работу по разделу «Теория»: Разобрался в материал полностью, все было понятно (2б) Во время работы возникали затруднения, но к концу урока они были преодолены (1,5б) Активно принимал участие на всех этапах урока (2 б) Принимал участие не на всех этапах урока (1б) Выступал у доски (2 б) Создавал продукт (плакат, алгоритм, схему на доске, рисунок, модель) (2б) Наибольшее затруднение вызвал раздел «Проверка домашнего задания» Д.з. Наибольшее затруднение вызвал раздел «Теория» Т. Наибольшее затруднение вызвал раздел «Практика» П. Достиг ли цели урока? Фамилия, имя – количество баллов ___________________________ |
Тема: _____________________________________________________________________________________________________________________
Цель: ______________________________________________________________________________________________________________________
| Проверка домашнего задания | Теория | Практика | Оценивание |
| Запишите молекулярные уравнения реакций: H2 + Cl2 =
CuO + H2 =
CuCl2+H2=
Ca+H2=
Подчеркните ошибки в тексте: Лантаноиды и актиноиды в короткой форме Периодической системы Д.И. Менделеева вынесены в три последних ряда. В атомах лантаноидов и актиноидов происходит заполнение соответственно 4s- и 5s-подуровней. Лантаноиды не сходны по химическим свойствам. Близость свойств соединений лантаноидов обусловлена тем, что застройка внутренней 4f-оболочки атомов мало сказывается на состоянии валентных электронов. В образовании химической связи 4f-электроны лантаноидов обычно не принимают участия. Электроны заполняют 5d-, а не 4f- подуровень потому, что в этом случае они обладают меньшей энергией. Благодаря этому один из 4f -электронов (а в некоторых случаях, например, у церия, два 4f--электрона) легко возбуждается, переходя на 5d-подуровень, и становится, таким образом, валентным электроном. | Внимательно прочтите часть параграфа «Периодические изменения валентности и размеров атомов» Составьте краткий содержательный конспект или схему (не более 6 предложений)
Объясните одноклассникам, в чем заключается ваша часть темы (выступление у доски). Используя таблицу Менделеева, напишите как изменяется (увеличивается или уменьшается ) размер атомов во А) 2 группе ПСХЭМ Б) 3 периоде ПСХЭМ | Выполните задания: Укажите 5 химических элементов, имеющих постоянную валентность
_______________________ Укажите 5 химических элементов, имеющих переменную валентность Определите валентность хим.элементов в следующих хим. соединениях: NaCl, СаSO4, СаCl2 Постройте графическую формулу серы, укажите валентные возможности атома. Количество валентностей, образуемых атомом серы.
| Оцените свою работу по разделу «Теория»: Разобрался в материал полностью, все было понятно (2б) Во время работы возникали затруднения, но к концу урока они были преодолены (1,5б) Активно принимал участие на всех этапах урока (2 б) Принимал участие не на всех этапах урока (1б) Выступал у доски (2 б) Создавал продукт (плакат, алгоритм, схему на доске, рисунок, модель) (2б) Наибольшее затруднение вызвал раздел «Проверка домашнего задания» Д.з. Наибольшее затруднение вызвал раздел «Теория» Т. Наибольшее затруднение вызвал раздел «Практика» П. Достиг ли цели урока? Фамилия, имя – количество баллов ___________________________ |
Текст 2 группа.
Валентные возможности атомов определяются числом не спаренных электроном, а так же числом не поделённых электронных пар способных переходить на свободные орбитали атома другого элемента (участвовать в образовании ковалентной связи по донорно-акцепторному механизму).
| Азот | 7 N 1s22s22p3
| У атома азота на внешнем втором уровне 1s и 3pорбитали, всего 4 орбитали, следовательно, максимально возможная валентность равна IV |
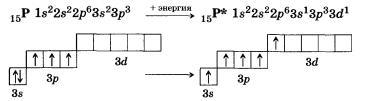
| Фосфор |
| У атома фосфора в основном (стационарном) состояниивалентность как и у азота равнаIV |
|
| У атома фосфора, в отличие от азота есть свободные d– орбитали, поэтому для фосфора характерновозбуждённое состояние, когда 3s2 электроны распариваются и валентность принимает значение V |

 Получите свидетельство
Получите свидетельство Вход
Вход




 Валентность
Валентность










 Урок "Валентность. Валентные возможности атома. Размер атомов." (52.5 KB)
Урок "Валентность. Валентные возможности атома. Размер атомов." (52.5 KB)
 0
0 1656
1656 372
372 Нравится
0
Нравится
0


