Тема урока: « Химические свойства оснований».
(8 класс)
Цель урока: изучить химические свойства растворимых и нерастворимых оснований.
Задачи:
Образовательная: повторить и закрепить полученные знания об оксидах, кислотах, солях и основаниях.
Развивающая: развивать у учащихся интерес к химии, раскрывать практическую направленность науки химии, связь ее с другими науками, развивать наблюдательность, развитие познавательных способностей, мышления, внимания, умения использовать изученный материал для познания нового.
Воспитательная: воспитание самостоятельности, сотрудничества, способности к взаимовыручке.
Тип урока: комбинированный.
Оборудование: экран, компьютер, мультимедиа проектор, учебники, рабочие тетради, тесты, CD – ROM, инструкция к лабораторном опытам №13, растворы NaOH, HCl, Ca(OH)2, CO2, FeCl3, Fe(OH)3↓свежеполученный, Cu(OH)2. индикаторы.
Методы:
Словесный (беседа, объяснение);
Практический (учащиеся выполняют лабораторные опыты)
Наглядный (демонстрационные опыты).
Форма работы: фронтальная и индивидуальная.
План урока.
Организационный момент.
Фронтальный опрос.
Проверочная тестовая работа.
Изучение нового материала.
Закрепление изученного материала.
Итог урока.
Домашнее задание.
Ход урока.
1. Организационный момент (сообщить тему, цель и план урока – слайд №1, 2).
2. Фронтальный опрос.
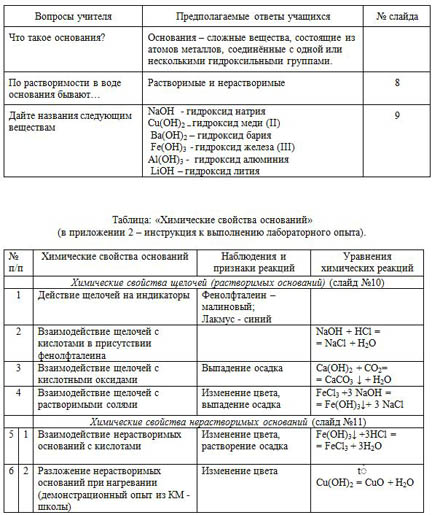
| Вопросы учителя | Предполагаемые ответы учащихся | № слайда |
| Какие классы неорганических соединений вы знаете? | Оксиды, кислоты, основания, соли | 3 |
| Что такое оксиды? | Оксиды – сложные вещества, состоящие из двух элементов одним из которых является кислород. |
|
| На какие группы делятся оксиды по химическим свойствам? | Основные, кислотные, амфотерные. |
|
| В приведённом перечне химических соединений выберите формулы оксидов и дайте им название. | FeO, CO2 , Al2O3 | 4 |
| Что такое кислоты? | Кислоты – это сложные вещества, состоящие из томов водорода и кислотных остатков. |
|
| Найдите ошибки лаборанта, допущенные им при расстановки кислот на полки. | Н3PO4 и H2S | 5 |
| Найдите ряд двухосновных кислот и дайте им название. | H2CO3 – угольная кислота; H2SiO3 – кремниевая кислота; H2S – сероводородная кислота. | 6 |
| Вставьте в уравнения химических реакций пропущенные вещества и расставьте коэффициенты. | 1) Р2O5 + 3H2O.= 2 H3PO4 2) HCl + NaOH =NaCl + H2O 3) H2SO4 + BaCl2 = BaSO4 ↓+ + 2 HCl 4) 2 HCl + Zn = ZnCl2 + H2 ↑ | 7 |
Индивидуальная карточка (учащийся работает у доски):
Задание: составьте уравнения реакций, раскрывающие схему превращений:
P→ P2O5 → H3PO4 → Na3PO4
3. Проверочная тестовая работа (приложение 1).
4. Изучение нового материала.
| Вопросы учителя | Предполагаемые ответы учащихся | № слайда |
| Что такое основания? | Основания – сложные вещества, состоящие из атомов металлов, соединённые с одной или несколькими гидроксильными группами. |
|
| По растворимости в воде основания бывают… | Растворимые и нерастворимые | 8 |
| Дайте названия следующим веществам | NaOH - гидроксид натрия Cu(OH)2 – гидроксид меди (II) Ba(OH)2 – гидроксид бария Fe(OH)3 - гидроксид железа (III) Al(OH)3 - гидроксид алюминия LiOH – гидроксид лития | 9 |
Таблица: «Химические свойства оснований»
(в приложении 2 – инструкция к выполнению лабораторного опыта).
| № п/п | Химические свойства оснований
| Наблюдения и признаки реакций | Уравнения химических реакций |
|
| Химические свойства щелочей (растворимых оснований) (слайд №10) |
| 1 | Действие щелочей на индикаторы
| Фенолфталеин – малиновый; Лакмус - синий |
|
| 2 | Взаимодействие щелочей с кислотами в присутствии фенолфталеина |
| NaOH + HCl = = NaCl + H2O |
| 3 | Взаимодействие щелочей с кислотными оксидами | Выпадение осадка | Ca(OH)2 + CO2= = CaCO3 ↓ + H2O |
| 4 | Взаимодействие щелочей с растворимыми солями | Изменение цвета, выпадение осадка | FeCl3 +3 NaOH = = Fe(OH)3↓+ 3 NaCl |
|
| Химические свойства нерастворимых оснований (слайд №11) |
| 5 | 1 | Взаимодействие нерастворимых оснований с кислотами | Изменение цвета, растворение осадка
| Fe(OH)3↓ +3HCl = = FeCl3 + 3H2O |
| 6 | 2 | Разложение нерастворимых оснований при нагревании (демонстрационный опыт из КМ - школы) | Изменение цвета
| t۫ Cu(OH)2 = CuO + H2O |
5. Закрепление изученного материала.
Задание 1 (слайд №12): С какими из перечисленных веществ будет реагировать гидроксид калия?
+ а) CO2
б) Mg(OH)2
+ в) Н2SO4
г) Cu
+ д) АlCl3
Задание 2: Предложите схему получения гашёной извести из мела.
Ответ: CaCO3 → CaO → Ca (OH)2
6. Итог урока.
Вывод: 1) основания – сложные вещества, состоящие из атомов металлов, соединённые с одной или несколькими гидроксильными группами;
2) растворимые в воде основания называются щелочами, которые получают при взаимодействии активных металлов с водой, основных оксидов (щелочных и щелочно-земельных металлов) с водой;
3) нерастворимые основания получают взаимодействием растворимых солей сo щелочами;
4) щелочи взаимодействуют: с кислотными оксидами, с кислотами, солями, изменяют цвет индикаторов;
5) нерастворимые в воде основания при нагревании разлагаются, взаимодействуют с кислотами.
7. Домашнее задание (слайд №13): подготовить
Сообщения о применении гидроксида калия или натрия, или кальция, или бария).
Приложение 1.
Тест по теме: «Оксиды и кислоты».
Вариант №1
1. Из приведённых формул выберите пару кислотных оксидов:
1) СаО, СО2 2) N2O3, N2O
3) SO2, CrO3 4) N2O5, Cu2O
2. Из приведённых формул выберите пару амфотерных оксидов:
1) SiO2, K2O 2) CuO, C12O5
3) Al2O3, ZnO 4) BaO, CrO3
3. Выберите оксид, который не растворяется в воде:
1) CO 2) СаО 3) Na2O 4) МgO
Найдите пару веществ, которая реагирует между собой:
1) Н2S и P2O3 2) СО и BaO
3) Р2О5 и SO3 4) BaO и SO2
При реакции HNO3 с раствором NaOH образуется:
1) NaNO3 2) H2O
3) NaNO3 и H2O 4) не реагируют между собой
6. Из приведённых формул выберите одноосновную кислоту:
1) HNO2 2) H2CO3 3) H2SO4 4) H3PO4
7. Найдите в приведённых формулах нерастворимую кислоту:
1) H2SiO3 2) Н2СО3 3) Н3РО4 4) H2SO3
8. Оксид, соответствующий сернистой кислоте H2SO3,
1) SO3 2) СO2 3) S2O3 4) SO2
9. Выберите вещество, с которым реагирует соляная кислота:
1) СаО 2) NO 3) SO2 4) SiO2
10. Закончите фразу: оксиды – это ….
Тест по теме: «Оксиды и кислоты».
Вариант №2
1. Из приведённых формул выберите пару основных оксидов:
1) СuО, СаО 2) FeO, СО
3) Мn2О7, К2О 4) Li2O, N2O
Из приведённых формул выберите пару несолеобразующих оксидов:
1) СО, N2O 2) CuO, NO
3) СО, СО2 4) N2O, N2O5
Из приведённых формул выберите оксид, который взаимодействует с водой:
1) SiО2 2) Сu2О 3) СrО3 4) MgO
4. Между собой реагируют пара веществ:
1) СuО и FeO 2) СО2 и СаО 3) Р2О3 и NO 4) СrО3 и SO2
5. При реакции SO2 с H2O образуется:
1) H2SO3 2) H2SO4 3) SO3 4) H2S2O7
6. Из приведённых формул выберите трёхосновную кислоту:
1) H2SO4 2) H3PO4 3) H2S 4) HCl
7. Из приведённых формул выберите летучую кислоту:
1) H2SO4 2) H2SiO3 3) H3PO4 4) H2S
8. Найдите оксид, соответствующий марганцовой кислоте НМnО4:
1) МgО 2) МnО2 3) Мn2О7 4) МnО
9. Цинк вытесняет водород из следующей кислоты:
1) НNO3(разб.) 2) НNО3(конц.)
3) H2SO4(paзб.) 4) H2SO4(kohц.)
![]() 10. Закончите фразу: кислоты – это ….
10. Закончите фразу: кислоты – это ….
Тест по теме: «Оксиды и кислоты».
Вариант №3
1. Закончите фразу: основания – это ….
2. Из приведённых формул выберите пару основных оксидов:
1) СrО, ВаО 2) FeO, NO
3) N2O3, Na2O 4) К2O, С12O
3. Из приведённых формул выберите оксид, который не растворяется в воде:
1) СO2 2) SiO2 3) N2O3 4) SO2
4. Между собой реагируют пара веществ:
1) СаО и SiO2 2) СuО и Na2O 3) N2O5 и CrO3 4) FeO и MgO
5. При реакции Zn с раствором HCl образуется:
l) ZnCl2 2) ZnCl2 и H2 3) H2 4) реакция не может протекать
6. Из приведённых формул выберите бескислородную кислоту:
1) H2SO4 2) H2S 3) PH3 4) HNO3
7. Из приведённых формул выберите трёхосновную кислоту:
1) Н2СО3 2) H2SO4 3) H3PO4 4) НСl
8. Оксид, соответствующий хромовой кислоте Н2СrO4,
1) СrО3 2) СrО 3) Сr2О3 4) СrO2
9. Из приведённых формул выберите пару растворимых в воде оксидов:
l) SiO2, K2O 2) CuO, Cl2O5
3) СO2, MgO 4) CaO, Mn2O7
10. Соляная кислота не реагирует с:
1) Сu 2) Zn 3) Na 4) Fe
Тест по теме: «Оксиды и кислоты».
Вариант №4
1. Из приведённых формул выберите пару несолеобразующих оксидов:
1) NO, Na2O 2) NO, CO
3) NO2, N2O 4) СO2, СаО
2. Из приведённых формул выберите пару кислотных оксидов:
1) Сr2О3, СO2 2) N2O5, CO 3) SiO2, CrO3 4) N2O, C12O7
3. Оксид, который взаимодействует с водой:
l) CuO 2) FeO 3)СO 4) СO2
4. Между собой реагирует пара веществ:
1) Na2O и FeO 2) NO и ВаО 3) Р2О5 и Na2O 4) С12O и SO2
5. При реакции SO3 с раствором H2O образуется:
l) H2S 2) H2SO4 3) H2SO3 4) H2S2O7
6. Бескислородсодержащая кислота — это
1) H2S 2) HC1O3 3) NH3 4) H2SiO3
7. Нерастворимая в воде кислота — это:
1) H2SO3 2) H2SiO3 3)H2CO3 4)H2S
8. Оксид, соответствующий азотистой кислоте HNO2:
1) N2O5 2) N2O3 3) N2O 4) NO
9. Соляная кислота реагирует с
1) Сu 2) Zn 3) Ag 4) Hg
10. Закончите фразу: соли – это ….
Приложение 2.
Инструкция
Лабораторный опыт №13.
Химические свойства оснований.
Задание 1. Испытайте действие растворов щелочей на различные индикаторы.
Задание 2. Проведите реакцию нейтрализации между раствором гидроксида натрия и раствором соляной кислотой в присутствии индикатора.
Задание 3. Определение известковой воды с помощью углекислого газа. (Пропустите через трубочку, опущенную в пробирку с гидроксидом кальция, углекислый газ, который образуется при вашем дыхании. Что вы наблюдаете?)
Задание 4. Проведите реакцию обмена между раствором гидроксида натрия и раствором хлорида железа (III).
Задание 5. Проведите реакцию обмена между гироксидом железа (III) и раствором соляной кислоты (в пробирку, содержащую осадок - гидроксида железа (III) (опыт №4) прилейте несколько капель раствора соляной кислоты).
Задание 6. В ходе выполнения лабораторного опыта заполните
таблицу №1: «Химические свойства оснований».
| № п/п | Химические свойства оснований
| Наблюдения и признаки реакций | Уравнения химических реакций |
|
| Химические свойства щелочей (растворимых оснований) |
| 1 | Действие щелочей на индикаторы
|
|
|
| 2 | Взаимодействие щелочей с кислотами
|
|
|
| 3 | Взаимодействие щелочей с кислотными оксидами
|
|
|
| 4 | Взаимодействие щелочей с растворимыми солями
|
|
|
|
| Химические свойства нерастворимых оснований |
| 5 | 1 | Взаимодействие нерастворимых оснований с кислотами
|
|
|
| 6 | 2 | Разложение нерастворимых оснований при нагревании
|
|
|

 Получите свидетельство
Получите свидетельство Вход
Вход












 Урок химии "Химические свойства оснований" (0.13 MB)
Урок химии "Химические свойства оснований" (0.13 MB)
 0
0 1106
1106 105
105 Нравится
0
Нравится
0


