
Уравнение состояния, газовые законы
Учитель физики Иноземцева Татьяна Николаевна

Уравнение состояния идеального газа
Цели урока:
- 1.Вспомнить: а) основное содержание МКТ;
- б) что такое идеальный газ;
- 2. Понятие состояния идеального газа
- 3. Газовые законы

Основные положения МКТ
Теория М.В. Ломоносова получила название
корпускулярной . Молекула – корпускула, частица;
атом - наименьшая часть химического элемента, являющаяся носителем его основных свойств.
- Все вещества состоят из молекул (ныне из атомов) .
- Все частицы вещества непрерывно и хаотично движутся.
- Все частицы между собой взаимодействуют.
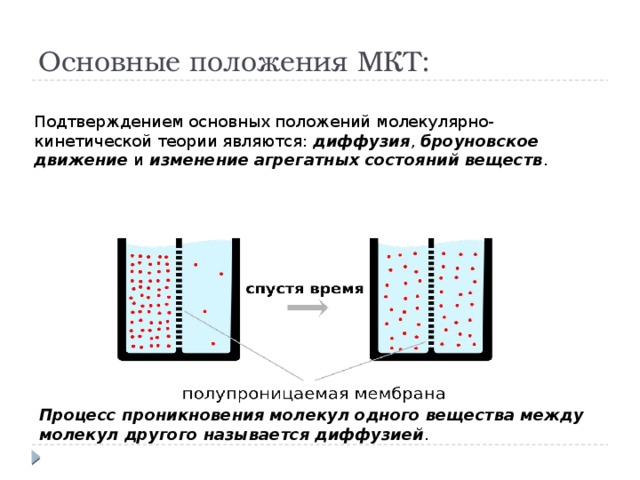
Основные положения МКТ:
Подтверждением основных положений молекулярно-кинетической теории являются: диффузия , броуновское движение и изменение агрегатных состояний веществ .
Процесс проникновения молекул одного вещества между молекул другого называется диффузией .

Скорость диффузии
В 1855 г. немецкий физиолог Адольф Евгений Фик сделал первое количественное описание процессов диффузии :
где J - плотность диффузионного потока вещества,
D - коэффициент диффузии,
C - концентрация вещества.
Броуновское движение
1827 год

Идеальный газ
- 1 . Потенциальная энергия взаимодействия молекул идеального газа настолько мала, что ею пренебрегают по сравнению с кинетической энергией.
- 2. Молекулы в идеальном газе настолько маленькие размеры, что их можно считать материальными точками. А это означает, что их суммарный объём ничтожно мал по сравнению с объёмом сосуда, в котором находится газ. И этим объёмом также пренебрегают.
- 3. Среднее время между столкновениями молекул намного превышает время их взаимодействия при соударении. Поэтому временем взаимодействия пренебрегают также.

Уравнение состояния
Состояние идеального газа характеризуют три параметра:
давление p , объём V и температура T .
Зависимость между ними описывается уравнением:
уравнением Менделеева-Клайперона
объединённый газовый закон
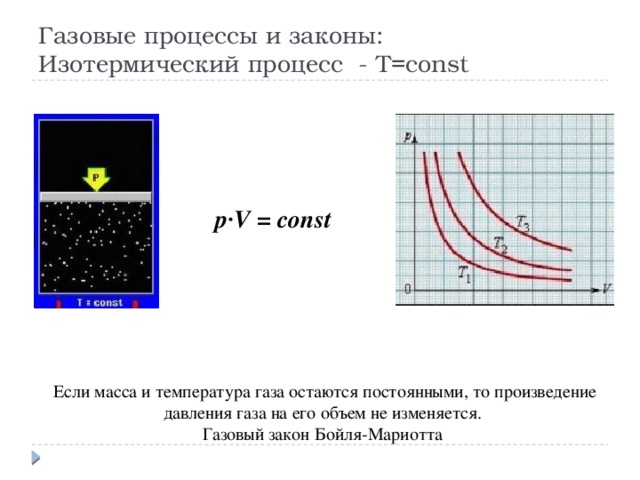
Газовые процессы и законы: Изотермический процесс - T=const
p·V = const
Если масса и температура газа остаются постоянными, то произведение давления газа на его объем не изменяется.
Газовый закон Бойля-Мариотта
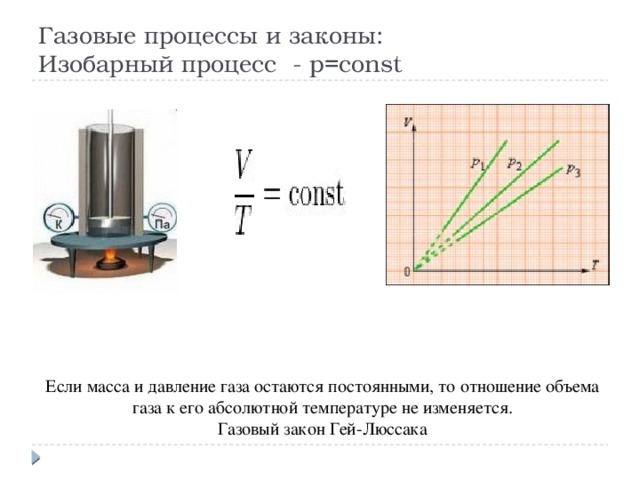
Газовые процессы и законы: Изобарный процесс - p=const
Если масса и давление газа остаются постоянными, то отношение объема газа к его абсолютной температуре не изменяется.
Газовый закон Гей-Люссака
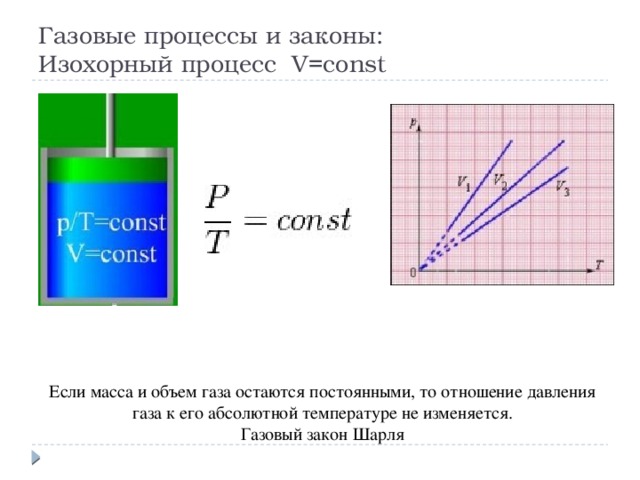
Газовые процессы и законы: Изохорный процесс V=const
Если масса и объем газа остаются постоянными, то отношение давления газа к его абсолютной температуре не изменяется.
Газовый закон Шарля

Применение газовых процессов
- Изотермический процесс проявляется :
- При дыхании человека и животного ;
- при использовании респиратора;
- при измерении давления воздуха, пара, газов и жидкостей,
например, в шинах автомобиля;
- в насосах всасывания и нагнетания;
- при использовании шприцов, медицинских банок;
- газовые балончики ( лак для волос, спрэй-очиститель и т.д.)
- пульверизатор;
2. Изобарный процесс проявляется:
- при расширение газа в цилиндре с подвижным поршнем при
нагревании цилиндра;

Применение газовых процессов
3 . Изохорный процесс проявляется :
- при нагревание газа в электрической лампочке при ее включении;
- в огнестрельном оружии для выталкивания пули из ствола;
- в качестве теплоносителей;
- в качестве рабочего тела для выполнения механической работы
(реактивные двигатели и снаряды, газовые турбины, парогазовые
установки, пневмотранспорт и др.),
- физической среды для газового разряда (в газоразрядных трубках и
др. приборах).

Самооценка за работу на уроке:
- Тема освоена на:
- Отлично
- Хорошо
- Удовлетворительно.
- Трудности при выполнении задания:
- Изучение новых терминов
- Групповая работа над заданием
- Ответы на вопросы по тесту .
- Как справляюсь с трудностями :
- Самостоятельно
- Спрошу у одноклассник
- Спрошу у учителя
- Почитаю учебник
- Самооценка за работу на уроке:
- Отлично
- Хорошо
- Удовлетворительно
- Все не понятно

 Получите свидетельство
Получите свидетельство Вход
Вход












 Уравнение состояния, газовые законы (587.02 KB)
Уравнение состояния, газовые законы (587.02 KB)
 0
0 830
830 74
74 Нравится
0
Нравится
0


