19.0216. Учитель химии
МБОУ «Фрунзенская средняя школа»
Усеинова Ф.Т.
Тема урока. Углекислый газ. Угольная кислота и ее соли.
Цели: изучить состав, строение, свойства углекислого газа, угольной кислоты и ее соли; рассмотреть качественную реакцию на карбонат-ион; познакомить со свойствами и взаимодействием карбонатов и гидрокарбонатов; продолжить формирование логического мышления; развивать умение сравнивать, обобщать, делать выводы.
Ход урока
I. Организационный момент урока.
II. Формулирование темы и определение цели урока.
О каких веществах сегодня на уроке мы будем говорить, вы определите по признакам:
1) бесцветный газ не поддерживает горение, его накопление в атмосфере грозит потеплением климата. Этот газ применяют в огнетушителях и для газирования напитков. (углекислый газ)
2) это вещество образуется при растворении углекислого газа в воде и ее соли служат строительным материалом для раковин морских обитателей и накапливаются в осадочных породах после их гибели. (угольная кислота и карбонаты)
Запись темы урока «Углекислый газ. Угольная кислота и ее соли» и определение его целей.
Рассмотреть строение молекулы, свойства углекислого газа и угольной кислоты; научиться отличать углекислый газ от других газов; составлять уравнения реакций характерных для солей угольной кислоты; проводить качественную реакцию на карбонат-ион.
III. Мотивация.
Зачитывание фрагмента:
В романе Г.Г. Хаггарда «Клеопатра» написано: «… она вынула из уха одну из 3-х огромных жемчужин и опустила жемчужину в уксусную кислоту? Наступило молчание, потрясённые гости, замерев, наблюдали, как несравненная жемчужина медленно растворяется, вот от неё не осталось и следа, и тогда Клеопатра подняла кубок, покрутила его, взбалтывая, и выпила всё до последней капли».
Объяснить растворение жемчужины мы сможем в ходе урока, изучив свойства солей самой распространённой в природе кислоты: угольной.
IV. Изучение нового материала.
1. Оксид углерода (IV)
1) Характеристика оксида углерода (IV) в сравнении с оксидом углерода (II)
| Признаки | Угарный газ | Углекислый газ |
| 1.Строение молекулы | Ковалентная полярная связь, молекулярная кристаллическая решетка | |
| Связь тройная, одна образована по донорно-акцепторному механизму | Четыре связи, молекула неполярна, имеет линейное строение | |
| 2. Физические свойства | Газообразны, без цвета, без запаха, не поддерживают горение и дыхание. | |
| Немного легче воздуха, плохо растворим в воде. Ядовит. | Тяжелее воздуха в 1.5 раза хорошо растворим в воде | |
| 3. Химические свойства | Реагируют с основными оксидами | |
| CO + CuO = Cu + CO2 Сильный восстановитель, восстанавливает металлы из их оксидов
| CO2 + CaO = CaCO3 Не проявляет восстановительных свойств, при повыш. температуре окислитель С+4O2 + 2Mg t˚C→ 2Mg+2O + C0 | |
| Несолеобразующий оксид | Типичный кислотный оксид 1) с водой даёт непрочную угольную кислоту: СО2 + Н2О ↔ Н2СО3 2) реагирует с основными оксидами и основаниями, образуя соли угольной кислоты Na2O + CO2 → Na2CO3 2NaOH + CO2 → Na2CO3 + H2O NaOH + CO2 (избыток) → NaHCO3 | |
2) Просмотр видео. Гашение горящих свечей, расположенных на разной высоте.
Вывод: Углекислый газ не поддерживает горение.
3) Получение оксид углерода (IV)
1.Термическим разложением солей угольной кислоты (карбонатов). Обжиг известняка – в промышленности:
CaCO3 t=1200˚C→ CaO + CO2
2. Действием сильных кислот на карбонаты и гидрокарбонаты – в лаборатории:
CaCO3 (мрамор) + 2HCl → CaCl2 + H2O + CO2
NaHCO3 + HCl → NaCl + H2O + CO2
3. Сгорание углеродсодержащих веществ:
СН4 + 2О2 → 2H2O + CO2
4. При медленном окислении в биохимических процессах (дыхание, гниение, брожение)
Вы слышали об эффекте «собачьей пещеры» в Италии? Есть там такая пещера-яма. Человек войдет и ходит, а собака или кролик погибают через несколько минут.
- Из вулканической трещины выделяется углекислый газ…
Почему в «собачьей пещере» человек остается живым, а собаки и другие мелкие животные гибнут?
СО2 тяжелее воздуха и скапливается внизу
СО2 безопасен для человека, но вреден для животных
человек входит в пещеру в противогазе.
4) Лабораторный опыт. Качественная реакция на углекислый газ. (стр. 122 учебника)
Инструктаж по ТБ!
Вывод: помутнение известковой воды Ca(OH)2 за счёт образования белого осадка – нерастворимой соли CaCO3:
Ca(OH)2 + CO2 → CaCO3 ↓+ H2O
2. Угольная кислота и её соли
1) Химическая формула - H2CO3
+1 +4 -2
а) Молекулярная формула: H2CO3
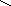
Н ─ О
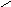
С = О
Н ─ О
2) Демонстрационный эксперимент. Получение угольной кислоты
(просмотр видео)
3) Демонстрационный эксперимент.
а) добавим 2-3 капли лакмуса в раствор угольной кислоты и раствор соляной кислоты. Сравним окраску (слабая окраска (розовая) в растворе угольной кислоты). Интенсивность окраски зависит от количества ионов водорода (чем их больше, тем интенсивнее окраска, тем более сильный электролит)
Вывод: Угольная кислота – двухосновная слабая кислота
1 ст. H2CO3  H+ + HCO3- (гидрокарбонат-ион)
H+ + HCO3- (гидрокарбонат-ион)
II cт. HCO3-  H+ + CO32- (карбонат-ион)
H+ + CO32- (карбонат-ион)
диссоциация по второй ступени практически не идёт.
3) Демонстрационный эксперимент ( просмотр видео)
Нагреем окрашенный метил-оранжем, раствор угольной кислоты. Окраска меняется с розовой на оранжевую. Объясните наблюдения. (предположения учащихся)
При стоянии или нагревании раствор становится нейтральным. Угольная кислота существует только в растворе т.к. она очень легко разлагается на углекислый газ и воду (тоже происходит в желудке, когда мы пьем газированную воду, поэтому «пучит» живот)
H2CO3  CO2
CO2  + H2O
+ H2O
любая газированная вода представляет собой раствор угольной кислоты в воде.
Непрочными могут быть и сильные кислоты, например, азотная кислота разлагается на свету (хранят в бутылке из темного стекла). И наоборот, слабые кислоты (уксусная, лимонная) могут быть прочными, используют при консервировании.
3) Химические свойства:
Для угольной кислоты характерны все свойства кислот.
Учащиеся записывают уравнение реакции в молекулярной и ионной форме
1) с активными металлами
H2CO3 + Ca = CaCO3 + H2↑
2) с основными оксидами
H2CO3 + CaO = CaCO3 + H2O
3) Взаимодействует в растворе со щелочами.
При написании уравнения реакции нужно учитывать, что угольная кислота – слабый электролит, поэтому ее расписывать на ионы нельзя.
H2CO3 (изб) + NaOH = NaHCO3 + H2O
H2CO3 + 2NaOH = Na2CO3 + 2H2O
H2CO3+2Na+ + 2OH- 2Na+ + CO32- +2H2O
H2CO3+2OH- 2Na+ +2H2O
4) Угольная кислота образует два ряда солей:
Средние соли - карбонаты Na2СO3, СаСО3 (NH4)2CO3
Кислые соли - бикарбонаты, гидрокарбонаты NaHCO3, Ca(HCO3)2
Найдите соответствие формулы солей и их названия:
Карбонат натрия (кальцинированная сода)
Карбонат кальция (мел, известняк, мрамор)
Гидрокарбонат натрия (питьевая сода)
Карбонат калия (поташ)
Исходя из данных таблицы растворимости, отметьте растворимость карбонатов
5) Физические свойства:
Все гидрокарбонаты хорошо растворимы в воде в отличие от карбонатов, из которых растворимы только карбонаты щелочных металлов и аммония.
6) Химические свойства солей угольной кислоты:
Общие свойства солей:
1) Вступают в реакции обмена с другими растворимыми солями
Na2CO3 + CaCl2 = CaCO3↓ + 2NaCl
2) Разложение гидрокарбонатов при нагревании
NaHCO3 t˚C → Na2CO3 + H2O + CO2↑
3) Разложение нерастворимых карбонатов при нагревании
CaCO3 t˚C → CaO+ CO2↑
4) Карбонаты и гидрокарбонаты могут превращаться друг в друга:
7) Просмотр видео Взаимопревращение карбонатов и гидрокарбонатов.
СО2 + Ca(OH)2 = CaCO3↓ + H2O
Выпадет белый творожистый осадок - CaCO3.
СаСO3  + H2O + CO2
+ H2O + CO2  Ca(HCO3)2
Ca(HCO3)2
Осадок исчезает. t
Ca(HCO3)2  Са СO3
Са СO3  + H2O + CO2
+ H2O + CO2
Осадок снова появляется.
8) Специфические свойства:
Лабораторный опыт. Качественная реакция на CO32- карбонат – ион "вскипание" при действии сильной кислоты:
CaCO3 +2 HCl= CaCl2 +CO2 +H2O
CaCO3 + 2H+ + 2Cl- Ca2+ +2Cl- +CO2
Ca2+ +2Cl- +CO2 + H2O
+ H2O
CaCO3 + 2H+  Ca2+ +CO2
Ca2+ +CO2 + H2O
+ H2O
Na2CO3 +2 HCl= 2NaCl +CO2 +H2O
2Na++ CO32- + 2H+ + 2Cl- CO2
CO2 + 2Na+ +2Cl- + H2O
+ 2Na+ +2Cl- + H2O
CO32- + 2H+  CO2
CO2 + H2O
+ H2O
При добавлении в обе пробирки соляной кислоты, выделяется углекислый газ. Почему?
Вывод: Для обнаружения карбонат – иона СО3 надо использовать кислоты более сильные, чем угольная. Качественная реакция на соли угольной кислоты (СО32- или карбонат-ион) – взаимодействие с разбавленной кислотой, например, соляной:
V. Закрепление изученного материала
№ 1. Составьте кластер «Углекислый газ»
№2. Установите соответствие между левыми и правыми частями уравнений
№3. Осуществите превращения по схеме:
1) Al 4 C 3→ CH 4→ CO 2→ MgCO 3→ Mg (HCO3)2→ MgCO 3
2) Mg → MgC 2→ Mg(OH)2→ MgCO 3→ CO 2→ C
3) CO2 → H2CO3 → Li2CO3 → CO2
№4. Решите задачу
1.Какой объём углекислого газа выделится при обжиге карбоната кальция массой 200 г
№5. Составьте синквейн на одну из тем «Угольная кислота» «Карбонаты»
VI. Подведение итогов работы (10 мин)
Подведем итог нашего урока и ответим на наш поставленный вопрос в начале урока:
– «Что же произошло, когда растворила жемчужину Клеопатра?», запишите уравнение реакции.
Предполагаемый ответ:
При растворении жемчуга в уксусной кислоте произошла химическая реакция
СаСО3 +2 СН3СООН (СН3СОО)2Ca + 2 CO2 +2 H2O
VII. Рефлексия
Оцените свои достижения по рубрике «Я могу» «Я знаю» ( стр. 123, 129 учебника)
VIII. Домашнее задание
П. 34-35, упр. 14-20, задача 3 на стр.123
Подготовить презентацию о карбонатах в природе.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Углекислый газ. Угольная кислота и ее соли. (47.56 KB)
Углекислый газ. Угольная кислота и ее соли. (47.56 KB)
 0
0 701
701 42
42 Нравится
0
Нравится
0


