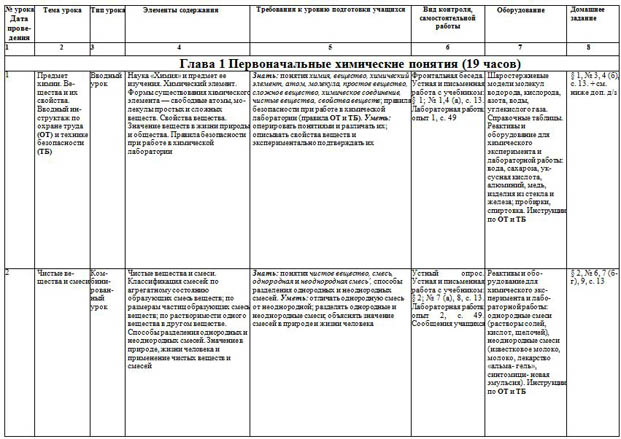
| 1 | Предмет химии. Вещества и их свойства. Вводный инструктаж по охране труда (ОТ) и технике безопасности (ТБ) | Вводный урок | Наука «Химия» и предмет ее изучения. Химический элемент. Формы существования химического элемента — свободные атомы, молекулы простых и сложных веществ. Свойства вещества. Значение веществ в жизни природы и общества. Правила безопасности при работе в химической лаборатории | Знать: понятия химия, вещество, химический элемент, атом, молекула, простое вещество, сложное вещество, химическое соединение, чистые вещества, свойства веществ; правила безопасности при работе в химической лаборатории (правила ОТ и ТБ). Уметь: оперировать понятиями и различать их; описывать свойства веществ и экспериментально подтверждать их
| Фронтальная беседа. Устная и письменная работа с учебником: § 1; № 1,4 (а), с. 13. Лабораторная работа: опыт 1, с. 49 | Шаростержневые модели молекул водорода, кислорода, азота, воды, углекислого газа. Справочные таблицы. Реактивы и оборудование для химического эксперимента и лабораторной работы: вода, сахароза, уксусная кислота, алюминий, медь, изделия из стекла и железа; пробирки, спиртовка. Инструкции по ОТ и ТБ | § 1, № 3, 4 (б), с. 13. + см. ниже доп. д/з |
| 2 | Чистые вещества и смеси | Ком- бини- рован- ный урок | Чистые вещества и смеси. Классификация смесей: по агрегатному состоянию образующих смесь веществ; по размерам частиц образующих смесь веществ; по растворимости одного вещества в другом веществе. Способы разделения однородных и неоднородных смесей. Значение в природе, жизни человека и применение чистых веществ и смесей | Знать: понятия чистое вещество, смесь, однородная и неоднородная смесь', способы разделения однородных и неоднородных смесей. Уметь: отличать однородную смесь от неоднородной; разделять однородные и неоднородные смеси; объяснять значение смесей в природе и жизни человека | Устный опрос. Устная и письменная работа с учебником: § 2; № 7 (а), 8, с. 13. Лабораторная работа: опыт 2, с. 49. Сообщения учащихся | Реактивы и оборудование для химического эксперимента и лабораторной работы: однородные смеси (растворы солей, кислот, щелочей), неоднородные смеси (известковое молоко, молоко, лекарство «альма- гель», синтомици- новая эмульсия). Инструкции по ОТ и ТБ | § 2, № 6, 7 (б-г), 9, с. 13 |

 Получите свидетельство
Получите свидетельство Вход
Вход











 Тематическое планирование по химии (8 класс) (0.34 MB)
Тематическое планирование по химии (8 класс) (0.34 MB)
 0
0 925
925 48
48 Нравится
0
Нравится
0






