
Строение атома
Автор: Фарафонтова Светлана Юрьевна

Экспериментальные доказательства сложности строения атома .
Первые указания о сложном строении атома были получены при изучении процессов прохождения электрического тока через жидкости и газы. Опыты выдающегося ученого М. Фарадея в 30-х годах ХIХ в. навели на мысль о том, что электричество существует в виде единичных отдельных зарядов. Величины этих единичных зарядов электричества были определены позже, в опытах с так называемыми катодными лучами. Было установлено, что катодные лучи – это поток заряженных частиц, которые получили название электронов .
Прямым доказательством сложности строения атома было открытие самопроизвольного распада атомов некоторых элементов, названное радиоактивностью. В 1896 году французский физик А. Беккерель обнаружил, что материалы, содержащие уран, засвечивают в темноте фотопластинку, ионизируют газы, вызывают свечение флюоресцирующих веществ. В дальнейшем выяснилось, что этой особенностью обладает не только уран. М.Склодовская-Кюри и П.Кюри открыли два новых радиоактивных элемента – полоний и радий.
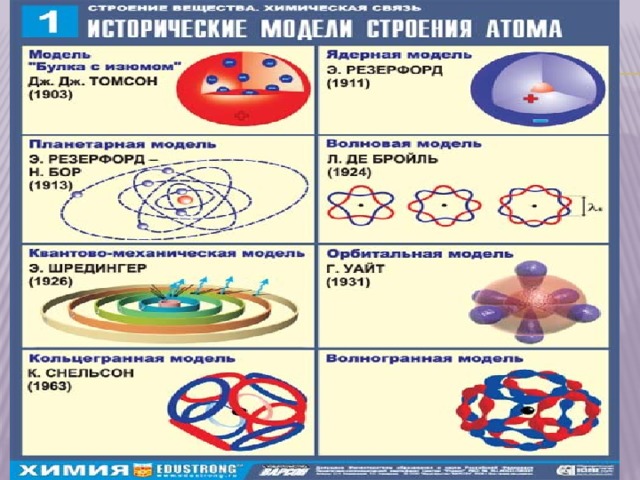

Планетарная модель атома Резерфорда.
- Эти и другие открытия позволили предложить следующую модель
- строения атома, которая была названа планетарной :
- В центре атома находится положительно заряженное ядро,
- занимающее ничтожно малую часть пространства внутри атома.
- Весь положительный заряд и почти вся масса атома
- сосредоточены в его ядре (масса электрона ничтожно мала);
- Ядра атомов состоят из протонов и нейтронов (общее название
- нуклоны). Число протонов в ядре равно порядковому номеру
- элемента(Z), а сумма чисел протонов и нейтронов соответствует его массовому числу.
- Вокруг ядра вращаются электроны .
- Их число равно положительному заряду ядра.

Состав ядер. Изотопы
Заряд ядра является фундаментальной характеристикой элемента и определяется числом протонов в нем. Химический элемент- вид атомов с одинаковым зарядом ядра. Сумма масс протонов и нейтронов составляет массовое число: А=Z+ N, где А – массовое число, Z- порядковый номер элемента, N – число нейтронов .
Виды атомов, различающиеся массовым числом, т.е. числом нейтронов, называются изотопами ( нуклидами)

Строение электронной оболочки атома.
Электронная оболочка атома – это совокупность всех электронов в данном атоме.
Химические свойства элементов определяются строением электронных оболочек их атомов.
В 20-х годах ХХ века ученые установили, что электрон имеет двойственную природу: он является одновременно и частицей и волной ( корпускулярно-волновой дуализм)
Представление о двойственной природе электрона привело к созданию квантово-механической теории строения атома. Согласно этой теории, электрон не имеет определенной траектории движения. Можно говорить только о вероятности нахождения электрона в разных частях атомного пространства.
Электронная оболочка каждого атома представляет
собой сложную систему. Она делится на подоболочки
с разной энергией – энергетические уровни. Коли-
чество энергетических уровней в атомов соответст-
вует номеру периода, в котором находится данный
элемент. Уровни, в свою очередь, делятся на под-
уровни , а подуровни состоят из атомных орбиталей

Элктроные орбитали.
Часть атомного пространства, в которой вероятность нахождения электрона наибольшая (более 90%), называется атомной орбиталью.
Каждый электрон в атоме занимает определенную орбиталь и образует электронное облако , которое является совокупностью различных положений быстро движущегося электрона. Атомная орбиталь и облако электрона, который занимает эту орбиталь, имеют одинаковый размер, одинаковую форму и одинаковое направление в пространстве. Электронные орбитали различаются по форме:
- s-электроны имеют форму шара;
- р-электроны – форму объемной
- восьмерки:
- d-электроны - форму четырех-
- листника
- f –более сложную форму .

Размещение электронов на подуровне
- Подуровень – совокупность орбиталей одного вида.
-
Так, s-подуровень состоит из:
1 s-орбитали; р-подуровень – из 3 р-орбиталей,
d –подуровень – из 5 d-орбиталей; f-подуровень – из 7 f-орбиталей.
р-подуровень
s-подуровень
Атомная орбиталь первого энергетического уровня обозначается 1s, второго – 2s и т.д., такая орбиталь в каждом уровне одна. Со второго энергетического уровня появляются р-орбитали, их всего три в каждом (втором и последующих)уровне, и они составляют р-подуровни. С третьего энергетического уровня появляется d-подуровень (пять d-орбиталей).
На каждой орбитали может размещаться максимально 2 электрона. Поэтому, на s-подуровне максимально может находиться – 2 е, на р-подуровне – 6е, на d-подуровне – 10е, на f- 14е.

Максимальное число электронов на уровне.
Максимальное число электронов на уровне складывается из количества электронов на подуровнях:
2 уровень – 2s 2 2р 6 –8 ē
3 уровень – 3s 2 3p 6 3d 10 – 18 ē
4 уровень – 4s 2 4p 6 4d 10 4f 14 – 32 ē

Порядок заполнения орбиталей электронами .
Электроны заполняют орбитали, начиная с подуровня с меньшей энергией
( принцип минимума энергии).
Последовательность заполнения орбиталей следующая:
1s→2s→2p→3s→3p→4s→3d→4p→5s…
При наличии орбиталей с одинаковой энергией (например, трех р - орбиталей одного уровня), каждая орбиталь заселяется вначале одним электроном (и поэтому на р - подуровне не может быть больше трех неспаренных электронов), а затем уже вторым, с образованием электронных пар.
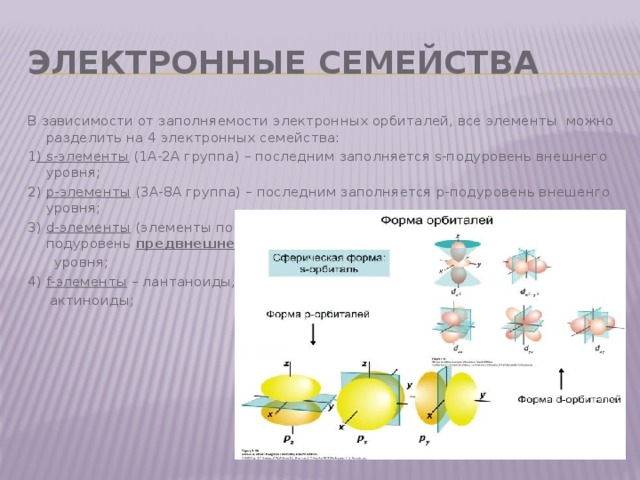
Электронные семейства
В зависимости от заполняемости электронных орбиталей, все элементы можно разделить на 4 электронных семейства:
1 ) s-элементы (1A-2A группа) – последним заполняется s-подуровень внешнего уровня;
2) р-элементы (3А-8А группа) – последним заполняется р-подуровень внешенго уровня;
3) d-элементы (элементы побочных подгрупп)- последним заполняется d-подуровень предвнешнего
уровня;
4) f-элементы – лантаноиды,
актиноиды;

Валентные электроны.
Валентные электроны – это электроны, участвующие в образовании химических связей. Их число всегда равно номеру группы.
Они располагаются:
- у элементов главных подгрупп – на внешних s и р - подуровнях;
- у элементов побочных подгрупп - на внешних s и предвнешних d - подуровнях.
(на внешнем s-подуровне – всегда 2 (реже 1) электрона).
Например: Элементы VII группы ПС имеют 7 валентных электронов.
Cl – элемент главной подгруппы (VII-А). Валентные электроны -3s 2 3p 5
Mn – элемент побочной подгруппы (VII-Б). Валентные электроны – 4s 2 3d 5
В образовании химических связей участвуют не все валентные, а, в основном, лишь неспаренные электроны.
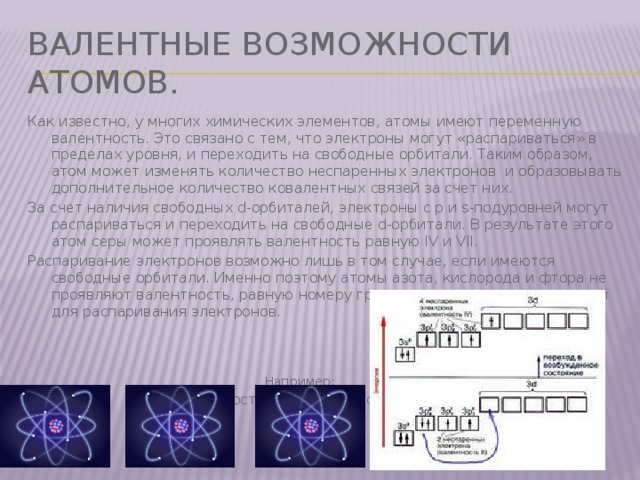
Валентные возможности атомов.
Как известно, у многих химических элементов, атомы имеют переменную валентность. Это связано с тем, что электроны могут «распариваться» в пределах уровня, и переходить на свободные орбитали. Таким образом, атом может изменять количество неспаренных электронов и образовывать дополнительное количество ковалентных связей за счет них.
За счет наличия свободных d-орбиталей, электроны с р и s-подуровней могут распариваться и переходить на свободные d-орбитали. В результате этого атом серы может проявлять валентность равную IV и VII.
Распаривание электронов возможно лишь в том случае, если имеются свободные орбитали. Именно поэтому атомы азота, кислорода и фтора не проявляют валентность, равную номеру группы – у них нет возможностей для распаривания электронов.
Например:
Сера в состоянии валентности ІІ и ІV


 Получите свидетельство
Получите свидетельство Вход
Вход
























 Строение атома (0.68 MB)
Строение атома (0.68 MB)
 1
1 1076
1076 149
149 Нравится
0
Нравится
0



