
Микулёнок Н.Н., учитель химии
Коледа Г.Ф., учитель физики
Татаева В.К., учитель математики
Боровская средняя школа Лепельского района

- Раствора сульфата меди ( II) и железа
- Растворов хлорида меди ( II) и гидроксида натрия

Единица измерения скорости в СИ : 1

n - число молей одного из вступивших в реакцию или образующихся в результате реакции вещества (Х)
V - объём газа
t - время
- изменение числа молей за
время
Т.к.
=
C, следовательно
=

Скорость реакции в гомогенной системе
=
= С 2 - С 1
- изменение молярной концентрации одного
из вступивших или
образующихся в результате реакции
веществ за время

Скорость гомогенной реакции определяется изменением концентрации реагирующих веществ во времени


- Знак “-“ перед дробью ставиться потому, что несмотря на убывание концентрации вещества А , т.е. на отрицательное значение разности с 2 (А) – с 1 (А), скорость реакции может быть только положительной величиной
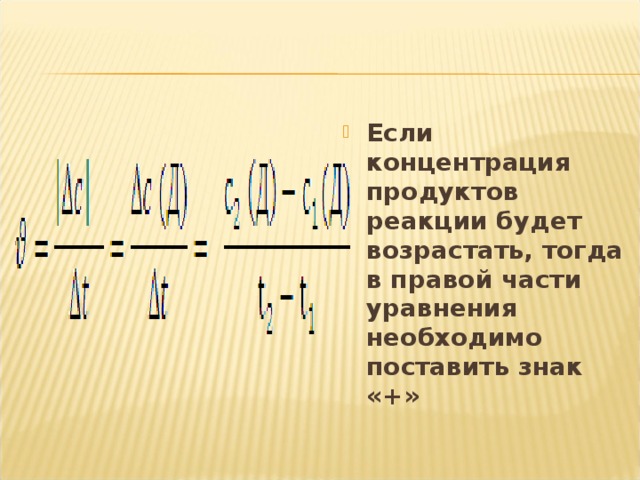
- Если концентрация продуктов реакции будет возрастать, тогда в правой части уравнения необходимо поставить знак «+»

n – количество вещества,
S – площадь соприкосновения веществ,
t – время

- Начальная концентрация оксида серы ( IV ) в реакции окисления его до оксида серы ( VI ) была 2 моль\дм 3 , а через 50 сек стала 0,5 моль\ дм 3 . В этом случае чему будет равна скорость?
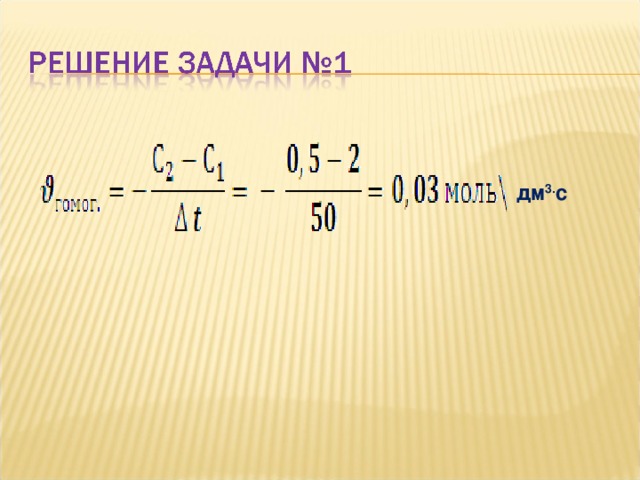
дм 3. с

Вычислите среднюю скорость реакции А+В
2С, если начальная концентрация вещества А равна 0,22 моль/дм 3 , а через 10 секунд стала 0,215 моль/дм 3 . Как изменилась за это время концентрация вещества В?

=0,2 моль/ л
с

1.Химическая реакция, хаотическое движение частиц, столкновение частиц, определённая ориентация частиц, достаточный запас энергии взаимодействующих частиц.
2.Изменение концентрации реагирующих (образующихся ) веществ в единицу времени,
3.Изменение числа молей реагирующих ( образующихся) веществ в единицу времени на единице поверхности,

- Какие знания вы приобрели на данном уроке?
- С какими понятиями познакомились?
- Много ли времени нужно затратить дома на изучение материала?
- Что не усвоили? Почему?

- Подготовьте сообщение о роли биологических катализаторов –ферментов а процессах жизнедеятельности организмов.

- выучить параграф 21
- стр.130-132 выполнить задания №№5, 10

 Получите свидетельство
Получите свидетельство Вход
Вход












 Скорость химических реакций. Урок химии. 10 класс (2.56 MB)
Скорость химических реакций. Урок химии. 10 класс (2.56 MB)
 0
0 637
637 59
59 Нравится
0
Нравится
0



