
Чтобы что-то узнать, Нужно уже что-то знать
С. Лем.

Реакции ионного обмена -
- это реакции, протекающие между ионами в растворах электролитов.

2
2
К OH + H2SO4 =
К 2SO4 + H2 O
Молекулярный вид
2 К + +2OH - + 2 H + +SO4 2- =
2 К + +SO4 2- + 2 H2 O
Полное ионное
Ионный вид
Сокращённое ионное
2 H2 O
2OH - + 2 H + =
OH - + H + =
H2 O
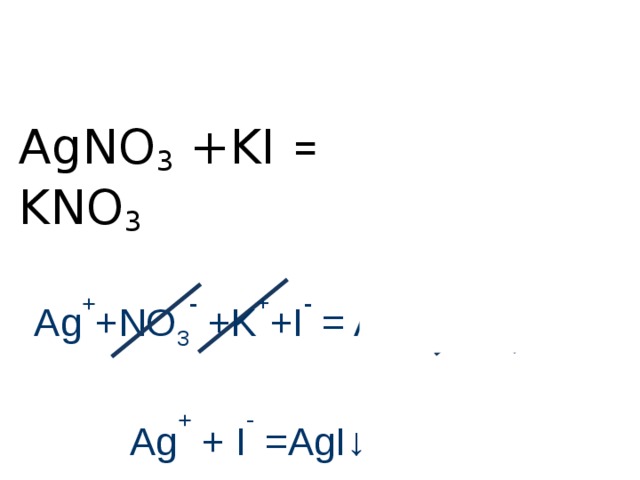
AgNO 3 +KI = AgI + KNO 3
Ag + +NO 3 - +K + +I - = AgI +K + +NO 3 -
Ag + + I - =AgI↓
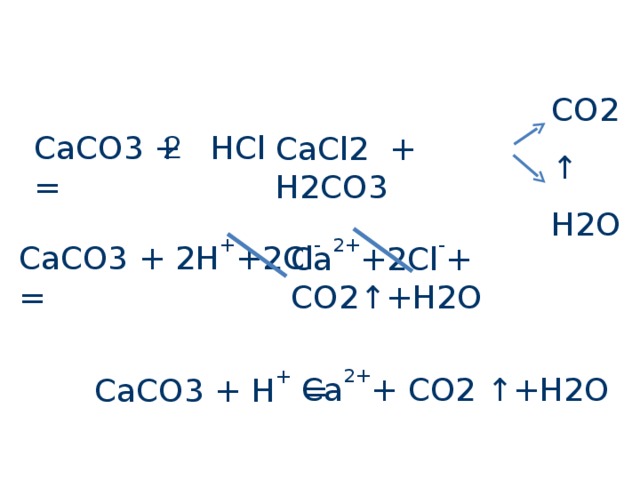
CO2 ↑
H2O
2
CaCO3 + HCl =
CaCl2 + H2CO3
CaCO3 + 2 H + + 2Cl - =
Ca 2+ +2Cl - + CO2 ↑ +H2O
Ca 2+ + CO2 ↑ +H2O
CaCO3 + H + =

Условия необратимого протекания реакций ионного обмена:
Химик "правила обмена"
Не забудет никогда:
Если выделится газ - Это раз;
И получится вода - Это два;
А еще - нерастворимый
Осаждается продукт…
"Есть осадок ", - третий пункт .

задание
Проиллюстрируйте правило Бертолле для соляной кислоты.

Применение реакций ионного обмена
- Определение качества воды.
- Устранение жесткости воды.
- Определение качества продуктов питания.

Силу уму придают
упражнения

 Получите свидетельство
Получите свидетельство Вход
Вход











 Реакции ионного обмена 8 класс (364 KB)
Реакции ионного обмена 8 класс (364 KB)
 0
0 1449
1449 19
19 Нравится
0
Нравится
0


