МИНИСТЕРСТВО ОБРАЗОВАНИЯ РЕСПУБЛИКИ КОМИ
КОМИ РЕСПУБЛИКАСА ЙÖЗÖС ВЕЛÖДАН МИНИСТЕРСТВО
Государственное профессиональное образовательное учреждение
«Сыктывкарский лесопромышленный техникум»
«Сыктывкарса вöр промышленносьт техникум»
уджсикасö велöдан канму учреждение
Решебник по химии (неорганическая химия)
Разработала: Пантелеева. Т.П., преподаватель химии
Неорганическая химия
Сыктывкар 2014г
Основные понятия и законы химии.
Запишите, что в выражении расчета относительной молекулярной массы серной кислоты H2SO4
(M2 (H2SO4) =1ּ2 + 32+16ּּ 4=98) обозначают числа:
1-………………………………………………………………………………………..
32-……………………………………………………………………………………..
16-……………………………………………………………………………………..
2-……………………………………………………………………………………….
4-……………………………………………………………………………………….
98-……………………………………………………………………………………..
Вычислите относительные молекулярные массы веществ:
а) метан CH4…………………………………………………………………….
б) угарный газ СО…………………………………………………………..
в) уксусная кислота CH3COOH…………………………………….
г) азотная кислота HNO3.................................................
д) перекись водорода H2O2…………………………………………..
е) пищевая сода NaHCO3………………………………………………..
Вычислите относительные молекулярные массы веществ и поставьте знаки или = вместо звездочки:
а) Mr(CO) * Mr(CO2)
б) Mr(Al2O3) * Mr(B2O3)
в) Mr(H3PO4) * Mr(H2S04)
г) Mr(SiH4) * Mr(CH4)
д) Mr(C6H12O6) * Mr(C12H22O11)
е)Mr(P2O5) * Mr(P2O3)
Вычислите массовое отношение элементов в веществах, формула которых:
а) MgO…………………………………………………………………………….
б) H2S……………………………………………………………………………….
в) CO2………………………………………………………………………………
г) K2CO3…………………………………………………………………………….
д) H2SiO4…………………………………………………………………………..
е)C6H12O6………………………………………………………………………….
ж)CuSO4……………………………………………………………………………
Вычислите массовую долю каждого элемента в мраморе СаСО3, в сульфате магния MgSO4, в карбонате железа FeCO3:
![]()
Дано: Решение:
1. Вычислите относительную молекулярную
массу веществ:
2. Найдите массовую долю элементов по
формуле:
ω Э = ……………………………………………………………
ω Са =…………………………………………………………..
ω С =……………………………………………………………..
ω О =…………………………………………………………….
Ответ:………………………………………………………………………….
Выведите формулу веществ, в котором массовые доли кальция, углерода и кислорода соответственно составляют 40, 12 и 48 %.

Дано: Решение:
CaxCyOz 1) Запишите относительные атомные массы
элементов, образующих вещество:
Ar(Ca)=…………..; Ar(C)=……………; Ar(O)=……………
2)Проведите вычисления по формуле:
х:у:z=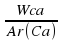 :
: 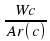 :
: 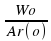 =…………………………………
=…………………………………
3) Запишите формулу
Ответ:……………………………………………………………………………
Какова формула соединения, в котором массовая доля марганца составляет 61,8%, кислорода 36%, водорода 2,2%:
![]()
Дано: Решение:
Ответ:………………………………………
Какова формула соединения, в котором массовая доля водорода 2,4%, серы 39,1%, кислорода 58,5%
![]()
Дано: Решение:
Ответ:…………………………………………..
Составьте формулу по правилам:
а) Количество вещества (n) равно отношению массы вещества (m) к его молярной массе (М)
.........................................................................
б) Объем газоотводного вещества (V) равен произведению молярного объема (Vm) на количество вещества
……………………………………………………………………………..
в) Число частиц вещества (N) равно произведению постоянной Авогадро (Nа) на количество вещества
…………………………………………………………………………………
Заполните таблицу, вставив пропущенные числа и единицы величин.
| Количество веществ | Молярная масса | Масса |
| n(O2)= 1 моль
n(Al)= 0.1 моль |
|
m(CO)=28мг |
Сколько молекул содержится в 90г воды?
![]()
Дано: Решение:
N=…………………; n=………………..=N=……………….
M(………)=…………………; N=…………………..
Ответ:……………………………………………………………………….
Найдите массу 24-·1023 молекул кислорода:
![]()
Дано: Решение:
m=……………….; n=…………; = m=
Na=………………; M(………….)=
Ответ:………………………………………………………..
Вычислите массу 72 ·1023малекул азота:
![]()
Дано: Решение:
Ответ:…………………………………………..
Вычислите объем (н.у), который занимают 34г аммиака:
![]()
Дано: Решение:
V=…………; n=…………………=V=………………
Vm=………………; M(…………..)=
Ответ: …………………………………….
Вычислите массу (н.у) 33,5л метана СН4:
![]()
Дано: Решение:
m=………….; n=………………….=m=……………..
M(…….)=……………….; Vm=……………………..
Ответ:……………………………………………
Вычислите объем (н.у), который занимают 18.1023 молекул озона:
![]()
Дано: Решение:
V=………….; n=………………….=V=……………..
Vm(…….)=……………….; Na=……………………..
Ответ:…………………………………………
Рассчитайте число молекул в 11,2л водорода:
![]()
Дано: Решение:
Ответ………………………………………………………
Рассчитайте число молекул в 720г воды:
![]()
Дано: Решение:
Ответ………………………………………………………
Строение атома. Периодическая система химических элементов Д.И. Менделеева
1. Заполните таблицу «Состав атомов химических элементов»
| Характеристика химических элементов
| Знаки химических элементов |
| Н | N | K | P | F | Ca | Zn | Al |
| Порядковый номер в таблице Д.И.Менделеева Число протонов, p Число электронов, ē Заряд ядра атома Массовое число, А Число нейтронов, no |
|
|
|
|
|
|
|
|
2. Запишите символы, название и положения в таблице химических элементов в атомах которых:
а)14 протонов,14 электронов, 14 нейтронов
……………………………………………………………………………………………………..
б)52 протона, 52 электрона, 76 нейтронов
……………………………………………………………………………………………………..
в)29 протонов, 29 электронов, 35 нейтронов
……………………………………………………………………………………………………..
3. Сколько химических элементов изображено на рисунке, показывающем заряды ядер их атомов?







+12 +30 +17 +30 +12 +1 +17
Запишите символы этих химических элементов
………………………………………………………………………….
4. Запишите схемы строения электронных оболочек атомов химических элементов с порядковыми номерами с 1-го по 20-й в таблице Д.И. Менделеева
1H 2Hе
3Li 4Be 5B 6C 7N 8O 9F 10Ne
11Na 12Mg 13Al 14Si 15P 16S 17Cl 18Ar
19K 20Ca
5. Запишите, не пользуясь таблицей Д.И.Менделеева, положение химических элементов (порядковый номер, номер периода и группы, название подгруппы), которым соответствуют электронные схемы:
а)2ē, 8ē, 3ē:…………………………………….
б)2е, 5е:………………………………………….
в)2ē, 8ē, 14ē, 2ē……………………………..
6. Игра «крестики – нолики». Покажите выигрышный путь, который составляют электронные схемы атомов:
а) элементов-неметаллов б) элементов – металлов
| 2ē,8ē,6ē | 2ē,5ē | 2ē,8ē,1ē |
| 2ē,4ē | 2ē,8ē,3ē | 2ē,6ē |
| 2ē,7ē | 2ē,1ē | 2ē,8ē,6ē |
| 2ē,3ē | 2ē,8ē,6ē | 2ē,5ē |
| 2ē,8ē,3ē | 2ē,1ē | 2ē,8ē,2ē |
| 2ē,6ē | 2ē,8ē,1ē | 2ē,4ē |
7. Подчеркните символы химических элементов – металлов
а) P, Cl, Mg, Ar, N, Si, Al б) Si, Sn, Pb, C, Ge
Расположите их в порядке уменьшения металлических свойств
……………………………………… …………………………………………….
Подчеркните символы химических элементов – неметаллов
а) B, Be, S, F, N, Na, O б) N, Sb, P, Bi, As
Расположите их в порядке уменьшения неметаллических свойств
…………………………………….. …………………………………………..
Степень окисления.
1.Окислительно – восстановительные реакции.
| Правила определения степени окисления (с примерами)
|
| 1. У свободных атомов и у простых веществ с.о. равна 0 Na2O, H2, H2SO4, N2, S, H2O, Al, Cu, HNO3, F2, CaO. 2. Металлы во всех соединениях имеют положительную с.о. (ее максимальное значение равно номеру группы): а) у металлов главной подгруппы l группа +1 б) у металлов главной подгруппы ll группа +2 в) у алюминия +3 Na, K2O, Fe, CaCO3, AlCl3, Li3N, BaSO4, Zn, Mg(NO3)2 3. В соединениях кислород имеет с.о. -2 (исключения: ОF2 и пероксиды H2O2, K2O2 ) H2CO3, O3, K2O, OF2, CuSO4, NaOH, O2, SO3. 4. В соединениях с неметаллами у водорода с.о. +1, а с металлами -1: HCl, KH, H2, KOH, H2O, H2SO4, NH3. 5. В соединениях сумма с.о. всех атомов равна 0. |
2. Определите степени окисления атомов в соединениях:
Al2O, H2S, FeO, Fe2O3, NH3, N2O, NO2, N2O3, SO3, Na 2S, Na3N, NaCl, MgBr2, MgS, Mg3N2, Al2S3, CaO, CaCl2, Ca3N2
3.Составьте формулы веществ по названию
а) сульфид калия…………………………………………..
б) нитрид натрия…………………………………………..
в) оксид фосфора(V)……………………………………..
г) оксид серы (Vl)………………………………………….
д) хлорид кальция……………………………………….
е) оксид углерода (ll)…………………………………..
ж) оксид алюминия……………………………………..
з) фосфид кальция……………………………………….
4. По изменению степени окисления элемента определите и запишите в приведенных схемах число отданных или число принятых электронов

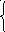 а) Окислители -
а) Окислители -
No2……………….→2N-3
Fe+3………………→Fe+2 процесс
S…………………..→S-2 восстановления
б) Восстановители -

 Сао……………..→Са+2
Сао……………..→Са+2
Н2о……………...→2Н+ процесс
Feo………………→Fe+3 окисления
5. Расставьте коэффициенты в уравнениях окислительно- восстановительных реакций методом электронного баланса или методом полуреакций.
HCl+MnO2Cl2+MnCl2+H2O
NaClONaClO3+NaCl
KClO3 KCl+O2
KClO3KClO4 +KCl
HNO2HNO3+NO+H2O
S+HNO3H2SO4+NO
NO2+H2OHNO2+HNO3
KNO3 KNO2+O2
H2O2+KJJ2+KOH
KJ +FeCl3J2+FeCl2+KCl
(NH4)2Cr2O7N2+Cr2O3+H2O
H2S+H2SO4S+H2O
HCl+HClO3Cl2+H2O
J2 + H2O HJO3 + HJ
Cl2 + NaOH NaClO + NaCl + H2O
KNO2 + KMnO4 + H2O KNO3 + MnO2 + KOH
KNO2 + KMnO4 + KOH KNO3 + K2MnO4 + H2O
KNO2 + KMnO4 + H2SO4 KNO3+MnSO4+K2SO4+H2O
P2O5+CP+CO
Cu+HNO3Cu(NO3)2+NO2+H2O
Cu(NO3)2CuO+NO2+O2
Cu+HNO3Cu(NO3)2+NO+H2O
S+HNO3H2SO4+NO2+H2O
P+HNO3+H2OH3PO4+NO
HNO3+HClCl2+H2O+NOCl
NH3+O2NO+H2O
KMnO4K2MnO4+MnO2+O2
Na2SO3+KMnO4 + H2SO4Na2SO4+MnSO4+K2SO4+H2O
H2S+KMnO4+H2SO4S+MnSO4+K2SO4+H2O
K2MnO4+H2OKMnO4+MnO2+KOH
Cl2+NaOHNaClO3+NaCl+H2O
Na2SO3+KMnO4+ NaOHNa2SO4+K2MnO4+Na2MnO4+H2O
S+HNO3 H2SO4+NO
KJ+KJO3+H2SO4J2+K2SO4+H2O
C+HNO3CO2+NO+H2O
H2S+K2Cr2O7+H2SO4S+Cr2(SO4)3+K2SO4+H2O
AgNO3 Ag+NO2+O2
H2O2+KMnO4+H2SO4O2+MnSO4+K2SO4+H2O
FeSO4+H2O2+H2SO4Fe2(SO4)3+H2O
Na2S2O3+H20Na2S4O6+NaOH
Au+HNO3+HClAuCl3+NO+H2O
Pt+HNO3+HClPtCl4+NO+H2O
Mg+HNO3Mg(NO3)2+N2O+H2O
Zn+HNO3Zn(NO3)2+NH4NO3+H2O
As+Cl2+H2O H3AsO4+HCl
As2O3+Zn+H2SO4AsH3+ZnSO4+H2O
IV. Типы химических реакций
Допишите уравнения химических реакций и укажите их тип по числу и составу исходных веществ и продуктов реакции
а) N2O5 + H2O→ HNO3 - реакция…………….
б) Al + H2SO4 → - реакция…………….
в) Fe2O3 + HCl → - реакция…………….
г) NH4Cl →NH3 + HCl - реакция……………
д) Fe2O3 + C → Fe + CO2 -реакция……………..
е) CaO +CO2 → CaCO3 -реакция……………..
ж) Fe(OH)3 → Fe2O3 + H2O - реакция………………
з) Al(OH)3 + H2SO4 → - реакция………………
и) H2 + O2 → - реакция……………….
к) Al + CuCl2(раствор) → - реакция……………….
2. Запишите уравнения реакций по схемам, укажите их тип по числу и составу исходных веществ и продуктов реакции.
а) нитрат бария + сульфат железа (III) →
сульфат бария + нитрат железа (III) →
……………………………………………………………………………………………
б) оксид фосфора (V) + вода → фосфорная кислота
……………………………………………………………………………………………
в) оксид кальция + оксид фосфора (V) → фосфат кальция
…………………………………………………………………………………………….
г) алюминий + соляная кислота →? + ?
…………………………………………………………………………………………..
д) нитрат калия → нитрит калия + кислород
……………………………………………………………………………………………
е) серная кислота + гидроксид железа (III) → ? + ?
…………………………………………………………………………………………..
3.Контрольная работа № 1
ВАРИАНТ 1
Дать характеристику элемента: а) Mg б)Ne
…………………………………………………………………………………………………
Составьте формулы следующих соединений: а) фтора с ксеноном; б) бериллия с углеродом, в которых электроположительный элемент проявляет максимальную степень окисления.
……………………………………………………………………………………….
3. Вычислить молекулярную массу: а) K2CO3 б) Na2О
………………………………………………………………………………………………
4. Сколько электронов во внешних электронных слоях сурьмы, фосфора и мышьяка, если максимальная валентность каждого из них по кислороду равна V?
………………………………………………………………………………………………
5. Определить тип химической реакции и расставить коэффициенты:
а)KClO3 →KCl+O2…………………………………………………………..
б)Na+HCl → NaCl+H2…………………………………………………….
в)CaO+CO2 →CaCO3…………………………………………………….
г)KCl+AgNO3 →AgCl+KNO3……………………………………………
…………………………………………………………………………………………….
6. Какова валентность марганца в оксидах, формулы которых Mn2O3, MnO, MnO2, Mn2O7, MnO3?.................................
ВАРИАНТ 2
Дать характеристику элемента: а) Li ,б) F
…………………………………………………………………………………
Поставьте степень окисления элементов в соединениях, формулы которых XeF4, CCl4, PCl5, SnS2
……………………………………………………………………………………………
Вычислить молекулярную массу: а)MgO, б) НСООН
…………………………………………………………………………………………….
Атомы пяти элементов одной из главных подгрупп имеют
в наружном электронном слое соответственно 2s1, 3s1,4s1,
5s1, 6s1. Назовите эти элементы.
К какому типу химических реакций относится образование углекислого газа в результате: а) взаимодействие угля с оксидом меди; б) прокаливания известняка; в) сжигания угля; г) горение угарного газа
ВАРИАНТ 3
Дать характеристику элемента: а) Ве б) Р
…………………………………………………………………………………………………
Проставьте степень окисления элементов в соединениях, формула которых CrO3, SbCl3, Mn2O7
………………………………………………………………………………………………
Вычислите массовое отношение элементов в веществах формулы, которых: а) MgO, б) H2S, в) CO2, г) K2CO3, д) H4SiO4
………………………………………………………………………………………………………
У атомов каких элементов наружный электронный слой характеризуется символом: а) 2s2 б) 3s2 в) 4s2?
…………………………………………………………………………………………………………
Напишите формулы высших оксидов для углерода, мышьяка и теллура. К какому типу их можно отнести на основании химических свойств?
…………………………………………………………………………………………………
Какое количество вещества соответствует: а) 128г меди; б) 54г серебра; в) 18г алюминия (масса чайной алюминиевой ложки?)
…………………………………………………………………………………………………
4. Виды связей и кристаллические решетки.
1. Назовите частицы, схемы электронного строения которых:
а) +14 ) ) )…………………………………………………………….
2 8 4
б) +13 ) )………………………………………………………………..
2 8
в) +17 ) )…………………………………………………………………
2 8
г) +3 ) )……………………………………………………………………
2 1
д) +20 ) ) )……………………………………………………………….
2 8 8
е)+16 ) ) )……………………………………………………………….
2 8 8
2. Подчеркните пары химических элементов, между атомами которых образуется ионная химическая связь:
а) магний и фтор
б) хлор и водород
в) кальций и сера
г) калий и кислород
д) фосфор и водород
е) натрий и алюминий
3. Поиграйте в «крестики нолики». Покажите выигрышный путь, состоящий из формул веществ с ионной связью.
а) б)
| CuS | Mg | H2S |
| K2O | Na3N | BaCl2 |
| Cl2 | CO2 | NH3 |
| РН3 | CaS | K2O |
| H2O | NaCl | O2 |
| MgO | SO3 | BaF2 |
4. Подчеркните структурную формулу вещества с одинарной связью:
а) O = S = O б) Cl - Cl в) H : N : H г) Cl : Cl
5. Подчеркните электронную формулу вещества с двойной связью.


а) О б) :О: :S: :О: в) S = C = S г) Н2
Н Н
6. Поиграйте в «крестики – нолики». Покажите выигрышный путь, состоящий из формул веществ с ковалентной неполярной связью.
| H2O | Ca | H2 |
| HBr | CaO | J2 |
| HCl | CaCl2 | O2 |
Поиграйте в «крестики – нолики». Покажите выигрышный путь, состоящий из пар химических элементов, между атомами которых образуются ковалентная полярная связь.
| Cl и Н | K и O | N и N |
| Н и С | Na и F | Ca и Br |
| Н и О | Cl и Cl | Ba и F |
…………………………………………..
………………………………………….
…………………………………………
Составьте схемы образования химических связей между парами атомов, образующими выигрышный путь.
8. Составьте схемы образования химической связи для металлов:
а) алюминия………………………………………………………………….
б) натрия……………………………………………………………………….
в) магния………………………………………………………………………...
9. Заполните схему соответствующими понятиями и формулами веществ, записав последние в скобках.
Типы химической связи
Химическая связь
↙ ↓ ↘
(……………….) (……………..)
↙ ↘
(…………….) (………………)
10. Заполните таблицу «Кристаллические решетки»
| Кристаллическая решетка | Типы химических связей | Физические свойства веществ | Примеры веществ |
| Тип | Виды частиц в узлах |
| Ионная |
|
|
|
|
| Атомная |
|
|
|
|
| Молекулярная |
|
|
|
|
| Металлическая |
|
|
|
|
11. Укажи тип связи и решетки в следующих соединениях
1-Вариант
KCl, O3, N2, HBr, NH3, MgCl2, K2S, P4, S8, H2O, BaCl2
2-Вариант
BaSO4, CuCl2, O2, P4, HJ, HCl, H2SO4, MgCO3, N2, H2O
3-Вариант
NaCl, O2, Fe, спирт (C2H5OH), Na, CaCO3, Ge, бронза, Al2O3, алмаз (С)
4-Вариант
нашатырный спирт (NH4OH), графит (С), CaSO4, H2O, HNO3, сталь, Al, P4, карборунд (SiC), BaO
Растворы. Массовая доля растворенного вещества. Электролитическая диссоциация.
Заполните таблицу, записав в нее по 2 примера смесей.
| Агрегатное состояние веществ в смесях | Примеры смесей |
| Твердое – твердое |
|
| Твердое – жидкое |
|
| Твердое – газообразное |
|
| Жидкое – жидкое |
|
| Жидкое – газообразное |
|
| Газообразное - газообразное |
|
2. Решите задачи на массовую долю.
1.
Сколько сахара и воды надо взять для приготовления 500 г. 2,5%-ного раствора?
………………………………………………………………………
2.
В 750 г. воды растворили 60 г. AgNO3. Какова массовая доля полученного раствора?
……………………………………………………………….
3.
Какое количество Na2B4O7 и сколько воды надо взять для приготовления 2кг. 5%-ного раствора, рассчитанного на безводную соль?
…………………………………………………………………
4.
В 750 г. воды растворили 60 г. AgNO3. Какова массовая доля полученного раствора?
…………………………………………………………………...
5.
Сколько азотной кислоты содержится в 50 мл. ее водного раствора, концентрация которого 10,68% (ρ=1,062)?
……………………………………………………………………..
6.
Какова массовая доля раствора, полученного при растворении 75 г. K2CO3 в 300 г. воды?
........................................................................................................
7.
Сколько хлороводорода растворено в 50 мл. 38,16 %-ной соляной кислоты (ρ=1,195)?
…………………………………………………………………..
8.
Сколько граммов HCl содержится в 250 мл. 10%-ного раствора, плотность которого 1,05?
……………………………………………………………………….
9.
К 300 г 15%-ного раствора KOH прибавили 300г воды. Определить массовую долю полученного раствора.
………………………………………………………………………...
10.
Найти массовую долю в растворе, 300г которого содержат 30г соли.
11.
Чему равна массовая доля раствора, полученного в результате растворения 90 г вещества в 180 г воды?
……………………………………………………………………..
12.
Сколько граммов поваренной соли и воды необходимо для приготовления 2кг 20%-ного раствора?
…………………………………………………………………….
13.
В 240 мл воды растворили 80 г соли. Какова массовая доля полученного раствора? Плотность воды равна 1г/мл.
………………………………………………………………………
14.
Сколько грамм NaNO3 и воды необходимо для приготовления 1,6 кг 10% раствора?
………………………………………………………………………
15.
Сколько необходимо хлороводорода и воды для получения 1 кг соляной кислоты с массовой долей 33%.
……………………………………………………………………..
16.
Сколько едкого натра содержится в 40мл. раствора, концентрация которого равна 32% (ρ=1,352)?
………………………………………………………………...........................
3. Поиграйте в «крестики – нолики». Покажите вещества или растворы, которые:
а) проводят ток
| Гидроксид натрия (раствор) | Дистиллированная вода | Сульфат натрия (раствор) |
| Сахароза (раствор) | Серная кислота | Спирт |
| Вода, насыщенная кислородом | Азотная кислота (раствор) | Хлорид натрия (раствор) |
б) не проводят ток
| Известковая вода | Гидроксид калия (раствор) | Карбонат калия (твердый) |
| Минеральная вода | Соляная кислота | Нитрат алюминия (раствор) |
| Дистиллированная вода | Глюкоза (твердая) | Глюкоза (раствор) |
4. Составьте возможные уравнения электролитической диссоциации веществ в водных растворах.
KOH………………………………… Ca(OH)2…………………………………
Cu(OH)2………………………….. NaOH……………………………………
LiOH……………………………….. Fe(OH)2………………………………..
HNO3……………………………… H2SiO3……………………………………
H3PO4…………………………….. H2S………………………………………..
NaCl……………………………….. BaSO4……………………………………
KNO3……………………………… Fe(NO3)2………………………………
CaCO3…………………………….. Fe2(SO4)3………………………………
Na3PO4…………………………… Ca3(PO4)2………………………………
Cu(NO3)2……………………….. K2SiO3…………………………………..
5. Запишите молекулярные и ионные уравнения практически осуществимых реакций.
а)Na2CO3+Ca(NO3)2→………………………………………………………………………………………………………………………………………………………………………………
…………………………………………………………………………………………………………
б)Cu(OH)2 + HCl →…………………………………………………………………………..
…………………………………………………………………………………………………………………………………………………………………………………………………………………..
в)NaOH + H3PO4 →……………………………………………………………………………
……………………………………………………………………………………………………………………………………………………………………………………………………………………
г)K2CO3 +HNO3 →……………………………………………………………………………
…………………………………………………………………………………………………………………………………………………………………………………………………………………..
д)KNO3 + Na2SO4 →………………………………………………………………………..
………………………………………………………………………………………………………..
………………………………………………………………………………………………………..
е)Fe(NO3)3 + KOH→………………………………………………………………………..
…………………………………………………………………………………………………………
…………………………………………………………………………………………………………
ж)MgCO3 + HCl →…………………………………………………………………………….
…………………………………………………………………………………………………………………………………………………………………………………………………………………..
Основные классы неорганических соединений.
1. Составьте формулы веществ по названию
а) оксид азота (V)………………………б) оксид хрома (Vl)…………………….
в) оксид серы(lV)……………………… г) оксид железа (lll)…………………….
д) оксид алюминия………………….. е) оксид натрия…………………………..
ж) оксид углерода (lV)……………… з) оксид фосфора (V)…………………..
2. Поиграйте в «крестики – нолики». Покажите выигрышный путь, который составляют формулы:
а) оксидов б) оксидов металлов
| HCI | NaOH | SO2 |
| O2 | Al2O3 | H2O2 |
| FeO | H2SO4 | NaBr |
| SO3 | Fe2O3 | SiO2 |
| CuO | BaO | CO2 |
| NO | K2O | MgO |
в) оксидов неметаллов
| Li2O | NO2 | P2O5 |
| Cl2O7 | BaO | CO2 |
| NO | K2O | MgO |
3. Составьте формулу названных в тексте оксидов
В земной коре – литосфере – находится оксид алюминия…………….. (глина), оксид кремния (IV)……………… (песок), оксид железа (III) ………………(содержится в красном железняке). Водная оболочка Земли – гидросфера – это оксид водорода………………….. В воздухе есть оксид углерода (IV)……………. (углекислый газ) В результате хозяйственной деятельности человека образуются вещества, загрязняющие атмосферу: оксид углерода(II)…………………(угарный газ), оксид серы(IV)……………..(сернистый газ), оксид азота(II) ……………….. и оксид азота (IV)………………….
4. Поиграйте в «крестики – нолики». Покажите выигрышный путь, который составляют формулы основания
а) б)
| H2O2 | CuO | H2O | | NaOH | Cu(OH)2 | Mg(OH)2 | | Ca(OH)2 | HNO3 | BaSO4 | MgCl2 | KOH | Ca(OH)2 |
| CuOH | Ba(OH)2 | Na2O |
| Fe(OH)2 | CaCO3 | LiOH |
5. Составьте формулу оксида, соответствующих гидроксидам.
Например: гидроксид калия - КОН= оксид К2+1О
а) гидроксид железа(lll)………………… = -оксид…………….
б) гидроксид меди (ll)…………………….. = -оксид…………….
в) гидроксид олова (ll)……………………. = - оксид…………….
г) гидроксид свинца(lV)…………………. = - оксид……………….
д) гидроксид натрия ……………………….= -оксид……………..
е) гидроксид алюминия…………………. = -оксид……………..
ж) гидроксид бария…………………………= -оксид………………
6. Определите заряды ионов, степени окисления элементов в кислотах; запишите формулы соответствующих им оксидов.
а) серная кислота……………………………… = -оксид…………….
б) сернокислая кислота…………………….. = -оксид…………….
в) азотная кислота……….……………………. = - оксид…………….
г) азотистая кислота…………………………. = - оксид……………
д) кремниевая кислота. …………………… = -оксид……………..
е) фосфорная кислота………………………. = -оксид……………..
ж) угольная кислота………………………… = -оксид………………
7. Поиграйте в « крестики - нолики». Покажите выигрышный путь, который составляют формулы солей
а) б)
| HNO3 | NaOH | Na2CO3 |
| CuCl2 | Al2(CO3)3 | Na3PO4 |
| Cu(OH)2 | Fe(NO3)2 | Ba (OH)2 |
| H3PO4 | NaNO3 | H2SO4 |
| AlPO4 | K2SiO3 | Na2O |
| HNO2 | Fe2(SO4)3 | FeSO4 |
Выпишите все формулы солей и назовите их
а)………………………………………………………………
………………………………………………………………..
б)…………………………………………………………….
………………………………………………………………
8. Подчеркните формулы солей, содержащих сложные ионы.
H2CO3Na2HNO2MgCO3ZnCl2PвO2BaSO4Fe(NO3)3H2SO4AgClAlPO4H2SiO3Cu(NO3)2HMgOPNO3SO3N2O3C a3(PO4)2Na2S
9. Составьте формулы солей по названиям
а) хлорид калия……………………… б) нитрат меди (ll)……………………
в) фосфат кальция…………………. г) карбонат натрия…………………..
д) силикат калия……………………. е) сульфат алюминия………………..
10. Допишите название, формулы и типы веществ так, чтобы получилась последовательность: формула оксида – тип оксида (основные или кислотные) – формула и тип гидроксида (основание или кислота)
а) Na2O-……………………………..-…….…………………..
б) N2O5-……………………………..-……….………………..
в) Mn2O7-…………………………..-………….……………..
г) CuO-……………………………….-.…………………………
д) SO2-……………………………….-……………….…………
е) SO3-……………………………….-………………….………
ж) FeO-……………………………..-…………………………..
з) CO2-……………………………….-…………………………..
и) P2O5-……………………………..-……………………………
к) CaO-………………………………-………………………….…
11. Составьте уравнения практически осуществимых реакций.
а) K2O + H2O→…………………………………………………………
б) SO3 + H2O→………………………………………………………….
в) CuO + H2O→…………………………………………………………
г) P2O5 + H2O→…………………………………………………………
д) SiO2 + H2O→…………………………………………………………
е) CaO + H2O →…………………………………………………………
ж) N2O5 + H2O→…………………………………………………………
з) FeO + H2O→……………………………………………………………
и) Mn2O7 + H2O→ ………………………………………………………
к) Na2O + H2O→………………………………………………………….
12. Составьте уравнения возможных реакций
а) SO3 + Na2O→……………………………………………………………
б) K2O + MgO →………………………………………………………….
в) CaO +CO2 →…………………………………………………………..
г) N2O5 + BaO→…………………………………………………………
д) SiO2 + P2O5→………………………………………………………..
е) P2O5 + CaO→………………………………………………………..
13. Запишите уравнения возможных реакций
а) HCl + Na2SiO3 →……………………………………………………
б) HNO3 + BaCl→………………………………………………………
в) H2SO4 + Ba(NO3)2 →……………………………………………..
г) HCl + AgNO3 →………………………………………………………
д) H3PO4 + KCl→………………………………………………………..
е) HNO3 + CaCO3 →…………………………………………………..
14. Запишите уравнения практически осуществимых реакций. Если реакция не протекает, укажите причину
а) HCl + Li2CO3→…………………………………………………..
б) H2SO4 + H2SiO3→……………………………………………...
в) HCl + Ag→…………………………………………………………
г) H2SO4 +Ca(NO3)2→……………………………………………
д) HCl + Fe2O3→……………………………………………………
е) HNO3 + H2O →…………………………………………………..
ж) N2O5 + KOH→……………………………………………………
з) H2SO4 + Al→……………………………………………………….
15. Запишите уравнения практически осуществимых реакций. Если реакция не протекает, укажите причину
а) NaOH +N2O5→………………………………………………………
б) Fe(OH)3 + HNO3→…………………………………………………
в) KOH + CaO→……………………………………….………………..
г) Fe(OH)3→………………………………………….…………………..
д) Ba(OH)2 + Fe(NO3)3→……………………….…………………..
е) Ca(OH)2 +NaNO3→…………………………..……………………
16. Вычеркните «лишние» формулы и допишите предложения.
а) H2SO4, HNO3, H3PO4, HCl, H2S – это кислоты, которые не образуют кислых солей, так как................................................
……………………………………………………………………………………………….
б) Ca(OH)2, NaOH, Cu(OH)2, KOH, Fe(OH)2 –это основания, которые не образуют основных солей, так как…………………………………….…..
………………………………………………………………………………………………………
17. Выберите из списка три пары солей, которые будут взаимодействовать друг с другом: карбонат натрия, сульфат бария, силикат натрия, нитрат меди (II), фосфат калия, нитрат серебра и составьте молекулярные и ионные уравнения соответствующих реакций.
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
18. Подчеркните формулы тех веществ, которые составляют генетический ряд и запишите схему этой генетической связи:
LiNO3, Na2O, H2SO4, Li2O, Cu(NO3)2, BaCl2, Li, CO2, LiOH
……………………………………………………………………………………………………….
Составьте уравнения реакций, с помощью которых можно осуществить эту цепочку превращений. Уравнения реакций с участием электролитов напишите в ионной форме
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
19. Контрольная работа «Основные классы неорганических соединений»
ВАРИАНТ 1
Напишите уравнения реакций в ионном виде:
ZnO + HNO3 →
KCl + AgNO3 →
Na2CO3+ H2SO4 →
LiOH + FeCl3 →
Какой объем водорода (н.у.) выделится при взаимодействии 48г магния с соляной кислотой?
Осуществите превращения:
Al → Al2O3 → Al2 (SO4)3 → Al (OH) 3 → AlCl3
Найдите формулу кислоты, имеющей следующий элементный состав: H – 3,7 %; Р – 37,8% ;
О -58,5 %
Укажите, к какому классу относятся данные соединения и дайте им названия:
Са3 (РО4)2, Fe2O3, NaOH, Ca (OH)2, SO2, H2SO3, KCl, MgBr2
Сколько граммов соли и воды надо взять, чтобы получить 40 г 5%- ного раствора?
ВАРИАНТ 2
Напишите уравнения реакций в ионном виде:
HNO3 + KOH →
Zn + H2SO4 →
CuSO4 + BaCl2 →
NaOH + AlCl3 →
Какой объем водорода (н.у.) можно получить при действии разбавленной серной кислоты, взятой в избытке, на 1,2 г. магния?
Осуществите превращения:
Ba → BaO → Ba (OH)2 → BaCO3 → BaO
Найдите формулу кислоты, имеющей следующий элементный состав:
H -3,7%; Р – 37,8 %; О – 58,5%?
К какому классу относятся данные соединения и дайте им названия:
BaO, HCl, NaOH, CO2, Mg(OH)2, SO2, H2CO3, CO, CaCl2, BaCO3, Cr2O3.
Сколько граммов соли и воды нужно взять, чтобы получить 100г 2% - ного раствора?
ВАРИАНТ 3
Напишите уравнения реакций в ионном виде:
Na +H2SO4 →
Ba(OH)2+CO2 →
HNO3+KOH →
K2SO3+MgCl2 →
Какая масса соли получится при взаимодействии 144г оксида железа (ll) с соляной кислотой?
Осуществите превращения:
Mg → MgO → Mg(OH)2 → MgCl2 → MgSO3
Найдите формулу кислоты, имеющей элементный состав:
H -2,4%; S -39,1%; O – 58,5%.
К какому классу относятся данные соединения и дайте им названия:
Al2O3, H2S, Mn(OH)2, K2O, H2SO4, BeO, NaOH, NaHCO3, MgSO3, Kl, Pb(OH)4, SnCl2, CrO3
Сколько граммов соли и воды надо взять, чтобы получить 80г 20% - ного раствора?
ВАРИАНТ 4
Напишите уравнения реакций в ионном виде:
Mn + Ni(NO3)2 →
H2SO4 + NaOH →
ZnO + HNO3 →
CuSO4 + BaCl2 →
Какой объем оксида углерода (lV) (н.у.) выделится при взаимодействии 200г карбоната калия с соляной кислотой?
Осуществите превращения:
Cu→ CuO →Cu Br2→ Cu(OH)2→ CuO →Cu
Какова формула соли, если массовый состав этого вещества равен:
K -56, 6%; С -8,7%; О – 34,8%?
К какому классу относятся данные соединения и дайте им названия:
SiO2, H2CO3, Na2O, HBr, CaHPO4, CО, Cu(NO3)2, Cl2O7, Mg ( OH)2, Cu(OH)2
Сколько граммов соли и воды нужно взять, чтобы получить 120г 30% - ного раствора?
ВАРИАНТ 5
Напишите уравнения реакций в ионном виде:
Na2SO4+ Ba(NO3)2 →
NaOH + SO2 →
HCl + LiOH →
Zn + FeCl2 →
Какой объем водорода (н.у.) выделится при взаимодействии 112 г железа с серной кислотой?
Осуществите превращения:
Na → NaOH → NaCl → NaOH → Na2SO4 → BaSO4
Найдите формулу соли, имеющей следующий элементный состав:
К – 39,67%; Мn – 27,87%; О – 32,46%
Укажите, к какому классу относятся данные соединения и дайте им названия:
H2S, BaBr2, Cr2O3, KMnO4, NaCl, AgNO3, NaHCO3, Ba(OH)2, CaO, P2O5
Сколько граммов соли и воды нужно взять, чтобы получить 50 г 3% - ного раствора?
ВАРИАНТ 6
Напишите уравнения реакций в ионном виде:
BaCl2 + H2SO4 →
Al + CuSO4 →
K2SO3 + HCl →
FeCl3 + KOH →
Какая масса соли получится при взаимодействии 162г оксида цинка с серной кислотой?
Осуществите превращения:
Fe → FeCl3 → Fe(OH)3 → Fe2O3 → Fe2(SO4)3 → Fe(OH)3
Найдите формулу соли, имеющей следующий элементный состав:
Mg -9,9%; S- 13%; О – 71,4% ; Н – 5,7%.
Укажите, к какому классу относятся данные соединения и дайте им названия:
LiOH, MgHPO4, CaCl2, NiO, H2SiO3, NaBr, CaS, Al2(SO4)3, Cr2O3, Ca(OH)2
Сколько граммов соли и воды нужно взять, чтобы получить 200г 1% - ного раствора?
Заполните в таблице пустые клеточки. Укажите характер среды:
| [Н+ |
| 10-7 |
|
| 10-4 | 10-11 |
| [ОН-] | 10-1 |
| 10-12 | 10-7 |
|
|
| рН |
|
|
|
|
|
|
| Среда |
|
|
|
|
|
|
Металлы и неметаллы
1. Заполните таблицу «Сравнение свойств элементов – металлов и элементов – неметаллов»
| Признаки сравнения | Металлы | Неметаллы |
| Положение в периодической системе |
|
|
| Особенности строения атомов (число ē на внешнем уровне, радиус атома) |
|
|
| Окислительно – восстановительные свойства |
|
|
Заполните таблицу « Сравнение свойств простых веществ металлов и неметаллов» и их соединений.
| Признаки сравнения | Металлы | Неметаллы |
| Химическая связь |
|
|
| Кристаллическая решетка |
|
|
| Физические свойства |
|
|
| Окислительно – восстановительные |
|
|
| Характер оксидов |
|
|
| Характер гидроксидов |
|
|
3. Укажите в таблице состав сплавов. Из букв, соответствующих основному компоненту сплавов, вы составите название самого твердого металла: , а из букв, соответствующих тем металлам, которых в сплавах меньше, - название драгоценного металла: .

| Название сплавов
| Металл, входящий в состав сплава |
| Al | Sn | Mg | Zn | Mn | Cu | Ni |
| Бронза | С | П | Е | У | Ш | Х | Б |
| Латунь | А | Ф | Н | Л | В | Р | Ц |
| Мельхиор | Г | В | Ш | Ю | Н | О | А |
| Дюралюминий | М | Я | Т | Б | И | Н | А |
4. Запишите уравнения практически осуществимых реакций. Если реакция не протекает, укажите причину
а) Mg + HCl→……………………………………………………….……………………
б) Zn + H3PO4→…………………………………………………………………………
в) Al + H2SO4 (разб.)→………………………….………………….
г) Ag + HCl→………………………………………………………….………………….
д) Fe + HCl→……………………………………………………………………………..
е) Pв + H2SO4 (разб.) →………………………….…………………
ж) Al + HCl→…………………………………………………………….……………….
5. Поиграйте в «крестики – нолики». Найдите выигрышный путь, состоящий из названий наиболее часто используемых в пирометаллургии восстановителей
| Кислород | Хлор | Серебро | Магний |
| Углерод (кокс) | Алюминий | Водород | Оксид углерода (II) |
| Вода | Кальций | Фтор | Оксид алюминия |
| Медь | Сера | Железо | Оксид углерода (IV) |
Запишите уравнения реакций для переходов:
а)Ca → CaO→ Ca(OH)2 → Ca(NO3)2 → Ca3(PO4)2
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
б)Fe  FeCl3
FeCl3 ………………
……………… ……………………
……………………  Fe
Fe  FeCl2
FeCl2
……………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………

 Получите свидетельство
Получите свидетельство Вход
Вход




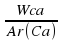 :
: 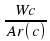 :
: 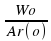 =…………………………………
=…………………………………


 а) Окислители -
а) Окислители - 








 Решебник по неорганической химии (0.16 MB)
Решебник по неорганической химии (0.16 MB)
 0
0 3331
3331 91
91 Нравится
0
Нравится
0





