_____________________________________________________________________________
«Растворы.
Применение знаний о растворах в игровой деятельности».
Автор: Соколова Елена, 6 класс
Руководитель: Водякова О. Н.
учитель химии
МКОУ Березовская оош
2015
План
| I. Введение………………………………………………………………. | стр.3 | ||
| II. Основная часть ………………………………………………………. | стр.5 | ||
| Теоретическая часть | |||
| 2.1 | Растворы. Вода-растворитель. Приготовление растворов…….. |
стр.5 | |
| 2.2 | Приборы и материалы для проведения исследования. ………………………..………………. |
стр.10 | |
| 2.3 | Техника безопасности при проведении эксперимента ………………………………………… |
стр.10 | |
| Практическая часть |
| ||
| 2.4 | Приготовление растворов с разной концентрацией.. | стр.11 | |
| 2.5 | Тестирование мыльных пузырей……………………. | стр.14 | |
| 2.6 | Экономические расчеты……………………………... | стр.16 | |
| III. Заключение …………………………………………………………. | стр.18 | ||
| IV. Список литературы ………………………………………………… | стр.20 | ||
| V. Приложения………………………………………………………….. | стр.21 | ||
Введение
Сегодня я приглашаю вас в мир моего детства. Какая я? Любопытная, наблюдательная и конечно есть желание поэкспериментировать. Экспериментальная работа дает возможность мне почувствовать себя в роли ученого, приоткрывающего дверь в новое, неизвестное. Только самостоятельно добывая в эксперименте знания, я могу получить уверенность в его истинности и справедливости. Но для того, чтобы начать эксперимент я должна изучить теоретические основы интересующей меня темы. Итак, меня интересует тема: «Растворы и как их можно использовать в повседневной игре».
Цель:
- изучить тему - «Растворы»;
- научиться применять знания о растворах.
Задачи:
- изучить теоретические знания о растворах;
- применить полученные знания в практической деятельности;
- найти экспериментальным путем наилучший состав раствора;
- исследовать свойства разных растворов.
Методы исследования
- наблюдение (исследование внешних признаков и видимых изменений на протяжении определенного промежутка времени);
- эксперимент (проверка верности выдвинутой гипотезы)
- сравнительный анализ (исследование сходства и различия в строении, протекании процессов и поведении объектов);
- описательный (фиксирование наблюдаемых внешних признаков объекта исследования). [7]
Гипотеза: действительно ли выполнение простых операций со знакомыми нам веществами являются научными. Применимы ли знания химии о растворах в игровой деятельности.
Учусь я еще в 6 классе и с наукой химией не знакома, тем не менее, очень часто приходится слышать такие слова как – раствор. И я решила узнать, что же это такое и где их можно применить. Оказывается, что я сама практически ежедневно готовлю различные растворы: например - чай или смешиваю различные цвета красок. Что же это неужели я уже занимаюсь химией?
II. Основная часть
Теоретическая часть
2.1 Растворы.
Вода-растворитель. Приготовление растворов.
Из курса природоведения и из повседневной жизни нам известно, что в воде растворяются и твердые вещества (сахар, соль), и жидкости (уксусная кислота), и газы (кислород). Так, например, газированная вода – это раствор оксида углерода в воде. Следует иметь в виду, что характерным признаком растворов является их однородность. Процесс растворения веществ в воде это не только физическое явление, т.е. механическое перемешивание веществ. Растворами называются однородные системы, состоящие из молекул растворителя и частиц растворенного вещества, между которыми происходят физические и химические взаимодействия. [1, с.78] Растворы всегда однородны, как правило, прозрачны, растворённые вещества в растворе не отличаются от растворителя, между ними нельзя определить границу, они не отстаиваются. По агрегатному состоянию растворы делятся:
- газообразные растворы: воздух – это раствор кислорода, паров воды, углекислого газа СО2 и благородных газов в азоте;
- твердые растворы: сплавы металлов;
- жидкие растворы.[9]
Раствор - система, состоящая из двух или более независимых компонентов (растворенное вещество и растворитель - компоненты раствора), а также продуктов их взаимодействия. Компонент, количество которого преобладает в данной системе, называют растворителем. [8] Особую роль на нашей планете играет вода. Из всех жидкостей вода служит наилучшим растворителем, обладает наибольшей теплоёмкостью. Вода входит в состав клеток и тканей любого животного и растения. Вода - самый распространенный растворитель для твердых, жидких и газообразных веществ. Водные растворы могут быть как бесцветными, так и окрашенными. Среди жидких растворов, кроме водных, бывают спиртовые, керосиновые и др.
Для приготовления растворов нам нужна «хорошая» вода. Всем известно, что в дождевой воде мыло хорошо пенится (мягкая вода), а в ключевой –обычно плохо (жесткая). Анализ жесткой воды показывает, что в ней содержатся значительные количества растворимых солей кальция и магния. Эти соли образуют с мылом нерастворимые соединения. Встречаются карбонатная, или временная, жесткость воды обусловлена присутствием гидрокарбонатов кальция и магния. Её можно устранить следующими способами:
Кипячением
Действием соды (гидрокарбонат натрия).
Некарбонатная, или постоянная жесткость воды обусловлена присутствием сульфатов и хлоридов кальция и магния. Её устраняют действием соды. [2, с. 123-124] С другой стороны, раствор - это не обязательно смесь воды с другими веществами. Растворы бывают и безводными. Например, сплавы металлов, смеси разных газов и др. Поэтому растворы бывают не только жидкими, но и твердыми и газообразными. Из повседневной жизни хорошо известно, что если некоторые вещества растворяются в воде, то при этом образуются растворы. Для характеристики способности вещества растворяться введено понятие «растворимость». По отношению к воде вещества делятся на: хорошо растворимые, малорастворимые, и нерастворимые. Вещества, которые вода растворяет, образуют с ней однородную смесь, т. е. в воде нельзя увидеть отдельные частицы или слои вещества. Нерастворимые в воде вещества плавают в ней в виде частиц, или слоев жидкости, либо оседают на дно.
Растворимость многих веществ небезгранична. Для большинства твердых веществ с повышением температуры растворимость увеличивается. [1, с. 79] Согласно современным представлениям растворение есть результат химического взаимодействия растворителя и растворенного вещества, при этом образуются молекулярные соединения. В водных растворах эти соединения называются гидратами.
А какие же нам известны растворы?
Относительное содержание компонента в растворе характеризуется его концентрацией. [3] Растворы бывают разбавленные и концентрированные. В разбавленных растворах по отношению к растворителю растворенного вещества мало; в концентрированных растворах его много. Растворимость (коэффициент растворимости) – максимально возможное число граммов вещества, которое может растворяться в 100граммах растворителя при данной температуре [1, с.79]
По соотношению преобладания частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные. Насыщенный раствор - это раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества. Раствор, концентрация которого ниже концентрации насыщенного раствора называется ненасыщенным. В таком растворе можно при тех же условиях растворить дополнительное количество того же самого вещества.
Если раствор, насыщенный при нагревании, осторожно охладить до комнатной температуры так, чтобы не выделялись кристаллы соли, то образуется перенасыщенный раствор. Таким образом, перенасыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем возможно в насыщенном растворе. Перенасыщенный раствор нестабилен, и при изменении условий (например при энергичном встряхивании или внесении кристаллика соли – затравки для кристаллизации) образуется насыщенный раствор и осадок кристаллов соли. [1, с.79] Таким образом, растворы - это однородные (гомогенные) смеси веществ. При этом в растворе растворителем считается вещество, которое находится в избытке и в том же агрегатном состоянии, что и сам раствор. При образовании растворов может поглощаться и выделяться теплота. Например, при растворении в воде серной кислоты температура сильно повышается. Это говорит о том, что образование раствора не рассматривается как химическая реакция, какое-то взаимодействие между молекулами происходит. Водные растворы кипят при более высокой температуре, а замерзают при более низкой. Все это говорит о том, что растворение веществ, следует относить к физико-химическим явлениям. [2, с.6]
Какова роль растворов в природе и технике?
Растения усваивают вещества в виде растворов;
Усвоение пищи связано с переводом питательных веществ в раствор;
Все природные воды являются растворами;
Растворами являются важнейшие физиологические жидкости – кровь, лимфа;
Многие технологические процессы в химической и других отраслях промышленности, например получение соды, удобрений, кислот, металлов, бумаги, протекают в растворах.
Таким образом, значение растворов велико.
Способы выражения концентрации растворов
Относительное содержание компонента в растворе характеризуется его концентрацией. [8] Концентрацию веществ в растворах можно выразить разными способами. Наиболее часто используют массовую долю растворённого вещества.
Массовая доля растворённого вещества w (омега) - это величина, равная отношению массы растворённого вещества к общей массе раствора m:
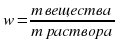
Для определения массы вещества необходимой для проведения расчетов нам потребовалась еще одна физическая величина - плотность. Каждое вещество занимает некоторый объём. И может оказаться, что объёмы двух тел равны, а их массы различны. В этом случае говорят, что плотности этих веществ различны.
В физике плотность обозначают греческой буквой ρ (ро). Плотность равна отношению массы тела к его объёму. Плотность = масса * объём (ρ = m*V, где m - масса, V - объём). [12]
Плотности используемых веществ
Таблица 1
| № п/п | Вещество | Плотность,г/мл |
| 1 | Вода | 1,0 гр/см3 |
| 2 | Моющее вещество | 1,1 гр/см3 |
| 3 | Глицирин | 1,26 гр/см3 |
| 4 | Нашатырный спирт | 0,95 гр/см3 |
[5], [11]
Единицы измерения объема 1см3=1мл. объемы жидкостей измеряют с помощью мерных стаканчиков, мензурок. [13]
Тогда необходимая нам масса тела выражается через плотность и объем следующей формулой.
m = ρ*V
Масса тела - есть произведение плотности вещества, из которого состоит тело на его объем. [14]
Найденная массовая доля в Приложениях 1,2
2.2 Приборы и материалы для проведения исследования.
Я, как и все дети люблю выдувать мыльные пузыри. Сегодня их можно купить в магазине, но они не всегда соответствуют нужным мне требованиям. Поэтому я решила, приготовить раствор для мыльных пузырей сама. В этом мне поможет наука химия и полученные мною знания по растворам.
Для проведения эксперимента готовим приборы и материалы: стеклянные трубочки, мерные стаканчики, весы с разновесом, штатив, фильтр, воронка, пластмассовые стаканы, маркер, трубочки для коктейля. Готовые моющие вещества, сода, глицерин, вода, сахар. Также для проведения эксперимента нам потребуется тетрадь для записей и фотоаппарат для фиксирования хода эксперимента.
2.3 Техника безопасности при проведении эксперимента
Изучая, теоретические данные я выяснила, что нельзя приступать к эксперименту не соблюдая всех «Правил безопасной работы в химической лаборатории». Знания этих правил является необходимым условием выполнения эксперимента и контролируется учителем. [6]
- использование только чистой посуды и проверка ее на целостность;
-брать вещества необходимо специальными ложечками;
-для перемешивания раствора необходимо использовать специальные стеклянные трубочки (палочки);
-нельзя пробовать на вкус вещества.
С веществами неизвестными
Не проводи смешивания неуместные:
Незнакомые растворы ты друг с другом не сливай
Не ссыпай в одну посуду, не мешай, не поджигай!
Из этого я поняла, что даже простые опыты могут быть не безобидными и требуют тщательной подготовки. Но поскольку я используемые химические моющие вещества после работы я, обязательно помою руки.
Практическая часть
Приготовление растворов с разной концентрацией
Наконец, освоив все азы, я принялась за эксперимент.
Изучив, в интернете большое количество рецептов приготовления растворов для приготовления мыльных пузырей я приступила к своему эксперименту. Купив в магазине два разных раствора, обнаружила, что даже магазинные растворы очень сильно отличаются друг от друга по качеству мыльных пузырей.
Я поставила себе задачу найти экспериментальным путем наилучший состав раствора для получения мыльных пузырей:
1. Самых больших по объему мыльных пузырей,
2. По количеству мыльных пузырей,
3. Наиболее прочных (время жизни дольше) мыльных пузырей,
4. Наиболее красивых (радужных) мыльных пузырей,
Для работы с разными моющими веществами я взяла для приготовления растворов за основу опыта взяла 1 раствор, т.к. для данного состава необходимы вещества в небольшом количестве. В ходе выполнения опыта все данные занесла в таблицу 1. [10]
Раствор для приготовления мыльных пузырей
Берем 60 мл воды,
добавляем 20 мл моющего средства,
20 мл глицерина.
Раствор готов.
Показатель качества мыльных пузырей.
Таблица 2.
| Состав | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Моющие вещества | Pril | Fairy | Sorti | Весна | Пена для ванн | Жидкое хозяйственное мыло | Твердое хозяйственное мыло | Готовые растворы |
| Показатель (получения мыльных пузырей) | + | + | + | + | + | + | - | + |
Вывод: все моющие вещества оказались вполне пригодными для приготовления мыльных пузырей. За исключением твердого хозяйственного мыла. Опыт с хозяйственным мылом я решила оставить, так как этот раствор имел специфически неприятный запах, мутный осадок и пузыри быстро лопались, попадали на лицо. Из моющих средств наиболее густым по консистенции было “Fairy” с ним и решили продолжить дальнейший эксперимент.
2. Для проведения второго опыта решили проверить качество мыльных пузырей относительно концентрации моющего вещества в растворах. (Приложение 1 – составы растворов). Всего взяли восемь разных растворов и рассчитали массовые доли моющего вещества в растворах.
Таблица 3
| Состав | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| Показатель (W%) | 16 | 35 | 1,8 | 5 | 35 | 5 | 13 | 20 |
| Показатель мыльных пузырей | Хор | Хор | Удов | Удов | Хор | Хор | Хор | Хор |
Вывод: концентрация моющих веществ в растворах влияет на качество мыльных пузырей, чем ниже концентрация вещества, тем меньше размеры и срок жизни мыльных пузырей. Оказалось, что для показателя – срока жизни мыльного пузыря; размера мыльных пузырей большое влияние оказывает глицерин. Поэтому для изучения раствора необходимого для приготовления мыльных пузырей в дальнейшем за основу решили взять концентрацию глицерина.
3. Для проведения дальнейшего эксперимента взяли за основу один состав и стали изменять в нем концентрацию глицерина для подбора оптимальной.
Приготовили 4 раствора с разной массовой долей по глицерину (таблица 2). Раствор:
-100мл кипяченной воды;
-2гр соды;
-20мл моющего вещества;
- глицерин.
Для расчета концентрации глицерина по формуле. Применили известную плотность веществ. Таблица 1.
Массовая доля глицерина в растворе
Таблица 4
| № раствора | Вода, мл. | Сода,гр. | Моющее вещество, мл. | Глицерин,мл. | Общий объем, мл. | Массовая доля глицерина, % |
| 1 | 100 | 2 | 20 | 12 | 134 | 11 |
| 2 | 100 | 2 | 20 | 25 | 147 | 20 |
| 3 | 100 | 2 | 20 | 37 | 159 | 27 |
| 4 | 100 | 2 | 20 | 50 | 172 | 34 |
Таблица 5
| № раствора | Вода, гр | Сода,гр | Моющее вещество, гр | Глицерин, гр | Общий вес, гр | Массовая доля глицерина, % |
| 1 | 100 | 2 | 20 | 15,12 | 139 | 11 |
| 2 | 100 | 2 | 20 | 31,5 | 155 | 20 |
| 3 | 100 | 2 | 20 | 46,62 | 170 | 27 |
| 4 | 100 | 2 | 20 | 63 | 187 | 34 |
Вывод: В ходе изучения растворов установлено, что наиболее практичным является раствор № 4 с массовой долей растворенного вещества 34%. Следовательно, качество мыльных пузырей напрямую зависит от концентрации раствора.
2.5 Тестирование мыльных пузырей
Для определения качества мыльных пузырей провели серию опытов (тестирование) по следующим показателям таблица
Тестирование мыльных пузырей
Таблица 6
| № раствора | 1 | 2 | 3 | 4 |
| Концентрация раствора по массовой доле глицерина | 11% | 20% | 27% | 34% |
| Время жизни пузыря | 3 мин. | 5 мин. | 15 мин. | 27 мин. |
| Средний размер | 5-6 см | 10-15 см | 15-25см | 30-35 см |
| Тест «матрешка» | Плохо | Удовлетворительно | Отлично | Отлично |
| Большой пузырь | Плохо | Плохо | Хорошо | Отлично |
Вывод: мы провели серию экспериментов по проверке качества состава мыльных пузырей относительно концентрации растворов. Оказалось, что качество мыльных пузырей напрямую зависит от концентрации растворов. Определили, что самым лучшим, раствором будет раствор № 4 с концентрацией глицерина 29%.
Для приготовления мыльных пузырей я остановилась на растворе № 4, с массовой долей глицерина w=29% потому, что мыльные пузыри из данного раствора отвечают всем моим требованиям.
Взаимодействие мыльных пузырей с различными поверхностями
Визуально наблюдала взаимодействие мыльных пузырей раствора № 4 с различными поверхностями (поверхность покрытая тканью, линолеум, стекло). Таблица 2
Взаимодействие с поверхностями
Таблица 7
| Стеклянное окно | Линолеум | Поверхность покрытая тканью |
| Если пузырь выдувать далеко от стекла, то при столкновении они быстро лопнуть. А если выдувать пузырь близко к стеклу, то пузырь прилипнет к нему | При столкновении с более твердой и гладкой поверхностью, пузыри быстро лопаются | Когда мыльные пузыри попадают на ткань, то они отскакивали от него как мячики |
Вывод: наблюдается лучшее взаимодействие мыльного пузыря и шерстяного ковра. Я узнала, что это явление называется электризация. Это явление можно использовать в игре с маленькими детьми. Если хотите увидеть чудо, то надувайте мыльные пузыри очень близко к стеклу или возле окна.
Советы как проверить качество мыльных пузырей:
Пузырь диаметром 30 мм должен прожить не менее 30 секунд.
Обмакнуть палец в мыльный раствор и быстро проткнуть мыльный пузырь, если пузырь не лопнул, значит, раствор у вас получился правильный.
2.6 Экономические расчеты
По завершению опытов я решила подсчитать, сколько денежных средств мы затратили на приготовление мыльных пузырей в домашних условиях.
Стоимость веществ
Таблица 8
| Вещество | Цена, рублей | Стоимость вещества, взятого для приготовления раствора, рублей | |
| Вес, объем вещества для нашего раствора | Цена за 1 норму компонента | ||
| Моющее вещество «Fairy». | 63руб за 500мл | 20мл | 4 руб |
| Сода | 25 руб за 500грамм | 2гр | 0,1 руб (10коп) |
| Глицирин | 12 рублей за 25 мл | 50мл | 24 руб |
| Вода | - | 100мл | - |
| Общая стоимость мыльного раствора | 172мл | 28руб 10коп | |
Вывод: готовый раствор в магазине объемом 150мл стоит 42 рубля, а наш раствор объемом 172 мл стоит – 28,1рублей (150мл будет стоить 24,5 рублей) т.е. приготовленный в домашних условиях мыльный раствор оказался дешевле магазинного при значительном улучшении качества товара.
Мой раствор для приготовления мыльных пузырей
Как бы хорошо не были изучены имеющиеся растворы для приготовления мыльных пузырей. Я все же решила изобрести свой собственный раствор. В ходе эксперимента я убедилась, что для разного вида пузырей растворы должны быть разными.
- 100 мл кипяченной воды
- 2 гр соды
- 20 мл детского шампуня «Карапуз»
- белок 1 яйца (охлажденный) взбить, смешать с 1чайной ложкой сахара
Все это тщательно перемещать и можно пускать пузыри.
Поверьте, используя, имеющиеся дома вещества мы получаем очень красивые и долго живущие пузыри, с которыми интересно экспериментировать.
III. Заключение:
Мыльные пузыри - это чудо, которое привлекает не только детей, но и взрослых. В ходе исследования мы смогли определить наиболее подходящие концентрации растворов.
Мыльные пузыри замерзают на морозе, но не разбиваются на осколки, а делаются пластичными.
В ходе работы мною были проверены рецепты мыльных пузырей и сделаны выводы:
Для получения крупных устойчивых пузырей необходим раствор с с повышенной концентрацией глицерина. Наиболее подходящим является раствор № 4.
Вода должна быть мягкой, лучше подходит дистиллированная вода;
Для смягчения жесткости воды можно использовать соду (NaHCO3) гидрокарбонат натрия;
Размеры и окраска получаемых пузырей зависят от качества моющего средства и от его вида. Наилучшие результаты дает синтетическое средство для мытья посуды «Fairy».
Раствор мыльных пузырей, простояв сутки, не портится, а пузыри из такого раствора становятся более долговечными.
Человек использует мыльные пузыри в быту при уборке помещений, удаления жировых загрязнений, купании детей, при стирке, на радость детям и взрослым. То есть пузыри не только для развлечения, но и для практического значения. Важно правильно их приготовить с учетом знания о растворах.
Понять природу мыльных пузырей мне помогла наука химия и знания, полученные по теме «Растворы». Я желаю всем начинать знакомство с наукой химией - с экспериментальной деятельности.
В ходе эксперимента подтвердилась моя гипотеза. Выполнение простейших операций со знакомыми нам веществами действительно объяснимы с точки зрения науки и являются научными. И второе знания химии о растворах действительно применимы в игровой деятельности. Таким образом, своей работой я могу показать, что знания, получаемые нами в школе, применимы к нашей повседневной жизни.
Свой опыт я продемонстрировала для детей в детском саду и в 8 классе на внеклассном мероприятии, ведь именно изучение темы «Растворы» изучается в 8 классе. И такое зрелищное мероприятие поможет учащимся лучше разобраться в природе растворов. Поставленные задачи я выполнила полностью. Созданный мной рецепт мыльных пузырей, безопасен для маленьких детей. Все компоненты являются натуральными и экологически чистыми.
IV. Список литературы
Рудзитис Г.Е. Химия 8 класс.- М.:Просвещение, 2008. – 173с;
Рудзитис Г.Е. Химия 9 класс.- М.:Просвещение, 2008. –191с;
Ребиндер А.Б. «Мыльные пузыри» отрывки из книги Ч. Бойса «Мыльные пузыри».- М: «Химия и жизнь» стр. 88;
Перышкин А.В.Физика 7 класс. М.: Дрофа , 2001. – 189с.;
Жуков С.Т. Химия 8-9класс. http://www.chem.msu.su/rus/school/zhukov1/05a.html#5.10 ;
http://www.km.ru/referats/335328-obuchenie-uchashchikhsya-pravilam-bezopasnosti-pri- provedenii-khimicheskogo-eksperimenta;
http://biogdz.ru/9-klass/metody-issledovaniya-v-biologii.html;
http://www.chemport.ru/data/chemipedia/article_3229.html ;
https://www.google.ru/url?sa=t&rct=j&q=&esrc=s&source=web&cd=8&ved=0CE4QFjAH&url=http%3A%2F%2Fwww.novsu.ru%2Ffile%2F764544&ei=CvvpVIeoBYG6UPOOgagM&usg=AFQjCNGmJEGoQb3nUT1e9vcPlq7KP158Dw&bvm=bv.86475890,d.d24&cad=rjt ;
http://gosptovary.uaprom.net/p14531904-moyuschee-sredstvo-fejri.html ;
http://www.cniga.com.ua/index.files/nashatir.htm ;
http://www.yaklass.ru/p/fizika/7-klass/dvizhenie-i-vzaimodeistvie-tel-11864/plotnost-veshchestva-raschet-massy-i-obema-tela-po-ego-plotnosti-11869/re-6770280e-f5e5-4763-ba1d-574b01a8c13f ;
http://www.chemistry.ssu.samara.ru/chem3/z2_2.htm
http://www.convert-me.com/ru/convert/volume/
Приложение 1.
Определение концентрации моющего вещества в растворах
| № раствора | Массовая доля моющего вещества |
| Состав 1. 160 мл воды, 30 мл моющего средства, 10 мл глицерина
| Состав 1. 160*1гр/см3=160гр воды, 30*1, 1гр/см3=33гр моющего средства, 10*1,26 1гр/см3=12,6гр глицерина W(моющ.в-во)=33/205,6=0,16*100=16% |
| Состав 2. 15мл кипяченой воды | 15*1 гр/см3=15гр воды, 50*1,1 гр/см3=55гр моющего средства, 4гр сахара W(моющ.в-во)=55/155,9=0,35*100=35% |
| Состав 3. | 100 *1 гр/см3=100гр воды W(моющ.в-во)=2,2/119,55=0,018*100=1,8% |
| Состав 4. | 60 *1 гр/см3=60гр воды W(моющ.в-во)=5/104,7=0,05*100=5% |
| Состав 5. 30гр моющего средства. | 10 *1 гр/см3=10гр воды, 30*1,1 гр/см3=33гр моющего средства, 50гр сахара |
| Состав6. 20 мл моющего средства, 40 мл дистиллированной воды | 40*1гр/см3=40гр воды, 20*1,1 гр/см3=22гр моющего средства, W(моющ.в-во)=3,78/65,78=0,05*100=5% |
| Состав7. | 120 *1 гр/см3=120гр воды, 40*1,1 гр/см3=44гр моющего средства, W(моющ.в-во)=25,2/189,2=0,13*100=13% |
| Состав 8. 100мл воды 20мл моющего вещества 25мл глицерина
| 100 *1 гр/см3=100гр воды, 20*1,1 гр/см3=22гр моющего средства,\ W(моющ.в-во)=31,5/153,5=0,20*100=20% |
Приложение 2.
Определение концентрации глицерина в растворах
| № раствора | Массовая доля глицерина |
| Состав 1. 100мл воды 2гр соды 20 мл моющего вещества 12 мл глицерина |
100 *1=100гр воды 20 *1,1=22гр моющего средства, |
| Состав2. 100мл воды 2гр соды 20 мл моющего вещества 25 мл глицерина |
100 *1=100гр воды 20 *1,1=22гр моющего средства, |
| Состав 3. 100мл воды 2гр соды 20 мл моющего вещества 37 мл глицерина |
100 *1=100гр воды 20 *1,1=22гр моющего средства, |
| Состав 4. 100мл воды 2гр соды 20 мл моющего вещества 50 мл глицирина |
100 *1=100гр воды 20 *1,1=22гр моющего средства, |
Глицирин (по физическим свойствам глицерин - это густая сиропоподобная жидкость без запаха и цвета, сладкая на вкус, хорошо растворимый в воде. Свойства глицерина отражает его название «масляный сахар», применяемая в VIII в., Когда глицерин впервые добыт из оливкового масла. Глицерин имеет высокую температуру кипения 290 0С, неядовитый).
Глицерин - представитель трехатомных спиртов. По систематической номенклатуре, глицерин называется 1,2,3-пропантриол. В его молекуле каждый атом углерода связан с гидроксильной группой. Молекулярная формула глицерина C3H8O3.
Решение задач:
Единицы измерения: 1см3=1мл.
m = ρ*V m= m вещества/ m раствора

 Получите свидетельство
Получите свидетельство Вход
Вход











 Растворы. Применение знаний о растворах в игровой деятельности. (77.93 KB)
Растворы. Применение знаний о растворах в игровой деятельности. (77.93 KB)
 0
0 1447
1447 73
73 Нравится
0
Нравится
0


