Государственное бюджетное образовательное учреждение
города Москвы
средняя общеобразовательная школа № 626 имени Н.И. Сац
| Утверждаю
Директор ГБОУ СОШ № 626
___________Радзевич В. Ю._
Приказ № ____
от «____» ________ 2013 г.
| Рассмотрено
на МО учителей естественно-научного цикла
Протокол № ______
от «____» _________ 2013 г.
Руководитель МО _________ А.А.Антошкина |
Рабочая учебная программа по
химии (базовый уровень)_
Основного среднего (основного) общего образования___8 класс_
2013-2014 учебный год
Рабочая программа по химии составлена в соответствии с федеральным компонентом государственного стандарта основного общего образования, одобренным совместным решением коллегии Минобразования России и Президиума РАО от 23.12.2003 г. № 21/12 и утвержденным приказом Минобрнауки РФ от 05.03.2004 г. № 1089 и примерной программы основного общего образования (письмо Департамента государственной политики в образовании Минобрнауки России от 07.07.2005г. № 03-1263).
Программу составила _ Гребенюк Татьяна Николаевна________
г. Москва
2014 г.
ПОЯСНИТЕЛЬНАЯ ЗАПИСКА
Рабочая программа по химии составлена в соответствии с федеральным компонентом государственного стандарта основного общего образования, одобренным совместным решением коллегии Минобразования России и Президиума РАО от 23.12.2003 г. № 21/12 и утвержденным приказом Минобрнауки РФ от 05.03.2004 г. № 1089 и примерной программы основного общего образования (письмо Департамента государственной политики в образовании Минобрнауки России от 07.07.2005г. № 03-1263).
За основу рабочей программы взята программа курса химии для 8-11 классов общеобразовательных учреждений (автор Н.Н.Гара), рекомендованная Департаментом образовательных программ и стандартов общего образования Министерства образования РФ, опубликованная издательством «Просвещение» в 2008 году (Гара Н.Н. Программы общеобразовательных учреждений. Химия.- М.: Просвещение, 2008. -56с.).
Рабочая программа может быть реализована в 8 классе (2 ступень, основное общее образование, общеобразовательный уровень). Учебники линии Г.Е.Рудзитиса и Ф.Г.Фельдмана..
В рабочей программе нашли отражение цели и задачи изучения химии на ступени полного общего образования, изложенные в пояснительной записке Примерной программы по химии.
Изучение химии в основной школе направлено на достижение следующих целей:
освоение важнейших знаний об основных понятиях и законах химии, химической символике;
овладение умениями наблюдать химические явления, проводить химический эксперимент, производить расчеты на основе химических формул веществ и уравнений химических реакций;
развитие познавательных интересов и интеллектуальных способностей в процессе проведения химического эксперимента, самостоятельного приобретения знаний в соответствии с возникающими жизненными потребностями;
воспитание отношения к химии как к одному из фундаментальных компонентов естествознания и элементу общечеловеческой культуры;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, сельском хозяйстве и на производстве, решения
Общая характеристика учебного предмета
Весь теоретический материал курса химии для основной школы структуирован по шести блокам: Методы познания веществ и химических явлений. Экспериментальные основы химии; Вещество; Химическая реакция; Элементарные основы неорганической химии; Первоначальные представления об органических веществах; Химия и жизнь. Содержание этих учебных блоков в авторских программах направлено на достижение целей химического образования.
В курсе 8 класса учащиеся знакомятся с первоначальными понятиями: атом, молекула, простое и сложное вещество, физические и химические явления, валентность; закладываются простейшие навыки в написании знаков химических элементов, химических формул простых и сложных веществ, составлении несложных уравнений химических реакций; даются понятия о некоторых химических законах: атомно – молекулярном учении, законе постоянства состава, законе сохранения массы вещества; на примере кислорода и водорода углубляются сведения об элементе и веществе. Учащиеся изучают классификацию простых и сложных веществ, свойства воды, оксидов, кислот, оснований, солей; закрепляют практические навыки, необходимые при выполнении практических и лабораторных работ. Изучаются структура периодической системы химических элементов Д.И.Менделеева, периодический закон, виды химической связи.
Рабочая программа рассчитана на 69 часов в VIII классе, из расчета - 2 учебных часа в неделю, из них: для проведения контрольных - 4 часов, практических работ – 6 часов.
Преобладающими формами текущего контроля знаний, умений и навыков являются самостоятельные и контрольные работы, различные тестовые формы контроля.
Промежуточная аттестация проводится согласно локальному акту образовательного учреждения в форме контрольных работ, а итоговая – в форме теста.
При организации учебного процесса используются следующие формы: уроки изучения новых знаний, уроки закрепления знаний, комбинированные уроки, уроки обобщения и систематизации знаний, уроки контроля, практические работы, а также сочетание указанных форм.
Распределение часов по темам составлено по авторской программе с использованием резервного времени. Формулировка названий разделов и тем – соответствует авторской программе. Включены элементы содержания (авторская программа):
Закон Авогадро Расчетные задачи.
Объемные отношения газов при химических реакциях, решение задач.
Тема урока совпадает с названием параграфа учебника, кроме уроков «Вычисления по химическим уравнениям» и «Связь между классами неорганических соединений" (содержание в тексте в виде абзацев). Все демонстрации, лабораторные опыты и практические занятия взяты из Примерной программы.
ТРЕБОВАНИЯ К УРОВНЮ ПОДГОТОВКИ УЧАЩИХСЯ
В результате изучения химии в 8 классе учащиеся должны
знать/понимать
важнейшие химические понятия, основные законы химии, основные теории химии, важнейшие вещества и материалы.
уметь
называть, определять, характеризовать вещества, объяснять явления и свойства, выполнять химический эксперимент
использовать
Тема 1 «Первоначальные химические понятия» - 18 часов
Учащиеся должны знать:
определение важнейших понятий: простые и сложные вещества, химический элемент, атом, молекула; различать понятия «вещество» и «тело», «простое вещество» и «химический элемент», «физические явления» и «химические явления»;
определение химической формулы вещества, формулировку закона постоянства состава;
знаки первых 20 химических элементов;
понимать и записывать химические формулы веществ;
правила техники безопасности при работе в химической лаборатории.
Уметь:
отличать химические реакции от физических явлений;
использовать приобретённые знания для безопасного обращения с веществами и материалами, экологически грамотного поведения в окружающей среде, оценки влияния химического загрязнения окружающей среды на организм человека;
называть химические элементы;
определять валентность важнейших элементов по формуле и составлять формулы бинарных соединений по валентности;
определять состав веществ по химической формуле, принадлежность к простым и сложным веществам;
вычислять массовую долю химического элемента по формуле соединения;
классифицировать химические реакции по типу;
расставлять коэффициенты в уравнениях реакций;
проводить расчеты по уравнению реакции;
применять ЗУН при выполнении тренировочных заданий и упражнений.
Тема 2 «Кислород» - 5 часов
Учащиеся должны знать:
условия горения и способы его прекращения; понятие «тепловой эффект химической реакции»;
строение, свойства, способы получения и области применения кислорода;
состав, свойства, способы получения оксидов;
круговорот кислорода в природе;
состав воздуха
Уметь:
записывать уравнения реакции окисления;
вести расчеты по термохимическим уравнениям;
получать и собирать кислород методом вытеснения воздуха и воды;
записывать уравнения реакций, характеризующих химические свойства кислорода;
применять ЗУН при выполнении тренировочных заданий и упражнений.
Тема 3 «Водород» - 3 часа
Учащиеся должны знать:
состав молекулы водорода;
определение восстановителя;
области применения водорода и способы получения его в лаборатории и промышленности.
Уметь:
получать водород в лабораторных условиях методом вытеснения воздуха; доказывать его наличие, проверять на чистоту.
давать характеристику водорода как элемента и как простого вещества, описывать физические и химические свойства водорода, записывать уравнения реакций;
применять ЗУН при выполнении тренировочных заданий и упражнений.
Тема 4 «Растворы. Вода» - 6часов
Учащиеся должны знать:
способы очистки воды;
понятия «растворы», «растворитель», «дистиллированная вода»;
меры по охране воды от загрязнений;
определение растворимости, массовой доли растворенного вещества;
количественный и качественный состав воды;
химические и физические свойства воды;
понятие об анализе и синтезе как методах определения состава вещества.
Уметь:
объяснять процесс растворения с точки зрения атомно – молекулярного учения;
вычислять массовую долю растворенного вещества в растворе;
составлять уравнения реакций, доказывать химические свойства воды;
приготавливать раствор соли с определенной массовой долей растворенного вещества;
решать задачи на определение массовой доли и массы растворенного вещества;
применять ЗУН при выполнении тренировочных заданий и упражнений.
Тема 5 «Основные классы неорганических соединений» - 9 часов
Учащиеся должны знать:
классификацию неорганических соединений;
определение и классификацию оксидов, оснований, кислот и солей;
понятие генетической связи
Уметь:
классифицировать по составу и свойствам неорганические вещества;
доказывать химические свойства оксидов, оснований, кислот и солей, записывать уравнения реакций;
осуществлять схемы превращений, доказывающих генетическую связь между классами соединений;
применять ЗУН при выполнении тренировочных заданий и упражнений.
Тема 6 «Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома» - 8 часов.
Учащиеся должны знать:
определение амфотерности оксида и гидроксида;
основные признаки классификации химических элементов на примере естественных семейств щелочных и щелочноземельных металлов, галогенов, инертных газов;
определение периодического закона, периода, группы;
строение атома, состав атома, определение изотопов;
расположение электронов по слоям, формы электронных орбиталей;
причину периодического изменения химических свойств в зависимости от числа электронов в наружном слое;
роль периодического закона для развития науки и техники;
основные этапы жизни и деятельности Д.И.Менделеева.
Уметь:
объяснять общие и отличительные признаки в свойствах элементов каждого семейства;
объяснять изменения свойств элементов и их соединений, причину этого;
описывать химический элемент с точки зрения строения атома;
находить черты сходства и отличия у изотопов;
записывать строение атомов элементов первых четырех периодов;
записывать электронные и электронно – графические формулы для первых 20 элементов;
давать характеристику по плану данного химического элемента главной подгруппы по его положению в ПС и строению его атома;
применять ЗУН при выполнении тренировочных заданий и упражнений.
Тема 7 «Строение вещества. Химическая связь» - 9 часов.
Учащиеся должны знать:
определение химической связи, электроотрицательности, ковалентной и ионной связи;
механизм образования связи;
определение кристаллической решетки, типы.
Уметь:
определять ковалентную и ионную связи в различных веществах, записывать схемы образования связи;
определять тип кристаллической решетки;
применять ЗУН при выполнении тренировочных заданий и упражнений.
Тема 8 «Закон Авогадро. Молярный объем газов» 3 часа
Учащиеся должны знать:
определение понятия молярный объем, сущность закона Авогадро;
определение понятия относительная плотность газов.
Уметь:
вычислять относительную плотность газов;
проводить расчеты на основе уравнений реакций, уметь вычислять: количество вещества, объем или массу по количеству вещества, объему или массе реагентов и продуктов реакции (находить объем газа по количеству вещества, массе или объему одного из реагентов или продуктов реакции).
Тема 9 «Галогены» - 6 часов
Учащиеся должны знать:
положение галогенов в периодической таблице и строение их атомов; свойства хлора;
свойства хлороводорода, соляной кислоты и хлоридов; понимать значение качественных реакций;
положение галогенов в периодической таблице и строение их атомов.
Уметь:
характеризовать галогены как химические элементы; обосновывать их свойства как типичных неметаллов;
составлять уравнения характерных для хлора реакций;
уметь выполнять химический эксперимент по распознаванию важнейших неорганических веществ - распознавать хлориды;
составлять уравнения химических реакций (характерных для соляной кислоты реакций).
Проверка и оценка знаний и умений учащихся
Результаты обучения химии должны соответствовать общим задачам предмета и требованиям к его усвоению.
Результаты обучения оцениваются по пятибалльной системе. При оценке учитываются следующие качественные показатели ответов:
глубина (соответствие изученным теоретическим обобщениям);
осознанность (соответствие требуемым в программе умениям применять полученную информацию);
полнота (соответствие объему программы и информации учебника).
При оценке учитываются число и характер ошибок (существенные или несущественные).
Существенные ошибки связаны с недостаточной глубиной и осознанностью ответа (например, ученик неправильно указал основные признаки понятий, явлений, характерные свойства веществ, неправильно сформулировал закон, правило и т.п. или ученик не смог применить теоретические знания для объяснения и предсказания явлений, установления причинно-следственных связей, сравнения и классификации явлений и т. п.).
Несущественные ошибки определяются неполнотой ответа (например, упущение из вида какого-либо нехарактерного факта при описании вещества, процесса). К ним можно отнести оговорки, описки, допущенные по невнимательности (например, на два и более уравнения реакций в полном ионном виде допущена одна ошибка в обозначении заряда иона).
Результаты обучения проверяются в процессе устных и письменных ответов учащихся, а также при выполнении ими химического эксперимента.
Оценка теоретических знаний
Отметка «5»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, литературным языком;
ответ самостоятельный.
Отметка «4»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «3»:
ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя.
Отметка «1»:
отсутствие ответа.
Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимся и письменного отчета за работу.
Отметка «5»:
работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
эксперимент проведен по плану с учетом техники безопасности и правил работы с веществами и оборудованием;
проявлены организационно-трудовые умения (поддерживаются чистота рабочего места и порядок на столе, экономно используются реактивы).
Отметка «4»:
работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведен не полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
допущены две (и более) существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя.
Отметка «1»:
работа не выполнена, у учащегося отсутствуют экспериментальные умения.
Оценка умений решать экспериментальные задачи
Отметка «5»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования;
дано полное объяснение и сделаны выводы.
Отметка «4»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования, при этом допущено не более двух несущественных ошибок в объяснении и выводах.
Отметка «3»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования, но допущена существенная ошибка в объяснении и выводах.
Отметка «2»:
допущены две (и более) существенные ошибки в плане решения, в подборе химических реактивов и оборудования, в объяснении и выводах.
Отметка «1»:
задача не решена.
Оценка умений решать расчетные задачи
Отметка «5»:
в логическом рассуждении и решении нет ошибок, задача решена рациональным способом.
Отметка «4»:
в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»:
в логическом рассуждении нет существенных ошибок, но допущена существенная ошибка в математических расчетах.
Отметка «2»:
имеются существенные ошибки в логическом рассуждении и решении.
Отметка «1»:
задача не решена.
Оценка письменных контрольных работ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные.
Отметка «2»:
работа выполнена менее чем наполовину или содержит несколько существенных ошибок.
Отметка «1»:
работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Отметка за итоговую контрольную работу корректирует предшествующие отметки за четверть, полугодие, год.
Тематическое планирование учебного материала
| № темы | Название темы | Кол-во часов | Практические работы | Контрольные, проверочные работы |
|
| 1 | Первоначальные химические понятия | 18 | 2- | Контрольная работа № 1 |
|
| 2 | Кислород. Горение | 5 | 1 |
|
|
| 3 | Водород | 3 |
|
|
|
| 4 | Растворы. Вода | 6 | - | Контрольная работа №2 |
|
| 5 | Важнейшие классы неорганических соединений
| 9 | 1 | Контрольная работа №3 по теме: |
|
| 6 | Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома | 8 |
|
|
|
| 7 | Химическая связь. Строение веществ | 9 |
| Контрольная работа №4; |
|
| 8 | Закон Авогадро. Молярный объем газов | 3 | 1 |
|
|
| 9 | Галогены | 6 | 1 |
|
|
|
| Итоговый урок | 2 |
|
|
|
|
| Всего часов | 69 |
|
|
|
|
|
|
| Из них: |
|
|
|
|
|
|
| Контрольных работ | 4 |
|
|
|
|
|
| Практических работ | 6 |
|
|
|
|
|
| Лабораторных работ | 21 |
|
|
|
|
Календарно-тематическое планирование в 8 классе по учебнику « Химия»
( для изучения на базовом уровне авторы. Г.Е Рудзитис, Ф.Г Фельдман.)
(2013-2014 уч. год)
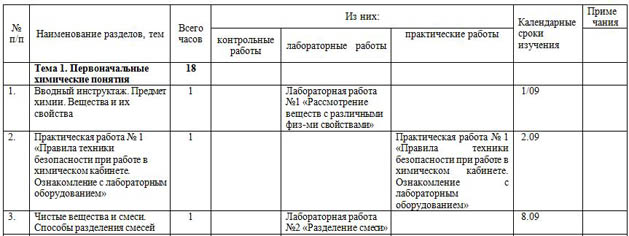
| № п/п | Наименование разделов, тем | Всего часов | Из них: | Календарные сроки изучения | Приме чания |
| контрольные работы | лабораторные работы | практические работы
|
|
|
| Тема 1. Первоначальные химические понятия | 18 |
|
|
|
|
|
| 1. | Вводный инструктаж. Предмет химии. Вещества и их свойства | 1 |
| Лабораторная работа №1 «Рассмотрение веществ с различными физ-ми свойствами» |
| 1/09 |
|
| 2. | Практическая работа № 1 «Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием» | 1 |
|
| Практическая работа № 1 «Правила техники безопасности при работе в химическом кабинете. Ознакомление с лабораторным оборудованием» | 2.09 |
|
| 3. | Чистые вещества и смеси. Способы разделения смесей | 1 |
| Лабораторная работа №2 «Разделение смеси» |
| 8.09 |
|
| 4. | Практическая работа № 2 «Очистка поваренной соли» | 1 |
|
| Практическая работа № 2 «Очистка поваренной соли» | 9.09 |
|
| 5. | Физические и химические явления. | 1 |
| Лабораторная работа № 3 «Примеры физических явлений» Лабораторная работа № 4 «Примеры химических явлений» |
| 15.09 |
|
| 6. | Атомы и молекулы. Атомно-молекулярное учение. Вещества молекулярного и немолекулярного строения. | 1 |
|
|
| 16.09 |
|
| 7. | Простые и сложные вещества. Химический элемент. | 1 |
| Лабораторная работа №5 . «Ознакомление с образцами простых и сложных веществ, минералов и горных пород. Металлов и неметаллов» |
| 22.09 |
|
| 8. | Язык химии. Знаки химических элементов. Относительная атомная масса | 1 |
|
|
| 30.9 |
|
| 9. | Закон постоянства состава веществ | 1 |
|
|
| 6/9 |
|
| 10. | Относительная молекулярная масса. Химические формулы. | 1 |
|
|
| 7/9 |
|
| 11. | Массовая доля химического элемента в соединении | 1 |
|
|
| 13/9 |
|
| 12-13 | Валентность химических элементов. Составление химических формул по валентности | 2 |
|
|
| 14.9
|
|
| 14. | Закон сохранения массы веществ. Химические уравнения. Классификация химических реакций по числу и составу исходных и полученных веществ | 1 |
| Лабораторная работа №6 «Разложение основного карбоната меди» (II). Лабораторная работа №7. «Реакция замещения меди железом» |
| 20/9 |
|
| 15. | Моль – единица количества вещества. Молярная масса | 1 |
|
|
| 21.9 |
|
| 16. | Решение расчетных задач по химическим уравнениям реакций | 1 |
|
|
| 27/9 |
|
| 17. | Контрольная работа № 1 по теме: «Первоначальные химические понятия» | 1 | Контрольная работа № 1 по теме: «Первоначаль ные химические понятия» |
|
| 28/9 |
|
| 18. | Решение задач по теме «Первоначальные химические понятия» | 1 |
|
|
|
|
|
|
| Тема 2. Кислород. Горение | 5 |
|
|
|
|
|
| 19. | Кислород, его общая характеристика и нахождение в природе. Получение кислорода и его физические свойства | 1 |
|
|
|
|
|
| 20. | Химические свойства кислорода. Оксиды. Применение. Круговорот кислорода в природе. | 1 |
| Лабораторная работа №8 «Ознакомление с образцами оксидов» |
|
|
|
| 21. | Практическая работа № 3 «Получение и свойства кислорода» | 1 |
|
| Практическая работа № 3 «Получение и свойства кислорода» |
|
|
| 22. | Воздух и его состав. Защита атмосферного воздуха от загрязнения. | 1 |
|
|
|
|
|
| 23. | Горение и медленное окисление. Тепловой эффект химических реакций. | 1 |
|
|
|
|
|
|
| Тема 3. Водород | 3 |
|
|
|
|
|
| 24. | Водород, его общая характеристика и нахождение в природе. Получение водорода и его физические свойства. | 1 |
| Лабораторная работа №9 «Получение и свойства водорода» |
|
|
|
| 25. | Химические свойства водорода. Применение. | 1 |
| Лабораторная работа № 10 «Взаимодейсвие водорода с оксидом меди (II)» |
|
|
|
| 26. | Повторение и обобщение по темам «Кислород», «Водород» | 1 |
|
|
|
|
|
|
| Тема 4. Растворы. Вода | 6 |
|
|
|
|
|
| 27. | Вода – растворитель. Растворы. Растворимость веществ в воде. | 1 |
|
|
|
|
|
| 28. | Массовая доля растворённого вещества. | 1 |
|
|
|
|
|
| 29. | Практическая работа № 4 «Приготовление раствора соли с определённой массовой долей вещества» | 1 |
|
| Практическая работа № 4 «Приготовление раствора соли с определённой массовой долей вещества» |
|
|
| 30. | Вода. Анализ и синтез воды. Вода в природе и способы ее очистки. Физические и химические свойства воды | 1 |
|
|
|
|
|
| 31. | Контрольная работа №2 по темам «Кислород», «Водород», «Растворы. Вода» | 1 | Контрольная работа №2 по темам «Кислород», «Водород», «Растворы. Вода» |
|
|
|
|
| 32. | Решение задач по темам «Кислород», «Водород», «Растворы. Вода» | 1 |
|
|
|
|
|
|
| Тема 5. Важнейшие классы неорганических соединений | 9 |
|
|
|
|
|
| 33. | Оксиды: классификация, номенклатура. Свойства оксидов, получение, применение. | 1 |
|
|
|
|
|
| 34. | Основания: классификация, номенклатура. Получение. | 1 |
| Лабораторная работа №14 «Свойства растворимых и нерастворимых оснований»
|
|
|
|
| 35. | Физические и химические свойства оснований. Реакция нейтрализации. | 1 |
| Лабораторная работа №15 «Взаимодействие щелочей с кислотами». Лабораторная работа №16 «Взаимодействие нерастворимых оснований с кислотами», Лабораторная работа № 17 «Разложение гидроксида меди (II) при нагревании» |
|
|
|
| 36. | Кислоты: классификация, номенклатура, физические и химические свойства | 2 |
| Лабораторная работа №11 «Действие кислот на индикаторы». Лабораторная работа №12 «Отношение кислот к металлам». Лабораторная работа № 13 «Взаимодействие кислот с оксидами металлов» |
|
|
|
| 37. | Соли: классификация, номенклатура, способы получения. | 1 |
|
|
|
|
|
| 38. | Физические и химические свойства солей |
|
|
|
|
|
|
| 39. | Генетическая связь между основными классами неорганических соединений | 1 |
|
|
|
|
|
| 40. | Практическая работа № 5 «Решение экспериментальных задачпо теме» «Важнейшие классы неорганических соединений»» | 1 |
|
| Практическая работа № 5 «Решение экспериментальных задач по теме» «Важнейшие классы неорганических соединений»» |
|
|
| 41. | Контрольная работа №3 по теме: «Важнейшие классы неорганических соединений». | 1 | Контрольная работа №3 по теме: «Важнейшие классы неорганических соединений». |
|
|
|
|
|
| Тема 6. Периодический закон и периодическая система химических элементов Д.И. Менделеева. Строение атома | 8 |
|
|
|
|
|
| 42. | Классификация химических элементов. Амфотерные соединения. | 1 |
| Лабораторная работа №18 «Взаимодействие гидроксида цинка растворами кислот и щелочей»
|
|
|
|
| 43. | Периодический закон Д.И. Менделеева | 1 |
|
|
|
|
|
| 44. | Периодическая таблица химических элементов. | 1 |
|
|
|
|
|
| 45. | Строение атома. Изотопы. Химический элемент. | 1 |
|
|
|
|
|
| 46. | Строение электронных оболочек атомов. | 1 |
|
|
|
|
|
| 47. | Состояние электронов в атомах | 1 |
|
|
|
|
|
| 48. | Значение периодического закона. Жизнь и деятельность Д.И. Менделеева | 1 |
|
|
|
|
|
| 49. | Повторение и обобщение знаний по теме: «Периодический закон и периодическая система химических элементов Д.И.Менднлеева. Строение атома» | 1 |
|
|
|
|
|
|
| Тема 7. Химическая связь. Строение веществ | 9 |
|
|
|
|
|
| 50. | Электроотрицательность химических элементов. | 1 |
|
|
|
|
|
| 51. | Ковалентная связь | 1 |
|
|
|
|
|
| 52. | Полярная и неполярная ковалентные связи | 1 |
|
|
|
|
|
| 53. | Ионная связь | 1 |
|
|
|
|
|
| 54. | Кристаллические решетки | 1 |
| Лабораторная работа №19 «Составление моделей молекул и кристаллов веществ с различным видом химических связей» |
|
|
|
| 55. | Валентность и степень окисления. Правила определения степеней окисления элементов | 1 |
|
|
|
|
|
| 56. | Окислительно-восстановительные реакции | 1 |
|
|
|
|
|
| 57. | Повторение и обобщение по теме: «Строение веществ. Химическая связь». | 1 |
|
|
|
|
|
| 58. | Контрольная работа №4 "ПСХЭ Д.И.Менделеева». «Строение атома», «Строение веществ. Химическая связь». | 1 | Контрольная работа №4 "Периодический закон и периодическая система химических элементов Д.И.Менделеева. Строение атома «, «Строение веществ. Химическая связь». |
|
|
|
|
|
| Тема 8. Закон Авогадро. Молярный объем газов | 3 |
|
|
|
|
|
| 59. | Закон Авогадро. Молярный объем газов. | 1 |
|
|
|
|
|
| 60. | Относительная плотность газов | 1 |
|
|
|
|
|
| 61. | Объемные отношения газов при химических реакциях | 1 |
|
|
|
|
|
|
| Тема 9. Галогены | 6 |
|
|
|
|
|
| 62 | Положение галогенов в периодической таблице и строение их атомов. Хлор. Физические и химические свойства хлора. Применение. | 1 |
|
|
|
|
|
| 63. | Хлороводород. Получение. Физические свойства
| 1 |
|
|
|
|
|
| 64. | Соляная кислота и ее соли | 1 |
|
|
|
|
|
| 65. | Сравнительная характеристика галогенов | 1 |
| Лабораторная работа №20 «Распознавание соляной кислоты, хлоридов, бромидов, иодидов и иода» Лабораторная работа №21 «Вытеснение галогенами друг друга из растворов их соединений» |
|
|
|
| 66 | Практическая работа № 6 «Получение соляной кислоты и опыты с ней» | 1 |
|
| Практическая работа № 6 «Получение соляной кислоты и опыты с ней» |
|
|
| 67. | Обобщение по темам «Закон Авогадро. Молярный объем газов» и «Галогены». | 1 | |
|
|
|
|
| 68 | Итоговый урок | 1 |
|
|
|
|
|
| 69 | Итоговый урок | 1 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Литература.
Гара Н.Н. Программы общеобразовательных учреждений. Химия. – М.: Просвещение, 2008. -56с.
Гара Н.Н. Химия: уроки в 8 кл.: Пособие для учителя. – М.: Просвещение, 2008. – 11 с.
Гара Н.Н. Химия. Контрольные и проверочные работы. 8-9 классы / Н.Н.Гара. – Дрофа, 2004.
4.Рудзитис Г.Е Химия: неорган. химия: учебник для 8 кл. общеобразовательных учреждений/ Г.Е Рудзитис, Ф.Г Фельдман.- 12-е изд., испр. - М.: Просвещение, 2008.-176с.
MULTIMEDIA – поддержка предмета:
Виртуальная школа Кирилла и Мефодия. Уроки химии. 8-9 классы. – М.: ООО «Кирилл и Мефодий», 2004
Демонстрационное поурочное планирование. Общая химия. – Волгоград: издательство «Учитель», 2007

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая учебная программа по химии (8 класс) (0.25 MB)
Рабочая учебная программа по химии (8 класс) (0.25 MB)
 0
0 778
778 10
10 Нравится
0
Нравится
0




