Рабочая учебная программа по химии
основное общее образование, 10-11 класс
Пояснительная записка
Рабочая учебная программа составлена на основе примерной программы среднегополного образования по химии (базовый уровень),в соответствии с государственными стандартами общего образования по химии (Сборник нормативных документов для образовательных учреждений РФ. М.:Дрофа 2007), ориентирована на учебник: Г.Е.Рудзитис, Ф.Г.Фельдман. Химия-10,11.-М.:Просвещение;2011,2012 при планировании 1 часа в неделю (по 34 часа\год), их них в 10 классе контрольных работ - 3, практических работ - 4 ; в 11 классе контрольных работ - 2, практических работ -3.
УМК:
1. Г.Е.Рудзитис, Ф.Г.Фельдман. Химия-10,11.-М.:Просвещение,2011, 2012
2. Гара Н. Н., Зуева М. В. Контрольные и проверочные работы по химии 10—11 кл. — М.: Дрофа, 2010
3. Ра д е ц к и й А. М. и др. Дидактические материалы по химии. 10—11кл. — М.: Просвещение, 2011
Выбранный УМК обеспечивает наиболее продуктивную отработку общеучебных умений и навыков по курсу химии 10-11 класса,обладает четко выраженной структурой и доступностью, способствуя усвоению некоторого базового объема химических знаний, формированию в сознании научной картины мира — одного из необходимых условий выработки реалистического взгляда на природу и место человека в ней, определенной культуры мышления и поведения, разумного и ответственного отношения к себе, людям и среде обитания.
Изучение химии в 10-11 классе направлено на достижение следующих целей:
- освоение системы знаний о химической составляющей естественно-научной картины мира, а также о системе важнейших химических понятий, законов и теорий;
- овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ; оценки роли химии в развитии современных технологий и получении новых материалов;
- развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения знаний и умений по химии с использованием различных источников информации, в том числе компьютерных технологий;
- воспитаниеубежденности в познаваемости мира, необходимости вести здоровый образ жизни, химически грамотного отношения к среде обитания;
- применение полученных знаний и умений по химии в повседневной жизни, а также для решения практических задач в сельском хозяйстве и промышленном производстве.
Учебно-воспитательные задачи предмета:
- изучить основы науки: важнейшие факты, понятия, химические законы и теории, химическую символику, доступные обобщения мировоззренческого характера;
- ознакомить с технологическим применением законов химии, с научными основами химического производства, с трудом людей на химическом и смежных производствах;
- воспитать нравственность, гуманизм, бережное отношение к природе и собственности;
- воспитать осознанную потребность в труде, совершенствовать трудовые умения и навыки, подготовить к сознательному выбору профессии в соответствии с личными способностями и потребностями общества;
- формировать умения сравнивать, вычленять в изученном существенное; устанавливать причинно-следственные связи; делать обобщения; связно и доказательно излагать учебный материал; самостоятельно применять, пополнять и систематизировать знания;
- формировать умения обращаться с химическими веществами, простейшими приборами, оборудованием; соблюдать правила техники безопасности; учитывать химическую природу вещества для предупреждения опасных для человека явлений (пожаров, взрывов, отравлений и т. п.); наблюдать и объяснять химические явления, происходящие в природе, лаборатории, на производстве и в повседневной жизни; фиксировать результаты опытов; делать соответствующие обобщения;
- формировать умения организовывать свой учебный труд; пользоваться учебником, справочной литературой; соблюдать правила работы в классе, коллективе, на рабочем месте.
Требования к результатам изучения химии в 10-11 классах
В результате изучения органической химии ученик 10 класса должен знать
важнейшие химические понятия: органическое вещество, углеродный скелет, функциональная группа, гомолог, гомологический ряд, изомер, классификация органических веществ, классификация химических реакций в органической химии, окислитель, восстановитель, окисление и восстановление
основные теории органической химии: гибридизации, химического строения органических веществ А.М. Бутлерова
важнейшие органические вещества и материалы: метан, этилен, ацетилен, бутадиен, бензол, этанол, фенол, этаналь, уксусная кислота, жиры, мыла, глюкоза, сахароза, крахмал, целлюлоза, амины, аминокислоты, анилин, белки, искусственные и синтетические волокна, каучуки, пластмассы
правила техники безопасности при выполнении работе с химическими реактивами
Уметь
называть изученные химические вещества по международной номенклатуре
составлять полные и сокращенные структурные формулы органических веществ, их гомологов и изомеров; уравнения химических реакций
определять состав веществ по их формуле, принадлежность веществ к определенному классу соединений, тип химических реакций, валентность и степень окисления элемента в соединениях
характеризовать общие химические свойства и строение основных классов органических веществ
объяснять зависимость свойств органических веществ от их состава и строения, сущность реакций
выполнять химический эксперимент по получению и распознаванию важнейших органических веществ
проводить самостоятельный поиск химической информации с использованием различных источников: научно-популярных изданий, компьютерных баз данных, Интернет - ресурсов.
использовать компьютерные технологии для обработки и передачи химической информации, и её представления в различных формах
вычислять молекулярную формулу органического вещества по массовой доле ХЭ в веществе; по количеству вещества, массе или объёму реагентов и/или продуктов реакции
• использовать приобретенные знания и умения в практической деятельности и повседневной жизни с целью:
1. объяснения химических явлений, происходящих в природе, быту, на производстве и в живых организмах
2. определения возможности протекания химических превращений в различных условиях и оценки их последствий
3. экологически грамотного поведения в окружающей среде
4. оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы
5. безопасного обращения с веществами и лабораторным оборудованием
6. критической оценки достоверности химической информации, поступающей из разных источников
В результате изучения органической химии ученик 11 класса должен знать
важнейшие химические понятия: вещество,химический элемент, атом, молекула,
относительная атомная и молекулярная массы, валентность, химическая связь, электроотрицательность, степень, окисления, ион, изотоп, аллотропия, классификация веществ, моль, молярная масса, молярный объём, вещества молекулярного и немолекулярного строения, химическая реакция, классификация реакций, электролит, неэлектролит, электролитическая диссоциация, окислитель и восстановитель, окисление и восстановление, тепловой эффект реакции, скорость химической реакции, катализ, химическое равновесие, углеродный скелет, функциональная группа, гомология, гомологический ряд, изомерия.
основные законы химии: сохранения массы веществ, постоянства состава,
периодический закон Д.И.Менделеева.
основные теории химии: химической связи, электролитической диссоциации, химического строения органических веществ А.М. Бутлерова
важнейшие вещества и материалы: основные металлы и сплавы, серная, соляная, азотная и уксусная кислоты, щелочи, аммиак, минеральные удобрения, метан, этилен, ацетилен, бензол, этанол, фенол, жиры, мыла, глюкоза, сахароза, крахмал, целлюлоза, белки, искусственные и синтетические волокна, каучуки, пластмассы.
правила техники безопасности при выполнении работы с химическими реактивами
Уметь
называть изученные химические вещества по тривиальной или международной номенклатуре
определять валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, характер среды в водных растворах неорганических соединений, окислитель и восстановитель, принадлежность веществ к различным классам органических и неорганических соединений
характеризовать элементы малых периодов по их положению в периодической системе, общие химические свойства металлов, неметаллов, основных классов органических и неорганических веществ, строение и химические свойства изученных органических соединений
объяснять зависимость свойств веществ от их состава и строения, природу химической связи (ионной, ковалентной, металлической), сущность реакций, зависимость скорости химической реакции и смещение химического равновесия от различных факторов
выполнять химический эксперимент по получению и распознаванию важнейших неорганических и органических веществ
проводить самостоятельный поиск химической информации с использованием различных источников: научно-популярных изданий, компьютерных баз данных, Интернет - ресурсов.
использовать компьютерные технологии для обработки и передачи химической информации, и её представления в различных формах
Использовать приобретенные знания и умения в практической деятельности и повседневной жизни с целью:
1. объяснения химических явлений, происходящих в природе, быту, на производстве и в живых организмах
2. определения возможности протекания химических превращений в различных условиях и оценки их последствий
3. экологически грамотного поведения в окружающей среде
4. оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы
5. безопасного обращения с горючими и токсичными веществами, лабораторным оборудованием
6. приготовления растворов заданной концентрации в быту и на производстве
7. критической оценки достоверности химической информации, поступающей из разных источников
Программа по химии позволяет раскрыть ведущие концептуальные идеи и отдельные положения, важные в познавательном и мировоззренческом отношении: зависимость свойств веществ от состава и строения; обусловленность применения веществ их свойствами; материальное единство неорганических и органических веществ; движение познания ко все более глубокой сущности; обусловленность превращений веществ действием законов природы; переход количественных изменений в качественные и разрешение противоречий; развитие химии под влиянием требований научно-технического прогресса; возрастающая роль химии в создании новых материалов, в решении энергетической и продовольственной проблем, в выполнении задач химизации народного хозяйства, экономии сырья, охраны окружающей среды.
На протяжении всего курса химии 10 класса прослеживаются межпредметные связи с курсом физики («Строение и валентные состояния атома углерода»), биологии ( вопросы о содержании соединений в организме растений, животных и человека; химические реакции в живых организмах), математики ( методика решения расчетных задач), литературы (упоминание об органических соединениях в литературных произведениях), экологии ( вопросы загрязнения окружающей среды органическими соединениями).
На протяжении всего курса химии 11 класса прослеживаются межпредметные связи с курсом физики (тема «Строение атома», «Вещества и их свойства»),биологии (вопросы о содержании химических соединений в организме растений, животных и человека; химические реакции в живых организмах),математики(методика решения расчетных задач),литературы(упоминание о металлах, неметаллах в литературных произведениях),экологии( «Химия в жизни общества» ).
В рамках реализации программы учитываются психологические, возрастные особенности обучающихся при отборе содержания, методов и форм работы. Индивидуально подбирается объем учебной нагрузки в зависимости от способностей и возможностей учащихся. Сочетаются различные формы обучения (коллективные, групповые, индивидуальные, парные), что позволяет развивать все виды коммуникативной деятельности обучающихся. Планирование и организация уроков осуществляется с опорой на нестандартные формы, методы и приемы работы, развивающие способности обучающихся, повышающие уровень теоретических и практических навыков. Обучение организуется как на репродуктивном уровне, предполагающем закрепление знаний, формирование общеучебных ЗУН, так и исследовательском, направленном на развитие творческого мышления и воображения учащихся. В процессе реализации программы в педагогической практике применяются технологии:
-личностно – ориентированного обучения по И.С.Якиманской и О.С.Газману;дифференцированного обучения по Г.К.Селевко;
развивающего обучения Л.Я.Зорина, Н.Ф.Талызиной, Л.В.Занкова;
диагностики образовательного процесса В.М.Лизинского, В.Зайцева, Т.Смирнова.
Самостоятельную работу обучащихся на уроке необходимо рассматривать как одно из основных средств воспитания ученика – деятеля, для этого используются тестовые задания, электронные учебные пособия, презентации.
Используемые формы, способы и средства проверки и оценки результатов обучения по данной рабочей учебной программе:
- лабораторная работа – вид самостоятельной практической и исследовательской работы обучающихся с целью углубления и закрепления теоретических знаний, развития навыков самостоятельного экспериментирования
- практическая работа – вид учебной деятельности обучающихся, по своим целям и задачам аналогичный лабораторным работам. Практические работы – средство связи теории и практики в обучении, развития познавательных способностей и самостоятельности обучащихся
- общественный смотр знаний- вид учебной деятельности обучающихся, направленный на оценку и самооценку приобретенных теоретических и практических умений и навыков по темам, которым контрольную работу провести трудно; при этомвиде деятельности знание проверяет независимая комиссия, учитель направляет работу обучающихся
- контрольная работа – вид учебной деятельности обучающихся, направленный на оценку и самооценку приобретенных теоретических и практических умений и навыков.
КРИТЕРИИ И НОРМЫ ОЦЕНКИ ЗНАНИЙ И УМЕНИЙ ОБУЧАЩИХСЯ
Результаты обучения химии должны соответствовать общим задачам предмета и требованиям к его усвоению.
Результаты обучения оцениваются по пятибалльной системе. При оценке учитываются следующие качественные показатели ответов:глубина (соответствие изученным теоретическим обобщениям);осознанность (соответствие требуемым в программе умениям применять полученную информацию);полнота (соответствие объему программы и информации учебника).
При оценке учитываются число и характер ошибок (существенные или несущественные).
Существенные ошибки связаны с недостаточной глубиной и осознанностью ответа (например, ученик неправильно указал основные признаки понятий, явлений, характерные свойства веществ, неправильно сформулировал закон, правило и т. п. или ученик не смог применить теоретические знания для объяснения и предсказания явлений, установления причинно-следственных связей, сравнения и классификации явлений и т. п.). Несущественные ошибки определяются неполнотой oтвета (например, упущение из вида какого-либо нехарактерного факта при описании вещества, процесса). К ним молено отнести оговорки, описки, допущенные по невнимательности (например, на два и более уравнения реакций в полном ионном виде допущена одна ошибка в обозначении заряда иона).
Результаты обучения проверяются в процессе устных и письменных ответов учащихся, а также при выполнении ими химического эксперимента.
Оценка теоретических знаний
Отметка «5»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, литературным языком;
ответ самостоятельный.
Отметка «4»:
ответ полный и правильный на основании изученных теорий;
материал изложен в определенной логической последовательности, при этом допущены две-три несущественные ошибки, исправленные по требованию учителя.
Отметка «3»:
ответ полный, но при этом допущена существенная ошибка или ответ неполный, несвязный.
Отметка «2»:
при ответе обнаружено непонимание учащимся основного содержания учебного материала или допущены существенные ошибки, которые учащийся не может исправить при наводящих вопросах учителя.
Отметка «1»:
отсутствие ответа.
Оценка экспериментальных умений
Оценка ставится на основании наблюдения за учащимся и письменного отчета за работу.
Отметка «5»:
работа выполнена полностью и правильно, сделаны правильные наблюдения и выводы;
эксперимент проведен по плану с учетом техники безопасности и правил работы с веществами и оборудованием
проявлены организационно-трудовые умения (поддериваются чистота рабочего места и порядок на столе, экономно используются реактивы).
Отметка «4»:
работа выполнена правильно, сделаны правильные наблюдения и выводы, но при этом эксперимент проведение полностью или допущены несущественные ошибки в работе с веществами и оборудованием.
Отметка «3»:
работа выполнена правильно не менее чем наполовину или допущена существенная ошибка в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которая исправляется по требованию учителя.
Отметка «2»:
допущены две (и более) существенные ошибки в ходе эксперимента, в объяснении, в оформлении работы, в соблюдении правил техники безопасности при работе с веществами и оборудованием, которые учащийся не может исправить даже по требованию учителя.
Отметка «1»:
работа не выполнена, у учащегося отсутствуют экспериментальные умения.
Оценка умений решать экспериментальные задачи
Отметка «5»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования;
дано полное объяснение и сделаны выводы.
Отметка «4»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования, при этом допущено не более двух несущественных ошибок в объяснении и выводах.
Отметка «3»:
план решения составлен правильно;
правильно осуществлен подбор химических реактивов и оборудования, но допущена существенная ошибка в объяснении и выводах.
Отметка «2»:
допущены две (и более) существенные ошибки в плане решения, в подборе химических реактивов и оборудования, в объяснении и выводах.
Отметка «1»:
задача не решена.
Оценка умений решать расчетные задачи
Отметка «5»:
в логическом рассуждении и решении нет ошибок, задача решена рациональным способом. Отметка «4»:
в логическом рассуждении и решении нет существенных ошибок, но задача решена нерациональным способом или допущено не более двух несущественных ошибок.
Отметка «3»:
в логическом рассуждении нет существенных ошибок но допущена существенная ошибка в математических рас четах.
Отметка «2»:
имеются существенные ошибки в логическом рассуждении и решении.
Отметка «1»:
задача не решена.
Оценка письменных контрольных работ
Отметка «5»:
ответ полный и правильный, возможна несущественная ошибка.
Отметка «4»:
ответ неполный или допущено не более двух несущественных ошибок.
Отметка «3»:
работа выполнена не менее чем наполовину, допущена одна существенная ошибка и две-три несущественные.
Отметка «2»:
работа выполнена менее чем наполовину или содержит несколько существенных ошибок.
Отметка «1»:
работа не выполнена.
При оценке выполнения письменной контрольной работы необходимо учитывать требования единого орфографического режима.
Отметка за итоговую контрольную работу корректирует предшествующие отметки за четверть, полугодие, год.
СОДЕРЖАНИЕ УЧЕБНОГО МАТЕРИАЛА (10 класс)
Повторение изученного в 9 классе (3ч)
Тема 1. Теоретические основы органической химии (1 ч)
Формирование органической химии как науки. Теория строения органических соединений А. М. Бутлерова. Углеродный скелет. Радикалы. Функциональные группы. Гомологический ряд. Гомологи. Структурная изомерия. Номенклатура.
Электронная природа химических связей в органических соединениях.
Классификация органических соединений.
Демонстрации. Образцы органических веществ и материалов. Модели молекул органических веществ. Растворимость органических веществ в воде и неводных растворителях. Плавление, обугливание и горение органических веществ.
Тема 2. УГЛЕВОДОРОДЫ (12 ч)
Строение алканов. Гомологический ряд. Номенклатура и изомерия. Физические и химические свойства алканов. Реакция замещения. Получение и применение алканов. Понятие о циклоалканах.
Демонстрации. Взрыв смеси метана с воздухом. Отношение алканов к кислотам, щелочам, раствору перманганата калия и бромной воде.
Лабораторные опыты. Изготовление моделей углеводородов и галогенопроизводных.
Расчетные задачи. Нахождение молекулярной формулы органического соединения по массе (объему) продуктов сгорания.
Алкены. Строение алкенов. Гомологический ряд. Номенклатура. Изомерия: углеродной цепи, положение кратной связи, цис-, траис-изомерия. Химические свойства: реакции окисления, присоединения, полимеризации Применение алкенов.
Алкадиены. Строение. Свойства, применение. Природный каучук.
Алкины. Строение ацетилена. Гомологи и изомеры, Номенклатура. Физические и химические свойства. Реакции присоединения и замещения. Применение.
Демонстрации. Получение ацетилена карбидным способом. Взаимодействие ацетилена с раствором перманганата калия и бромной водой. Горение ацетилена. Разложение каучука при нагревании и испытание продуктов разложения.
Практическая работа. Получение этилена и изучение его свойств.
Арены. Строение бензола. Изомерия и номенклатура. Физические и химические свойства бензола. Гомологи бензола. Генетическая связь ароматических углеводородов с другими классами углеводородов.
Демонстрации. Бензол как растворитель, горение бензола. Отношение бензола к бромной воде и раствору перманганата калия. Окисление толуола.
Природный газ. Нефть и нефтепродукты. Физические свойства. Способы переработки нефти.
Демонстрации. Ознакомление с образцами продуктов нефтепереработки.
Тема 3.КИСЛОРОДСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (12 ч)
Одноатомные предельные спирты. Строение молекул, функциональная группа. Водородная связь. Изомерия и номенклатура. Свойства метанола (этанола), получение и применение. Физиологическое действие спиртов на организм человека.
Многоатомные спирты. Этиленгликоль, глицерин. Свойства, применение.
Фенолы. Строение молекулы фенола. Взаимное влияние атомов в молекуле на примере молекулы фенола. Свойства. Токсичность фенола и его соединений. Применение фенола. Генетическая связь спиртов и фенола с углеводородами.
Демонстрации. Взаимодействие фенола с бромной водой и раствором гидроксида натрия. Растворение глицерина в воде. Реакция глицерина с гидроксидом меди(П).
Расчетные задачи. Расчеты по химическим уравнениям при условии, что одно из реагирующих веществ дано в избытке.
Альдегиды. Кетоны. Строение молекул. Функциональная группа. Изомерия и номенклатура. Формальдегид и ацетальдегид: свойства, получение и применение. Ацетон — представитель кетонов. Применение.
Односоставные предельные карбоновые кислоты. Строение молекул. Функциональная группа. Изомерия и номенклатура. Свойства карбоновых кислот. Применение.
Краткие сведения о непредельных карбоновых кислотах.
Генетическая связь карбоновых кислот с другими классами органических соединений.
Демонстрации. Получение этаналя окислением этанола. Взаимодействие метаналя (этаналя) с аммиачным раствором оксида серебра(1) и гидроксида меди(П). Растворение в ацетоне различных органических веществ.
Практическая работа. Решение экспериментальных задач на распознавание органических веществ.
Расчетные задачи. Определение массовой или объемной доли выхода продукта реакции от теоретически возможного.
Жиры. Нахождение в природе. Свойства. Применение.
Моющие средства. Правила безопасного обращения со средствами бытовой химии.
Глюкоза. Строение молекулы. Свойства глюкозы. Применение. Сахароза. Свойства, применение.
Крахмал и целлюлоза — представители природных полимеров. Реакция поликонденсации. Физические и химические свойства. Нахождение в природе. Применение. Ацетатное волокно.
Демонстрации. Растворимость жиров, доказательство их непредельного характера, омыление жиров. Сравнение свойств мыла и синтетических моющих средств.
Взаимодействие глюкозы с гидроксидом меди(П). Взаимодействие глюкозы с аммиачным раствором оксида серебра(1).
Взаимодействие сахарозы с гидроксидом кальция. Взаимодействие крахмала с иодом. Гидролиз крахмала. Ознакомление с образцами природных и искусственных волокон.
Практическая работа. Решение экспериментальных задач на получение и распознавание органических веществ.
Тема 4.АЗОТСОДЕРЖАЩИЕ ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ (3 ч)
Амины. Строение молекул. Аминогруппа. Физические и химические свойства. Анилин. Свойства, применение.
Аминокислоты. Изомерия и номенклатура. Свойства. Аминокислоты как амфотерные органические соединения. Применение.
Белки — природные полимеры. Состав и строение. Физические и химические свойства. Превращение белков в организме. Успехи в изучении и синтезе белков.
Химия и здоровье человека. Лекарства. Проблемы, связанные с применением лекарственных препаратов.
Демонстрации. Окраска ткани анилиновым красителем. Доказательство наличия функциональных групп в растворах аминокислот. Цветные реакции на белки (биуретовая и ксантопротеиновая реакции).
Тема 5. ВЫСОКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ (2 ч)
Понятие о высокомолекулярных соединениях. Полимеры, получаемые в реакциях полимеризации. Строение молекул. Полиэтилен. Полипропилен. Фенолформалъдегидные смолы.
Синтетические каучуки. Строение, свойства, получение и применение.
Синтетические волокна. Капрон. Лавсан.
Демонстрации. Образцы пластмасс, синтетических каучуков и синтетических волокон.
Практическая работа. Распознавание пластмасс и волокон.
Повторение по курсу химии 10 класса «Органические вещества и их свойства» (1ч)
КАЛЕНДАРНО – ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ (10класс)
Повторение изученного в 9 классе
| Дата | № | Тема | Основные понятия | Демонстрации, ИКТ | Дидактические единицы (ЗУН) | Дифферен-цированное домашнее задание |
|
| 1(1) | Теория электролитичес-кой диссоциации. Окислительно-восстановитель-ныереакции |
|
| Знать условия протекания реакций ионного обмена до конца. Уметь писать молекулярные, полные ионные и сокращённые ионные уравнения реакций ионного обмена. Уметь определять окислительно-восстановительные реакции, расставлять коэффициенты в схемах окислительно-восстановительных реакций методом электронного баланса. | повт п.1-5 (9кл) |
|
| 2(2) | Органическая химия и органические соединения. Изомерия. |
| Тест.самопроверка (ИКТ) | Знать классификацию органических соединений, уметь писать формулы изомеров. | повт п.48-50 (9кл) |
|
| 3(3) | Контрольная работа по повторению изученного в 9 классе. |
|
| Уметь применять знания, умения и навыки, полученные при изучении данной темы.
|
|
Тема 1.Теоретические основы органической химии
|
| 1(4) | Теория строения | Изомерия. | Модели молекул СН4, | Знать основные положения теории химического | п.1-4 упр. 1-7* |
|
|
| М.Бутлерова | состояние атома | Н2О, СН4 | валентности атомов. |
|
|
|
| Строение атома | углерода, |
| Знать формы s и рорбиталей, электронные и |
|
|
|
| углерода. | гибридизация. |
| электронно-графические формулы атома углерода в |
|
|
|
| Валентные |
|
| нормальном и возбуждённом состояниях. |
|
|
|
| состояния атома |
|
|
|
|
|
|
| углерода. |
|
|
|
|
Тема 2. Углеводороды
|
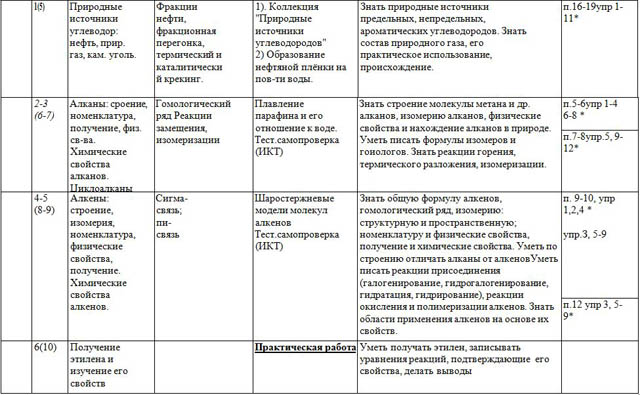
| 1(5)
| Природные источники углеводор: нефть, прир. газ, кам. уголь. | Фракции нефти, фракционная перегонка, термический и каталитический крекинг. | 1). Коллекция "Природные источники углеводородов" 2) Образование нефтяной плёнки на пов-ти воды. | Знать природные источники предельных, непредельных, ароматических углеводородов. Знать состав природного газа, его практическое использование, происхождение. | п.16-19упр 1-11* |
|
| 2-3 (6-7) | Алканы: сроение, номенклатура, получение, физ. св-ва. Химические свойства алканов. Циклоалканы | Гомологический ряд Реакции замещения, изомеризации | Плавление парафина и его отношение к воде. Тест.самопроверка (ИКТ) | Знать строение молекулы метана и др. алканов, изомерию алканов, физические свойства и нахождение алканов в природе. Уметь писать формулы изомеров и гоиологов. Знать реакции горения, термического разложения, изомеризации. | п.5-6упр 1-4 6-8 * |
| п.7-8упр.5, 9-12* |
|
| 4-5 (8-9) | Алкены: строение, изомерия, номенклатура, физические свойства, получение. Химические свойства алкенов. | Сигма-связь; пи-связь | Шаростержневые модели молекул алкенов Тест.самопроверка (ИКТ) | Знать общую формулу алкенов, гомологический ряд, изомерию: структурную и пространственную; номенклатуру и физические свойства, получение и химические свойства. Уметь по строению отличать алканы от алкеновУметь писать реакции присоединения (галогенирование, гидрогалогенирование, гидратация, гидрирование), реакции окисления и полимеризации алкенов. Знать области применения алкенов на основе их свойств. | п. 9-10, упр 1,2,4 *
упр.З, 5-9 |
| п.12 упр 3, 5-9* |
|
| 6(10) | Получение этилена и изучение его свойств |
| Практическая работа | Уметь получать этилен, записывать уравнения реакций, подтверждающие его свойства, делать выводы |
|
|
| 7(11) | Обобщение и систематиза- ция знаний по темам "Алканы" и "Алкены" |
| Учебная презентация по теме "Алканы" и "Алкены" | Упражняться в составлении химических формул изомеров и гомологов веществ классов алканов и алкенов. Уметь писать уравнения хим. реакций, отражающих хим.св-ваалканов и алкенов, решать задачи на вывод химических формул. | Повт п.5-10 |
|
| 8(12) | Алкины. Строение, изомерия, номенклатура, физ. св-ва, получение. Химические свойства алкинов. | Тройная связь. | Учебная презентация по теме "Алкины" | Знать общую формулу алкинов, гомологический ряд алкинов, изомерию и номенклатуру ацетиленовых углеводородов, получение алкиновкарбидным и метановым способом, физ. св-ва. Уметь писать реакции присоединения: галогенирование, гидрогалогенирование, гидратация, гидрирование; тримеризация ацетилена; применение алкинов. | п.13,упр. 1-3, 5 * |
|
| 9(13) | Алкадиены. Строение молекул. Химические свойства алкадиенов. Каучуки, резина. | Каучук, вулканизация, стереорегулярное и стереонерегулярноестроение. | Ознакомление с коллекцией каучук и резина. | Знать общую формулу алкадиенов, строение молекул, изомерию и номенклатуру, физические свойства. Уметь называть соединения по международной номенклатуре. Уметь писать уравнения р-ий, отражающих хим. св-ва диеновых углеводородов. | п.11-12, упр. 1-3 * |
|
| 10(14) | Арены. Строение молекулы бензола, физические свойства и получение. Химические свойства бензола | Бензольное кольцо, единая л-система. | Учебная презентация по теме "Арены" Тест.самопроверка (ИКТ) | Знать способы получения аренов, уметь писать реакции, отражающие способы получения. Знать химические свойства бензола: реакции замещения, галогенирование, нитрование, алкилирование; уметь писать уравнения соответствующих реакций. Знать применение бензола и его гомологов. | п. 14-15, упр. 1,2 * |
|
| 11(15) | Генетическая связь между классами углеводород. Обобщение знаний по теме "Углеводороды" |
| Учебный диск по теме «Углеводороды» | Уметь решать расчётные задачи на вывод формул органических соединений по массовым долям и по продуктам горения; выполнять упражнения на генетическую связь, получение и распознавание углеводородов. Уметь составлять формулы и названия углеводородов, их гомологов, изомеров. | Повт п.5-19 |
|
| 12(16) | Контрольная работа по теме "Углеводороды" |
|
| Уметь применять знания, умения и навыки, полученные при изучении данной темы.
|
|
Тема 3. Кислородсодержащие органические вещества
|
| 1-2(17-18) | Спирты. Состав, классификация, изомерия. Химические свойства предельных одноатомных и многоатомных спиртов. | Предельные одноатомные, многоатомные спирты. | Физические свойства этанола, бутанола, глицерина Взаимодействие глицерина с Сu(ОН)2, этанола с натрием, окисление этанола СuО | Знать состав и классификацию спиртов, их изомерию (положение гидроксильных групп, "углеродного скелета"). Знать физические свойства спиртов, их получение, иметь понятие о межмолекулярной водородной связи. Знать химические свойства спиртов, обусловленные наличием в молекулах гидроксогрупп, особенности свойств многоатомных спиртов, качественную реакцию на многоатомные спирты. | п. 20-22 |
|
|
|
|
|
|
| упр. 1-6* |
|
| 3(19) | Фенолы. | Фенолы | Учебная презентация по теме "Фенолы" | Знать строение молекулы фенола, его получение, физические и химические свойства, применение фенола и его производных. | п.23-24,упр 1-5* |
|
| 4(20) | Альдегиды. | Альдегиды,кетоны | Реакция «серебряного зеркала» , «медного зеркала» | Знать состав и классификацию альдегидов, их изомерию. Знать физические и химические свойства альдегидов, их способы получения. | п. 25-26, упр. 1-6* |
|
| 5(21) | Общественный смотр знаний по темам "Спирты", "Карбонильные соединения" |
| 1 .Распознавание водных растворов этанола и этаналя. 2. Распознавание водных растворов глицерина и фенола. | Уметь составлять уравнения реакций с участием спиртов, фенолов, альдегидов, а также на генетическую связь классов органических соединений, решать расчётные и экспериментальные задачи. | Повт.п.20-26 |
|
| 6(22) | Карбоновые кислоты. Классификация, номенклатура. Химические свойства карбоновых кислот. | Карбоновые кислоты. Реакция этерификации. | Знакомство с физическими свойствами карбоновых кислот. Взаимодействие уксусной кислоты с магнием, оксидом меди, гидроксидом натрия, карбонатом калия. | Знать строение молекул карбоновых кислот и карбоксильной группы. Уметь классифицировать кислоты и называть и х по международной номенклатуре. Знать биологическую роль карбоновых кислот. Знать общие свойства неорганических и органических кислот, реакцию этерификации и условия её проведения. | п.27-29, упр.1,14*,16 |
|
| 7(23)
| Сложные эфиры Жиры: состав и строение. Физические и химические свойства. | Сложные эфиры Омыление жиров. | Ознакомление с образцами сложных эфиров. Тест.самопроверка (ИКТ) | Знать строение молекул сложных эфиров, их изомерию и номенклатуру, способы получения, применение Знать состав и строение молекул жиров, их свойства, биологическую функцию жиров, понятие о CMC. | п. 30-31,упр.1-3* |
|
| 8(24) | Решение экспериментальных задач на распознавание веществ |
| Практическая работа | Уметь решать экспериментальные задачи на распознавание кислородсодержащих органических веществ, составлять уравнения реакций , делать выводы |
|
|
| 9(25) | Углеводы, их состав и классификация. Моносахариды. Полисахариды. | Моно-, ди-, полисахариды | Образцы углеводов и изделий из них. Взаимодействие сахарозы с гидроксидом меди (II) Реакция "Серебряного зеркала" Ознакомление с физическими свойствами целлюлозы и крахмала | Знать представителей каждой группы углеводов, биологическую роль углеводов, их значение в жизни человека. Знать физические свойства глюкозы, строение молекулы, зависимость химических свойств глюкозы от строения молекулы. Знать физические и химические свойства крахмала и целлюлозы, качественную реакцию на крахмал, биологическую роль полисахаридов. | п.32-35,упр.1-6* |
|
| 10(26) | Обобщение по теме «Углеводы» |
| Учебная презентация «Углеводы» | Уметь писать уравнения реакций, показывающих генетическую связь классов органических соединений. | Повт п.32-35 |
|
| 11(27) | Обобщение по теме «Кислородсодержащие органические вещества» |
| Учебный диск по теме «Кислородсодержа щие органические вещества» | Уметь писать уравнения реакций, показывающих генетическую связь классов органических соединений | Повт п.20-35 |
|
| 12(28) | Контрольная работа по теме «Кислородсодержащие органические вещества» |
|
| Уметь применять знания, умения и навыки, полученные при изучении данной темы.
|
|
Тема 4. Азотсодержащие органические вещества
|
|
1-2 (29-30)
| Амины. Аминокисло-ты. Белки | Амины, анилин. | Нейтрализация кислоты аминокислотой, нейтрализация щелочи аминокислотой Качественные реакции на белки. Тест.самопроверка (ИКТ) | Знать строение аминов, их классификацию, строение и номенклатуру, получение и свойства. Знать состав и строение молекул аминокислот, двойственность кислотно-основных свойств аминокислот и её причины. Знать первичную, вторичную, третичную и четвертичную структуры белков, химические свойства белков, биологические функции. | п. 36-38, упр. 1,2* |
|
|
|
|
|
|
| п 39-41 упр 9,10* |
|
| 3(31) | Решение эксперименталь-ных задач на получение и распознавание веществ |
| Практическая работа | Уметь решать экспериментальные задачи на получение и распознавание азотсодержащих органических веществ, составлять уравнения реакций , делать выводы |
|
Тема 5. Высокомолекулярные соединения
|
| 1(32) | Полимеры органические и неорганичес-кие. | Полимер, мономер, макромолекула, структурное звено, степень полимеризации. | Тест.самопроверка (ИКТ) | Знать основные понятия химии ВМС: полимер, мономер, макромолекула, структурное звено, степень полимеризации, способы получения полимеров, строение. | п. 42-45, упр. 1-6* |
|
| 2(33) | Распознавание пластмасс и волокон |
| Практическая работа | Уметь решать экспериментальные задачи на распознавание пластмасс и волокон, делать выводы | п. 10, упр. 1-6* |
Повторение по курсу химии 10 класса
|
| 1(34) | Органические вещества и их свойства |
| Учебный диск «Органические вещества» | Знать классификацию органических соединений, уметь писать формулы изомеров, составлять уравнения реакций, подтверждающие генетическую связь между органическими веществами |
|
СОДЕРЖАНИЕ ПРОГРАММЫ(11КЛАСС)
Повторение изученного в 10 классе (1ч)
Т е м а 1. ВАЖНЕЙШИЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ (2 часа)
Химический элемент. Закон сохранения массы веществ, закон сохранения и превращения энергии, закон постоянства состава. Классификация неорганических веществ.
Демонстрации:
1. Плакат «Классификация веществ».
2. Видеофильм «Химические элементы».
Т е м а 2. ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д. И. МЕНДЕЛЕЕВА В СВЕТЕ УЧЕНИЯ О СТРОЕНИИ АТОМА (4 часа)
Периодический закон, структура Периодической системы, орбиталь, энергетические уровни, подуровни, s-, р-, d-элементы. Значение периодического закона. Валентность и валентные возможности атомов. Изменение свойств оксидов, гидроксидов и водородных соединений химических элементов в зависимости от положения элементов в Периодической системе.
Демонстрации: комплект таблиц «Электронные оболочки атомов».
Тема 3. СТРОЕНИЕ ВЕЩЕСТВА (3 часа)
Основные типы химической связи: ковалентная (полярная и неполярная), водородная, ионная, металлическая; механизмы их образования, характеристики химической связи, кристаллические решётки.
Демонстрации;
1. Таблицы «Химическая связь».
2. Модели кристаллических решёток.
3. Транспаранты «Виды химической связи».
Т е м а 4. ХИМИЧЕСКИЕ РЕАКЦИИ (7 часов)
Классификация химических реакций. Скорость химических реакций. Факторы, влияющие на скорость реакций. Химическое равновесие. Условия, влияющие на смещение химического равновесия (принцип ЛеШателье).
Демонстрации:
1. Реакции экзо- и эндотермические.
2. Влияние на скорость химической реакции:
а) концентрации реагирующих веществ;б) поверхности соприкосновения реагирующих веществ;в)температуры;г)катализатора.
3. Видеофильм «Основы молекулярно-кинетической теории». Лабораторные опыты: из п/р№2 (с. 76) опыты 1,2,4.
Т е ма 5. НЕМЕТАЛЛЫ (6 часов)
Неметаллы. Характеристика элементов и простых веществ. Водородные соединения неметаллов, оксиды неметаллов, кислородсодержащие кислоты, окислительные свойства азотной и серной кислот.
Демонстрации:
Образцы неметаллов.
Модели кристаллических решёток Йода, алмаза, графита.
Получение аммиака и хлороводорода. Растворение их в воде, доказательство кислотно-основных свойств этих веществ.
Сжигание угля и серы в кислороде, определение химических свойств продуктов сгорания.
Взаимодействие концентрированной серной кислоты с медью.
Взаимодействие концентрированной азотной кислоты с медью.
Взаимодействие разбавленной азотной кислоты с медью.
Практическое занятие: решение практических расчетных задач. Получение, собирание и распознавание газов. (1 час)
Т е ма 6. МЕТАЛЛЫ (9 часов)
Металлы. Характеристика элементов и простых веществ. Металлы главных и побочных подгрупп Периодической системы химических элементов Д. И. Менделеева. Оксиды и гидроксиды железа, меди, хрома. Общие способы получения металлов. Электролиз. Сплавы.
Демонстрации:
Образцы металлов, их оксидов, некоторых солей.
Доказательство амфотерности алюминия.
Взаимодействие железа с кислородом.
Взаимодействие железа, меди, хрома с соляной и серной кислотами.
Получение гидроксидов меди и хрома, оксида меди.
Взаимодействие оксидов и гидроксидов металлов с кислотами.
Доказательство амфотерности соединений хрома (III), кислотных свойств хромовой
кислоты.
Образцы сплавов и изделий из них.
Электролиз раствора сульфата меди.
10. Видеофильмы «Металлы главных подгрупп», «Металлы побочных подгрупп».
Практическое занятие: решение экспериментальных задач по неорганической химии». (1 час)
Практическое занятие: решение экспериментальных задач по органической химии». (1 час)
Тема 7. ХИМИЯ И ЖИЗНЬ (2 часа)
Бытовая химическая грамотность. Продукты питания. Бытовая химия. Мебель. Лекарственные препараты. Химическое загрязнение окружающей среды и его последствия. Способы защиты окружающей среды и способы очистки и утилизации промышленных отходов.
КАЛЕНДАРНО-ТЕМАТИЧЕСКОЕ ПЛАНИРОВАНИЕ (11КЛАСС)
Повторение изученного в 10 классе (1ч)
| № п\п | Тема урока | Обязательные элементы содержания | Химический эксперимент(оборудование), ИКТ | Дидактические единицы (ЗУН) | Дифференцированное домашнее задание | Дата про- ведения |
| 1(1) | Классификация органических веществ | Углеводороды, кислород- и азотсодержащие органические вещества |
| Знать классификацию органических веществ | Повт.п.4(10кл), презентация «Многообразие органических веществ» * |
|
Тема 1. ВАЖНЕЙШИЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ (2 часа)
| 1-2 (2-3) | Химический элемент. Закон сохранения массы веществ, закон сохране- ния и превращения энергии, закон постоян-ства состава. Классификация неорганических веществ | Химический элемент, про-стое вещество, оксиды, гидроксиды (основания и кислоты), соли | Демонстрации: -ПС; - плакат «Классификация веществ;видеофильм «Хи-мические элементы» | Знать определение закона сохранения массы веществ и закона постоянства состава, их практическое значение; взаимосвязь закона сохране-ния массы веществ и закона превращения энергии, клас- сификацию неорганических веществ. Уметь различать понятия«химический элемент» и«простое вещество» | §1,2, упр. 1-3* |
|
|
|
|
|
|
|
|
|
| ТЕМА 2.ПЕРИОДИЧЕСКИЙ ЗАКОН И ПЕРИОДИЧЕСКАЯ СИСТЕМА ХИМИЧЕСКИХ ЭЛЕМЕНТОВ Д.И.МЕНДЕЛЕЕВА (4часа) |
| 1-2 (4-5) | Структура Периодичес- кой системы. Периоди-ческий закон. Строение электронных оболочек атомов химических элементов | Структура Периодической системы, периодический закон, орби-таль, энерге-тические уровни, подуровни,S-, р- d-элементы, электронные и графические формулы | Демонстрации: - Периодическая сис тема химических элементов Д. И. Менделеева; таблицы по строе нию атомов ИКТ: презентация «Периодический закон и система Д.И.Менделеева» | Знать структуру ПС, опре- деление периодического за- кона, строение электронных оболочек атомов химических элементов, расположение электронов на уровнях и подуровнях, значение пе- риодического закона. Уметь различать понятия«электрон-ное облако» и «орбиталь», характеризовать s-,- р-, d-электроны, определятьмаксимальное число электронов на уровне, характеризовать порядок заполнения электронами подуровней в атомах химических элементов № 1 -№ 38, составлять электронные и графические формулы, характеризовать химические элементы по положению в ПС и строению атома | §3,4, упр. 5-7*, задача 4,5* |
|
| 3(6) | Валентность и валентные возможности атомов | Валентность, валентные возможности атомов, атом в возбуждённом состоянии, различные механизмы образования ковалентной связи, свободная орбиталь, неподелённая электронная пара, периодическое изменение радиусов атомов химических элементов с возрастанием зарядов их ядер | Демонстрация: - комплект таблиц «Электронные оболочки атомов» ИКТ: презентация «Валентность и валентные возможности атомов» | Знать определение валентности в свете строения атомов, валентные возможности атомов элементов 2-го периода. Уметь объяснять причину высшей валентности атомов, определять валентность элементов при образовании химической связи по донорно-акцепторному механизму, составлять графические схемы строения внешних электронных слоев атомов химических элементов в возбуждённом и невозбуждённом состоянии | §5, с. 17-21, упр. 14, задача 2* |
|
| 4(7) | Изменение свойств соединений химических элементов в периодах и группах | Оксиды, гидроксиды, водородные соединения, гидриды металлов | ДемонстрацияПС ИКТ: презентация «Изменение свойств соединений химических элементов в периодах и группах» | Знать состав, строение, свойства оксидов, гидрокси-дов, водородных соединений химических элементов малых периодов и главных подгрупп | §5, с. 21-22, упр. 17, задача 2* |
|
ТЕМА 3.СТРОЕНИЕ ВЕЩЕСТВА(3часа)
| 1(8) | Основные виды | Виды химической связи: | ИКТ: презентация «Изменение свойств соединений химических элементов в периодах и группах» | Знать определение химиче- | §6, |
|
|
| химической | ковалентная (неполярная, | «Виды связи» | ской связи, виды химической | упр. 2,3, |
|
|
| связи, меха- | полярная), водородная, |
| связи, механизмы их образо- |
|
|
|
| низмы их обра- | ионная, металлическая, |
| вания. | задача 3* |
|
|
| зования | общие электронные пары, |
| Уметь определять вид хи- |
|
|
|
|
| донор, акцептор |
| мической связи в простых и |
|
|
|
|
|
|
| сложных веществах, состав- |
|
|
|
|
|
|
| лять схемы образования ве- |
|
|
|
|
|
|
| ществ с различными видами |
|
|
|
|
|
|
| связи, объяснять механизм |
|
|
|
|
|
|
| образования донорно- |
|
|
|
|
|
|
| акцепторной, ковалентной |
|
|
|
|
|
|
| связи, особенности водород- |
|
|
|
|
|
|
| ной связи |
|
|
| 2(9) | Характеристи- | Длина, энергия, направ- | ИКТ: презентация | Знать основныехарактери- | §7,8, |
|
|
| ки химической | направленность, насыщаемость | «Виды связи» | стики химической связи, | (§10*-про- |
|
|
| связи. Кристал- | связи,крист.решетки
связи, виды |
| типы кристаллическихрешё- | читать) |
|
|
| лические решетки |
|
| ток. | упр. 6, 8*, |
|
| 3(10) | Общественный смотр знаний по теме 1-2 |
| Тест.проверка знаний(ИКТ) | Знать структуру ПС, уметь характеризовать элемент по его положению в ПС, определять вид связи и решетки | повт п.1-10 |
|
ТЕМА 4. ХИМИЧЕСКИЕ РЕАКЦИИ (7 часов)
| 1(11) | Классификация | Классификация химиче- | Демонстрация: | Знать признаки и классифи- | § 11,упр. 3, |
|
|
| химических | реакций по числу и | - реакции | кации химических реакций. | 4, задача. 2* |
|
|
| реакций. Теп- | разнымпприсоставу исходных веществ | разных типов
| Уметь классифицировать |
|
|
|
| ловой эффект | признакам,.реакции, по | классификаций | предложенные химические |
|
|
|
|
|
|
| реакции |
|
|
| 2-3 | Скорость хи- | Скорость гомогенных ре- | Демонстрация: | Знать понятие скорости для | §12, упр. 5, |
|
| (12-13) | мическихреак- | акций, скорость гетероген- | - влияние на ско- | гомогенной и гетерогенной | 6, с. 62, |
|
|
| ций. Катализ | ных реакций, закон дейст- | рость химической | реакции, факторы, влияю- | задача 1,2* |
|
|
|
| вия масс, катализ, актив- | реакции: | щие на скорость реакции, |
|
|
|
|
| ные молекулы, катализа- | - концентрации; | сущность катализа, приме- |
|
|
|
|
| тор, ингибитор | - поверхности со- | нение катализаторов и инги- |
|
|
|
|
|
| прикосновения реа- | биторов. |
|
|
|
|
|
| гирующих веществ; | Уметь объяснять действие |
|
|
|
|
|
| -температуры; | каждого фактора, влияюще- |
|
|
|
|
|
| - катализатора | го на скорость реакции на |
|
|
|
|
|
| ИКТ: презентация «Скорость реакций» | конкретных примерах |
|
|
| 4(14) | Химическое | Химическое равновесие, | Демонстрация: | Знать определение состоя- | § 13,14 |
|
|
| равновесие. | обратимые и необратимые | - видеофильм «Ос- | ния химического равновесия, |
|
|
|
| Принцип Ле | реакции, условия, влияю- | новы молекулярно- | факторы, влияющие на сме- | упр. 8, 12* |
|
|
| Шателье | щие на смещение химиче- | кинетической тео- | щение химического равнове- |
|
|
|
|
| ского равновесия (принцип | рии» | сия, определение принципа |
|
|
|
|
| ЛеШателье), константа |
| ЛеШателье, определение |
|
|
|
|
| равновесия |
| обратимых и необратимых |
|
|
|
|
|
|
| реакций. Уметь объяснять на конкретных примерах способы смещения химического равновесия, применяя принцип ЛеШателье, записывать константу равновесия для гомогенных и гетерогенных реакций |
|
|
| 5-6(15-16) | Обобщение и систематизация знаний по темам 1-4 | Химический элемент, простые и сложные вещества, классификация неорганических веществ, структура ПС, строение атомов, строение электронных оболочек атомов, валентность, валентные возможности атомов, типы химической связи и типы кристаллических решеток, классификация химических реакций, скорость химических реакций, химическое равновесие | Лабораторные опыты из п/р № 2, с. 76 (№1,2,4) Тест.проверка знаний(ИКТ) | Уметь применять знания, умения и навыки, полученные при изучении тем 1-4, в ходе выполнения тренировочных заданий | Упр. 7,10*Повторить § 4; подготовка к к/р |
|
| 7(17) | Контрольная работа № 1по темам 1-4 | Закрепление и контроль ЗУН, полученных при изучении тем 1-4 | Тест.проверка знаний(ИКТ) | Уметь применять ЗУН, полученные при изучении тем 1-4, в ходе выполнения к/р |
|
|
| ТЕМА 5. НЕМЕТАЛЛЫ(6 часов)
|
| 1(18) и | Общая характеристика неметаллов | Неметаллы, характеристика элементов и простых веществ, ковалентная связь, кристаллические решётки (атомная, молекулярная), физические и химические свойства простых веществ неметаллов | Демонстрации: - образцы неметаллов; - модели кристаллических решёток йода, алмаза, графита ИКТ:презентация «Неметаллы» | Знать строение, свойства и применение простых веществ неметаллов. Уметь характеризовать химические элементы неметаллы по положению в ПС и строению атомов, определять вид химической связи, | §30, упр. 2,3* |
|
| 2(19)
| Водородные соединения неметаллов | Летучие водородные соединения, их кислотно-основные свойства | Демонстрации: - получение аммиака и хлороводорода, растворение их в воде, доказательство кислотно-основных свойств этих веществ Тест.проверка знаний(ИКТ) | Знать состав, строение, свойства, применение летучих водородных соединений. Уметь составлять формулы летучих водородных соединений неметаллов на основе строения их атомов и электроотрицательности, определять вид химической связи, тип кристаллической решетки, характеризовать физические и химические свойства, записывать уравнения химических реакций | §32, упр. 12 |
|
| 3(20) | Оксиды неметаллов | Оксиды неметаллов: солеобразующие и несолеобразующие, кислотные; физические и химические свойства оксидов | Демонстрации: - сжигание угля и серы в кислороде; - определение химических свойств продуктов сгорания ИКТ:презентация «Неметаллы» | Знать классификацию оксидов, их состав, строение, свойства, применение. Уметь составлять формулы оксидов химических элементов неметаллов I—IV периодов ПС, определять в них вид химической связи, тип кристаллической решётки, прогнозировать исходя из этого физические и химические свойства, объяснять причины изменения свойств в периодах и группах, записывать уравнения реакций | §31, с. 128-129, упр. 6,7* |
|
| 4-5 (21-22) | Кислородсодержащие кислоты. Окислительные свойства азотной и серной кислот | Кислородсодержащие кислоты, концентрированная, разбавленная азотная и серная кислоты, окислительные свойства азотной и серной кислот | Демонстрации: - взаимодействие концентрированной серной, концентрированной и разбавленной азотной кислот с медью ИКТ:презентация «Соединения неметаллов» | Уметь составлять формулы кислородсодержащих и бескислородных кислот, образованных неметаллами П-Ш периодов, определять вид химической связи, тип кристаллической решётки, характеризовать химические свойства кислот, записывать уравнения химических реакций в молекулярном, ионном и окислительно-восстановительном виде, характеризовать окислительные свойства азотной и концентрированной серной кислот, расставлять коэффициенты методом электронного баланса | §31, с. 130-134, упр. 9, 10*, 13 (б) |
|
| 6(23) | П/р № 1 «Решение практических расчетных задач. Получение, собирание и распознавание газов» | Свойства кислот, расчеты по уравнению, получение газов и их идентификация | Практическая работа | Уметь решать практические расчетные задачи, получать, собирать, распознавать газы, правильно проводить эксперимент, соблюдая правила техники безопасности | повт.п.30-31 |
|
ТЕМА 6.МЕТАЛЛЫ(9 часов)
| 1(24) | Общая характеристика металлов | Металлы, s-, р-, d-эле-менты, металлическая связь, металлическая кристаллическая решётка | Демонстрация образцов металлов, их оксидов, некоторых солей ИКТ:презентация «Металлы» | Звать строение, свойства, способы получения и применение простых веществ металлов. Уметь характеризовать химические элементы металлы по положению в ПС и строению атомов, характеризовать химические свойства металлов, записывать уравнения реакций в молекулярном и окислительно-восстановительном виде | С. 77-79, упр. 4, с. 88, упр. б* |
|
| 2(25) | Металлы главных подгрупп ПС | Металлы главных подгрупп, соединения металлов (оксиды, основания, соли), амфотерность алюминия и его соединений | Демонстрации: - образцы металлов, их оксидов, некоторых солей; - взаимодействие металлов с кислородом, кислотами, водой; - доказательство ам- | Знать характеристику металлов главных подгрупп ПС, исходя из положения в ПС и строения атомов. Уметь объяснять изменение свойств простых веществ металлов, а также их соединений (оксидов, гидроксидов, гидридов) в пределах одного | §21, табл. 13, с. 116 упр. 5, 7*, з.1 |
|
|
|
|
| фотерности алюминия и его гидроксида ИКТ:презентация «Металлы» | периода и главной подгруппы ПС, характеризовать химические свойства простых веществ металлов (главных подгрупп 1-Ш групп), свойства их соединений (оксидов, гидроксидов), записывать уравнения реакций в молекулярном, ионном и окислительно-восстановительном виде |
|
|
| 3-4 | Металлы по- | Металлы побочных под- | Демонстрации: | Знать характеристику хими- | §22,23,26, |
|
| (26-27) | бочных под- | групп, d-элементы | - образцы меди, же- | ческих элементов побочных | 27 |
|
|
| групп ПС |
| леза, хрома, их со- | подгрупп (железа, хрома, | табл. 14, |
|
|
| Д. И. Менде- |
| единений; | меди) по положению в ПС и |
|
|
|
| леева. |
| - взаимодействие | строению атомов, характе- | упр. 3,8* |
|
|
| меди, хрома |
| меди и железа с ки- | важнейшие степени окисле- |
|
|
|
|
|
| слотами (серная, со- | ния меди, железа, хрома вих |
|
|
|
|
|
| ляная); | соединениях (оксидах, гид- |
|
|
|
|
|
| - получение гидро- | роксидах). |
|
|
|
|
|
| ксидов меди, хрома, | Уметь характеризовать фи- |
|
|
|
|
|
| оксида меди; | зические и химические свой- |
|
|
|
|
|
| - взаимодействие | ства металлов в сравнении с |
|
|
|
|
|
| оксидов и гидрокси- | металлами главных под- |
|
|
|
|
|
| дов металлов с ки- | групп, записывать уравнения |
|
|
|
|
|
| слотами; | реакций в молекулярном и |
|
|
|
|
|
| - доказательство ам- | окислительно-восстанови- |
|
|
|
|
|
| фотерностисоедине- | тельном виде, прогнозиро- |
|
|
|
|
|
| ний хрома (III), ки- | вать химические свойства |
|
|
|
|
|
| слотных свойств | соединений металлов (желе- |
|
|
|
|
|
| хромовой кислоты | за, меди, хрома) по степени |
|
|
|
|
|
|
| окисления и характеризо- |
|
|
|
|
|
|
| вать на примере записи |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
| уравнений реакций в моле- |
|
|
|
|
|
|
| кулярном и ионном виде |
|
|
| 5(28) | Общие способы | Металлургия, пирометал- | Демонстрации: | Знать общие способы полу- | §19, |
|
|
| получения ме- | лургия, алюминотермия, | - образцы сплавов | чения металлов. | упр. 5,7, |
|
|
| таллов. Сплавы | электролиз | и изделий из них; | Уметь записывать уравне- | задача 2* |
|
|
|
|
| - электролиз раство- | ния реакций, подтверждаю- |
|
|
|
|
|
| ра сульфата меди ИКТ:презентация «Соединения неметаллов» | щие основные способы получения металлов, записывать уравнения реакций электролиза растворов и расплавов |
|
|
| 6(29) | Обобщение и систематиза-ция знаний по темам 5 и 6 | Неметаллы, водородные соединения, оксиды, кислородсодержащие кислоты, металлы главных и побочных подгрупп, их соединения, гидролиз соединений | Демонстрации: - видеофильм «Металлы главных подгрупп»; - видеофильм «Металлы побочных подгрупп» | Уметь применять полученные при изучении тем знания, умения и навыки при выполнении тренировочных заданий | Упр. 6, 17, 18, задачи 3, 5*
|
|
| 7(30) | Практическая работа № 2 «Решение экспериментальных задач по неорганичес-кой химии» |
| Практическая работа | Уметь проводить химический эксперимент по изучению химических свойств соединений, соблюдая правила техники безопасности | Повторить §19,21-23,26 |
|
| 8(31) | Практическая работа № 3 «Решение экспериментальных задач по органической химии» |
| Практическая работа | Уметь проводить химический эксперимент по изучению химических свойств соединений, соблюдая правила техники безопасности | Повторить §27,29, 30-32 |
|
| 9(32) | Контрольная работа № 2 по темам 5 и 6 | Закрепление и контроль ЗУН, полученных при изучении тем 5 и 6 | Тест.проверка знаний (ИКТ) | Уметь применять ЗУН, полученные при изучении тем 5 и 6, при выполнении к/р |
|
|
|
ТЕМА 7. ХИМИЯ И ЖИЗНЬ(2 часа)
|
| 1-2 (33-34) | Бытовая химическая грамотность. Химическое загрязнение окружающей среды | Бытовая химическая грамотность. Продукты питания, бытовая химия, лекарственные препараты. Химическое загрязнение окружающей среды и его последствия, способы защиты окружающей среды | Демонстрация: - видеофильм «Химия вокруг нас» | Знать правила выбора продуктов питания, правильное использование средств бытовой химии, лекарственных препаратов. Знать о последствиях загрязнений окружающей среды и способах ее защиты | П.34,видеодоклад (с презентацией) «Химическое загрязнение окружающей среды» * |
|
ЛИТЕРАТУРА
1. Г.Е.Рудзитис, Ф.Г.Фельдман. Химия-10,11.-М.Просвещение,2011,2012
2. Гара Н. Н., Зуева М. В. Контрольные и проверочные работы по химии 8—11 кл. — М.: Дрофа, 2010.
3. Гара Н. Н., Кошелева Е. А. Тесты по химии. 8—11 кл. — М.: Генжер, 2011.
4. Гузей Л. С, Суровцева Р. П. Тесты по химии. 8—11 кл. — М.: Дрофа, 2012.
5. Ра д е ц к и й А. М. и др. Дидактические материалы по химии. 8—11 кл. — М.: Просвещение, 2011.

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая учебная программа по химии (10-11 класс) (0.11 MB)
Рабочая учебная программа по химии (10-11 класс) (0.11 MB)
 0
0 1054
1054 74
74 Нравится
0
Нравится
0







