Рабочая программа по химии для 1 курса медицинского колледжа
Пояснительная записка
Рабочая программа учебной дисциплины «Химия» составлена на основе примерной программы учебной дисциплины «Химия» для профессий начального профессионального образования и специальностей среднего профессионального образования и рекомендаций Минобрнауки РФ 2007 г., приказа Минобрнауки РФ № 355 от 28.09.2009 г. и разъяснений научно-методического совета Центра начального, среднего, высшего и дополнительного профессионального образования ФГУ «ФИРО» приказ №1 от 03.02.2011 г.
Рабочая программа предназначена для изучения химии на базе основного общего образования при подготовке специалистов среднего звена.
Данная программа ориентирована на достижение следующих целей:
освоение знаний о химической составляющей естественно-научной картины мира, важнейших химических понятиях, законах и теориях;
овладение умениями применять полученные знания для объяснения разнообразных химических явлений и свойств веществ, оценки роли химии в развитии современных технологий и получении новых материалов;
развитие познавательных интересов и интеллектуальных способностей в процессе самостоятельного приобретения химических знаний с использованием различных источников информации, в том числе компьютерных;
воспитание убежденности позитивной роли химии в жизни современного общества, необходимости химически грамотного отношения к собственному здоровью и окружающей среде;
применение полученных знаний и умений для безопасного использования веществ и материалов в быту, на производстве и в сельском хозяйстве, для решения практических задач в повседневной жизни, для предупреждения явлений, наносящих вред здоровью человека и окружающей среде.
Отбор содержания проводился на основе следующих ведущих идей:
материальное единство веществ природы и их генетическая связь;
причинно-следственные связи между составом, строением, свойствами и применением веществ;
познаваемость мира и закономерностей химических процессов;
объясняющая и прогнозирующая роль теоретических знаний для фактологического материала;
конкретное химическое соединение представляет собой звено в непрерывной цепи превращений веществ, оно участвует в круговороте химических веществ и в химической эволюции;
законы природы объективны и познаваемы; знание законов химии дает возможность управлять превращениями веществ, находить экологически безопасные способы производства веществ и материалов и охраны окружающей среды от химического загрязнения;
наука и практика взаимосвязаны: требования практики – движущая сила развития науки, успехи практики обусловлены достижениями науки;
развитие химической науки и химизация народного хозяйства служат интересам человека и общества в целом, имеют гуманистический характер и призваны способствовать решению глобальных проблем человечества.
В программе теоретические сведения дополняются демонстрациями, лабораторными опытами и практическими работами. Предусмотрены задания для организации самостоятельной внеаудиторной деятельности студентов.
При изучении химии значительное место отводится химическому эксперименту, что позволяет формировать у студентов специальные предметные умения работать с веществами, выполнять простые химические опыты. Учит безопасному и экологически грамотному обращению с веществами, материалами и процессами в быту и на производстве.
На освоение учебной дисциплины «Химия» отводится время в объеме 156 часов, из них на лекции отводится 42 часа (1 семестр – 18 часов, 2 семестр – 24 часа), на семинары – 20 часов (1 семестр – 8 часов, 2 семестр – 12 часов), на практические занятия 94 часа (1 семестр – 38 часов, 2 семестр – 56 часов).
В соответствии с рекомендациями Минобрнауки РФ 2007 г., приказом Минобрнауки РФ № 355 от 28.09.2009 г. и разъяснениями научно-методического совета Центра начального, среднего, высшего и дополнительного профессионального образования ФГУ «ФИРО» приказ №1 от 03.02.2011 г. разница от рекомендованных в примерной программе (2008 г.) составляет 39 часов, изучение которых предусмотрено в процессе самостоятельной внеаудиторной работы студентов.
Для сохранения преемственности преподавания дисциплины курс по аналогии с программой по химии для общеобразовательных учреждений начинается изучением раздела «Общая и неорганическая химия» и завершается разделом «Органическая химия».
ТЕМАТИЧЕСКИЙ ПЛАН
| № раздела темы |
Наименование темы | Всего часов макси мальной нагрузки | Ауди тор ные часы
| Количество часов |
| теоретические | самос тоятельная работа |
| лек ции | семина ры | практика |
|
|
| 1 семестр | 96 | 64 | 18 | 8 | 38 | 32 |
| 1 | Общая и неорганическая химия | 117 | 78 | 22 | 10 | 42 | 39 |
| 1.1 | Химия – наука о веществах | 3 | 2 | 1 | - | 1 | 1 |
| 1.2 | Строение атома | 8 | 5 | 1 | 1 | 3 | 3 |
| 1.3 | Периодический закон и периодическая система химических элементов Д.И. Менделеева | 7 | 5 | 2 | 1 | 2 | 2 |
| 1.4 | Строение вещества | 13 | 9 | 2 | 1 | 6 | 4 |
| 1.5 | Полимеры | 5 | 3 | 1 | - | 2 | 2 |
| 1.6 | Дисперсные системы | 6 | 4 | 1 | 1 | 2 | 2 |
| 1.7 | Химические реакции | 14 | 9 | 2 | 1 | 6 | 5 |
| 1.8 | Растворы | 10 | 7 | 2 | 1 | 4 | 3 |
| 1.9 | Окислительно-восстановительные реакции. Электрохимические процессы | 9 | 6 | 2 | - | 4 | 3 |
| 1.10 | Классификация веществ. Простые вещества | 9 | 6 | 2 | - | 4 | 3 |
| 1.11 | Основные классы неорганических и органических соединений | 12 | 8 | 2 | 2 | 4 | 4 |
|
| 2 семестр | 138 | 92 | 24 | 12 | 56 | 46 |
| 1.12 | Химия элементов | 16 | 11 | 3 | 2 | 6 | 5 |
| 1.13 | Химия в жизни общества | 5 | 3 | 1 | - | 2 | 2 |
| 2 | Органическая химия | 117 | 78 | 20 | 10 | 48 | 39 |
| 2.1 | Предмет органической химии. Теория строения органических соединений | 21 | 14 | 2 | 2 | 10 | 7 |
| 2.2 | Предельные углеводороды | 9 | 6 | 2 | - | 4 | 3 |
| 2.3 | Этиленовые и диеновые углеводороды | 9 | 6 | 2 | - | 4 | 3 |
| 2.4 | Ацетиленовые углеводороды | 4 | 3 | 1 | - | 2 | 1 |
| 2.5 | Ароматические углеводороды | 6 | 4 | 1 | 1 | 2 | 2 |
| 2.6 | Природные источники углеводородов | 5 | 3 | - | 1 | 2 | 2 |
| 2.7 | Гидроксильные соединения | 6 | 4 | 2 | - | 2 | 2 |
| 2.8 | Альдегиды и кетоны | 10 | 7 | 2 | 1 | 4 | 3 |
| 2.9 | Карбоновые кислоты и их производные | 11 | 7 | 2 | 1 | 4 | 4 |
| 2.10 | Углеводы | 12 | 8 | 2 | 2 | 4 | 4 |
| 2.11 | Амины, аминокислоты, белки | 11 | 7 | 2 | 1 | 4 | 4 |
| 2.12 | Азотсодержащие гетероциклические соединения. Нуклеиновые кислоты | 6 | 4 | 1 | 1 | 2 | 2 |
| 2.13 | Биологически активные соединения | 7 | 5 | 1 | - | 4 | 2 |
|
| ВСЕГО | 234 | 156 | 42 | 20 | 94 | 78 |
Перечень и нумерация практических и теоретических занятий
(лекции и семинарские занятия)
I семестр
Лекции
| № | Название темы | Количество часов |
| Основные понятия и законы химии. Строение атома. | 2 |
| Периодический закон и периодическая система Д.И.Менделеева. | 2 |
| Строение вещества. | 2 |
| Полимеры. Дисперсные системы. | 2 |
| Химические реакции. | 2 |
| Растворы. | 2 |
| Окислительно-восстановительные реакции. | 2 |
| Классификация веществ. | 2 |
| Основные классы органических и неорганических веществ. | 2 |
|
| Всего | 18 |
Семинары
| № п/п | Наименование темы | Количество часов |
| Строение атома. Периодический закон и периодическая система химических элементов Д.И.Менделеева. | 2 |
| Строение вещества. Полимеры. Дисперсные системы. | 2 |
| Химические реакции. Растворы. | 2 |
| Основные классы органических и неорганических соединений. | 2 |
|
| Всего | 8 |
Практические занятия
| № п/п | Наименование темы | Количество часов |
| Правила безопасной работы в лаборатории. Строение атома. | 2 |
| Строение атома. | 2 |
| Периодический закон и периодическая система химических элементов Д.И.Менделеева. | 2 |
| Виды химической связи. | 2 |
| Виды химической связи. | 2 |
| Комплексные соединения. | 2 |
| Полимеры. | 2 |
| Дисперсные системы. | 2 |
| Типы и закономерности протекания химических реакций. | 2 |
| Скорость химической реакции и факторы, на нее влияющие. | 2 |
| Химическое равновесие и факторы, на него влияющие. | 2 |
| Растворы. | 2 |
| Гидролиз солей. | 2 |
| Окислительно-восстановительные реакции. | 2 |
| Электролиз. | 2 |
| Свойства простых веществ-металлов. | 2 |
| Свойства простых веществ-неметаллов. | 2 |
| Свойства оксидов и оснований. | 2 |
| Свойства кислот и солей. | 2 |
|
| Всего | 38 |
2 семестр
Лекции
| № п/п | Наименование темы | Количество часов |
| s-элементы и p-элементы, их соединения. | 2 |
| d-элементы и их соединения. Химия в жизни общества. | 2 |
| Предмет органической химии. | 2 |
| Предельные углеводороды. | 2 |
| Этиленовые и диеновые углеводороды. | 2 |
| Ацетиленовые углеводороды. Ароматические углеводороды. | 2 |
| Гидроксильные соединения. | 2 |
| Альдегиды. Кетоны. | 2 |
| Карбоновые кислоты. | 2 |
| Углеводы. | 2 |
| Амины. Аминокислоты. | 2 |
| Гетероциклические соединения. Биологически активные соединения. | 2 |
|
| Всего | 24 |
Семинары
| № п/п | Наименование темы | Количество часов |
| Химия элементов. | 2 |
| Предмет органической химии. | 2 |
| Углеводороды. Природные источники углеводородов. | 2 |
| Спирты. Альдегиды. Карбоновые кислоты. | 2 |
| Углеводы. | 2 |
| Азотсодержащие соединения. | 2 |
|
| Всего | 12 |
Практические занятия
| № п/п | Наименование темы | Количество часов |
| s-элементы и их соединения. | 2 |
| p-элементы и их соединения. | 2 |
| d-элементы и их соединения. | 2 |
| Химия в жизни общества. | 2 |
| Особенности строения органических соединений. | 2 |
| Изомеры и гомологи. | 2 |
| Номенклатура органических соединений. | 2 |
| Номенклатура органических соединений. | 2 |
| Химические реакции в органической химии. | 2 |
| Предельные углеводороды. | 2 |
| Предельные углеводороды. | 2 |
| Этиленовые углеводороды. | 2 |
| Диеновые углеводороды. | 2 |
| Ацетиленовые углеводороды. | 2 |
| Ароматические углеводороды. | 2 |
| Природные источники углеводородов. | 2 |
| Спирты. | 2 |
| Альдегиды. | 2 |
| Кетоны. | 2 |
| Карбоновые кислоты. | 2 |
| Сложные эфиры. Жиры. | 2 |
| Углеводы. | 2 |
| Углеводы. | 2 |
| Амины. | 2 |
| Аминокислоты. Белки. | 2 |
| Гетероциклы. Нуклеиновые кислоты. | 2 |
| Ферменты. Витамины. | 2 |
| Гормоны. Лекарства. | 2 |
|
| Всего | 56 |
Содержание учебной дисциплины
Раздел 1
Общая и неорганическая химия
Введение
Научные методы познания веществ и химических явлений. Роль эксперимента и теории в химии. Моделирование химических процессов.
1.1. Химия – наука о веществах
Состав вещества. Химические элементы. Способы существования химических элементов: атомы, простые и сложные вещества. Вещества постоянного и переменного состава. Закон постоянства состава веществ. Вещества молекулярного и немолекулярного строения. Способы отображения молекул: молекулярные и структурные формулы; шаростержневые и масштабные пространственные (Стюарта–Бриглеба) модели молекул.
Измерение вещества. Масса атомов и молекул. Атомная единица массы. Относительные атомная и молекулярная массы. Количество вещества и единицы его измерения: моль, ммоль, кмоль. Число Авогадро. Молярная масса.
Агрегатные состояния вещества: твердое (кристаллическое и аморфное), жидкое и газообразное. Закон Авогадро и его следствия. Молярный объем веществ в газообразном состоянии. Объединенный газовый закон и уравнение Менделеева–Клапейрона.
Смеси веществ. Различия между смесями и химическими соединениями. Массовая и объемная доли компонентов смеси.
Демонстрации. Опыты, иллюстрирующие закон сохранения массы веществ. Набор моделей атомов и молекул. Некоторые вещества количеством 1 моль. Модель молярного объема газов.
Лабораторные опыты. Изготовление моделей молекул некоторых органических и неорганических веществ.
Практическая работа. Очистка веществ фильтрованием и дистилляцией. Очистка веществ перекристаллизацией.
Изучив раздел студент должен:
знать:
роль химии в естествознании, ее связь с другими естественными науками, значение в жизни современного общества;
важнейшие химические понятия: вещество, химический элемент, атом, молекула, масса атомов и молекул, ион, радикал, аллотропия, моль, молярная масса, молярный объем газообразных веществ, вещества молекулярного и немолекулярного строения;
основные законы химии: закон сохранения массы веществ, закон постоянства состава веществ, закон Авогадро.
Уметь:
1.2. Строение атома
Атом – сложная частица. Доказательства сложности строения атома: катодные и рентгеновские лучи, фотоэффект, радиоактивность, электролиз.
Планетарная модель атома Э. Резерфорда. Строение атома по Н. Бору. Современные представления о строении атома. Корпускулярно-волновой дуализм частиц микромира.
Состав атомного ядра – нуклоны: протоны и нейтроны. Изотопы и нуклиды. Устойчивость ядер.
Электронная оболочка атомов. Понятие об электронной орбитали и электронном облаке. Квантовые числа: главное, орбитальное (побочное), магнитное и спиновое. Распределение электронов по энергетическим уровням, подуровням и орбиталям в соответствии с принципом наименьшей энергии, принципом Паули и правилом Гунда. Электронные конфигурации атомов химических элементов.
Валентные возможности атомов химических элементов.
Электронная классификация химических элементов: s-, p-, d-, f-элементы.
Демонстрации. Модели орбиталей различной формы.
Изучив раздел студент должен:
знать:
важнейшие химические понятия: нуклиды и изотопы, атомные s-, p-, d-орбитали;
основные теории химии: строения атома.
Уметь:
определять: валентность и степень окисления химических элементов;
осуществлять: самостоятельный поиск химической информации с использованием различных; использовать компьютерные технологии для обработки и передачи химической информации и ее представления в различных формах.
1.3. Периодический закон и Периодическая система химических элементов Д.И. Менделеева
Открытие Периодического закона. Предпосылки: накопление фактологического материала, работы предшественников (И.В. Деберейнера, А.Э. Шанкуртуа, Дж.А. Ньюлендса, Л.Ю. Мейера), съезд химиков в Карлсруэ, личностные качества Д.И. Менделеева. Открытие Д.И. Менделеевым Периодического закона.
Периодический закон и строение атома. Изотопы. Современное понятие химического элемента. Закономерность Г. Мозли. Современная формулировка Периодического закона. Периодическая система и строение атома. Физический смысл порядкового номера элементов, номеров группы и периода. Периодическое изменение свойств элементов: радиуса атома; энергии ионизации; электроотрицательности. Причины изменения металлических и неметаллических свойств элементов в группах и периодах, в том числе больших и сверхбольших. Значение Периодического закона и Периодической системы химических элементов Д.И. Менделеева для развития науки и понимания химической картины мира.
Демонстрации. Различные варианты таблицы Периодической системы химических элементов Д.И. Менделеева. Образцы простых веществ оксидов и гидроксидов элементов III периода.
Лабораторные опыты. Сравнение свойств простых веществ, оксидов и гидроксидов элементов III периода.
Изучив раздел студент должен:
знать:
Уметь:
характеризовать: s-, p-, d-элементы по их положению в Периодической системе Д.И. Менделеева;
объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева.
1.4. Строение вещества
Понятие о химической связи. Типы химических связей: ковалентная, ионная, металлическая и водородная.
Ковалентная химическая связь. Два механизма образования этой связи: обменный и донорно-акцепторный. Основные параметры этого типа связи: длина, прочность, угол связи или валентный угол. Основные свойства ковалентной связи: насыщенность, поляризуемость и прочность. Электроотрицательность и классификация ковалентных связей по этому признаку: полярная и неполярная ковалентные связи. Полярность связи и полярность молекулы. Способ перекрывания электронных орбиталей и классификация ковалентных связей по этому признаку: - и -связи. Кратность ковалентных связей и классификация их по этому признаку: одинарные, двойные, тройные, полуторные. Типы кристаллических решеток у веществ с этим типом связи: атомные и молекулярные. Физические свойства веществ с этими кристаллическими решетками.
Ионная химическая связь, как крайний случай ковалентной полярной связи Механизм образования ионной связи. Ионные кристаллические решетки и свойства веществ с такими кристаллами.
Металлическая химическая связь, как особый тип химической связи, существующий в металлах и сплавах. Ее отличия и сходство с ковалентной и ионной связями. Свойства металлической связи. Металлические кристаллические решетки и свойства веществ с такими кристаллами.
Водородная химическая связь. Механизм образования такой связи. Ее классификация: межмолекулярная и внутримолекулярная водородные связи. Молекулярные кристаллические решетки для этого типа связи. Физические свойства веществ с водородной связью. Биологическая роль водородных связей в организации структур биополимеров.
Единая природа химических связей: наличие различных типов связей в одном веществе, переход одного типа связи в другой и т.п.
Комплексообразование. Понятие о комплексных соединениях. Координационное число комплексообразователя. Внутренняя и внешняя сфера комплексов. Номенклатура комплексных соединений. Их значение.
Демонстрации. Модели молекул различной архитектуры. Модели из воздушных шаров пространственного расположения sp-, sp2-, sp3-гибридных орбиталей. Модели кристаллических решеток различного типа. Модели молекул ДНК и белка.
Лабораторные опыты. Взаимодействие многоатомных спиртов с фелинговой жидкостью. Качественные реакции на ионы Fe2+ и Fe3+.
Изучив раздел студент должен:
знать:
важнейшие химические понятия: химическая связь, электроотрицательность, валентность, степень окисления, гибридизация орбиталей, пространственное строение молекул, комплексные соединения;
основные теории химии: химической связи.
Уметь:
определять: валентность и степень окисления химических элементов, тип химической связи в соединениях, заряд иона, пространственное строение молекул, тип кристаллической решетки;
объяснять: природу химической связи.
1.5. Полимеры
Неорганические полимеры. Полимеры – простые вещества с атомной кристаллической решеткой: аллотропные видоизменения углерода (алмаз, графит, карбин, фуллерен – взаимосвязь гибридизации орбиталей у атомов углерода с пространственным строением аллотропных модификаций); селен и теллур цепочечного строения. Полимеры – сложные вещества с атомной кристаллической решеткой: кварц, кремнезем (диоксидные соединения кремния), корунд (оксид алюминия) и алюмосиликаты (полевые шпаты, слюда, каолин). Минералы и горные породы. Сера пластическая. Минеральное волокно – асбест. Значение неорганических природных полимеров в формировании одной из геологических оболочек Земли – литосферы.
Органические полимеры. Способы их получения: реакции полимеризации и реакции поликонденсации. Структуры полимеров: линейные, разветвленные и пространственные. Структурирование полимеров: вулканизация каучуков, дубление белков, отверждение поликонденсационных полимеров.
Классификация полимеров по различным признакам.
Демонстрации. Коллекции пластмасс, каучуков, волокон, минералов и горных пород. Минеральное волокно – асбест и изделия из него. Модели молекул белков, ДНК, РНК.
Лабораторные опыты. Ознакомление с образцами пластмасс, волокон, каучуков, минералов и горных пород. Проверка пластмасс на электрическую проводимость, горючесть, отношение к растворам кислот, щелочей и окислителей. Сравнение свойств термореактивных и термопластичных пластмасс. Получение нитей из капроновой или лавсановой смолы. Обнаружение хлора в поливинилхлориде.
Изучив раздел студент должен:
знать:
важнейшие химические понятия: полимер, мономер;
вещества и материалы, широко используемые в практике: графит, кварц, искусственные волокна, каучуки, пластмассы.
1.6. Дисперсные системы
Понятие о дисперсных системах. Классификация дисперсных систем в зависимости от агрегатного состояния дисперсионной среды и дисперсной фазы, а также по размеру их частиц. Грубодисперсные системы: эмульсии и суспензии. Тонкодисперсные системы: коллоидные (золи и гели) и истинные (молекулярные, молекулярно-ионные и ионные). Эффект Тиндаля. Коагуляция в коллоидных растворах. Синерезис в гелях.
Значение дисперсных систем в живой и неживой природе и практической жизни человека. Эмульсии и суспензии в строительстве, пищевой и медицинской промышленности, косметике. Биологические, медицинские и технологические золей. Значение гелей в организации живой материи. Биологические, пищевые, медицинские, косметические гели. Синерезис как фактор, определяющий срок годности продукции на основе гелей. Свертывание крови как биологический синерезис, его значение.
Демонстрации. Виды дисперсных систем и их характерные признаки. Прохождение луча света через коллоидные и истинные растворы (эффект Тиндаля).
Лабораторные опыты. Получение суспензии серы. Получение эмульсии растительного масла. Получение золя крахмала. Получение золя серы из тиосульфата натрия.
Изучив раздел студент должен:
знать:
важнейшие химические понятия: дисперсные системы, истинные растворы;
значение дисперсных систем в природе, медицине, строительстве.
1.7. Химические реакции
Классификация химических реакций в органической и неорганической химии. Понятие о химической реакции. Реакции, идущие без изменения качественного состава веществ: аллотропизация и изомеризация. Реакции, идущие с изменением состава веществ: по числу и характеру реагирующих и образующихся веществ (разложения, соединения, замещения, обмена); по изменению степеней окисления элементов (окислительно-восстановительные и не окислительно-восстановительные реакции); по тепловому эффекту (экзо- и эндотермические); по фазе (гомо- и гетерогенные); по направлению (обратимые и необратимые); по использованию катализатора (каталитические и некаталитические); по механизму (радикальные, молекулярные и ионные).
Вероятность протекания химических реакций. Внутренняя энергия, энтальпия. Тепловой эффект химических реакций. Термохимические уравнения. Стандартная энтальпия реакций и образования веществ. Закон Г.И. Гесса и его следствия. Энтропия.
Скорость химических реакций. Понятие о скорости реакций. Скорость гомо- и гетерогенной реакции. Энергия активации.
Факторы, влияющие на скорость химической реакции. Природа реагирующих веществ. Температура (закон Вант-Гоффа). Концентрация. Катализаторы и катализ: гомо- и гетерогенный, их механизмы. Ферменты, их сравнение с неорганическими катализаторами. Зависимость скорости реакций от поверхности соприкосновения реагирующих веществ.
Обратимость химических реакций. Химическое равновесие. Понятие о химическом равновесии. Равновесные концентрации. Динамичность химического равновесия. Факторы, влияющие на смещение равновесия: концентрация, давление, температура (принцип Ле Шателье).
Демонстрации. Модели бутана и изобутана. Получение кислорода из пероксида водорода и воды; дегидратация этанола. Реакции, идущие с образованием осадка, газа и воды; свойства металлов, окисление альдегида в кислоту и спирта в альдегид. Реакции горения; реакции эндотермические на примере реакции разложения и экзотермические на примере реакций соединения. Взаимодействие цинка с растворами соляной и серной кислот при разных температурах, разных концентрациях соляной кислоты; разложение пероксида кислорода с помощью оксида марганца(IV. Взаимодействие цинка различной поверхности (порошка, пыли, гранул) с кислотой. Смещение равновесия в системе: Fe3+ + 3 CNS- Fe(CNS)3; омыление жиров, реакции этерификации. Зависимость степени электролитической диссоциации уксусной кислоты от разбавления. Сравнение свойств 0,1 Н растворов серной и сернистой кислот; муравьиной и уксусной кислот; гидроксидов лития, натрия и калия.
Лабораторные опыты. Получение кислорода разложением пероксида водорода и(или) перманганата калия. Реакции, идущие с образованием осадка, газа или воды для органических и неорганических кислот.
Изучив раздел студент должен:
знать:
важнейшие химические понятия: аллотропия, скорость химической реакции, механизм реакции, катализ, тепловой эффект реакции, энтальпия, теплота образования, энтропия, химическое равновесие, константа равновесия, основные типы реакций в неорганической и органической химии;
основные законы химии: закон Гесса;
основные теории химии: химическую кинетику и химическую термодинамику.
Уметь:
1.8. Растворы
Понятие о растворах. Физико-химическая природа растворения и растворов. Взаимодействие растворителя и растворенного вещества. Растворимость веществ. Способы выражения концентрации растворов: массовая доля растворенного вещества (процентная), молярная.
Теория электролитической диссоциации. Механизм диссоциации веществ с различными типами химических связей. Вклад русских ученых в развитие представлений об электролитической диссоциации. Основные положения теории электролитической диссоциации. Степень электролитической диссоциации и факторы ее зависимости. Сильные и средние электролиты.
Диссоциация воды. Водородный показатель. Среда водных растворов электролитов. Реакции обмена в водных растворах электролитов.
Гидролиз как обменный процесс. Необратимый гидролиз органических и неорганических соединений и его значение в практической деятельности человека.
Обратимый гидролиз солей. Ступенчатый гидролиз. Практическое применение гидролиза.
Гидролиз органических веществ (белков, жиров, углеводов, полинуклеотидов, АТФ) и его биологическое и практическое значение. Омыление жиров. Реакция этерификации.
Демонстрации. Сравнение электропроводности растворов электролитов. Смещение равновесия диссоциации слабых кислот. Индикаторы и изменение их окраски в разных средах. Гидролиз карбонатов, сульфатов и силикатов щелочных металлов; нитратов свинца(II) или цинка, хлорида аммония.
Лабораторные опыты. Характер диссоциации различных гидроксидов.
Практическая работа. Приготовление растворов различных видов концентрации.
Изучив раздел студент должен:
знать:
важнейшие химические понятия: истинные растворы, электролитическая диссоциация, кислотно-оснóвные реакции в водных растворах, гидролиз, концентрация раствора.
Уметь:
определять: характер среды в водных растворах;
проводить расчеты: концентрации растворов;
готовить растворы различных видов концентрации .
1.9. Окислительно-восстановительные реакции. Электрохимические процессы
Окислительно-восстановительные реакции. Степень окисления. Восстановители и окислители. Окисление и восстановление. Важнейшие окислители и восстановители. Восстановительные свойства металлов – простых веществ. Окислительные и восстановительные свойства неметаллов – простых веществ. Восстановительные свойства веществ, образованных элементами в низшей (отрицательной) степени окисления. Окислительные свойства веществ, образованных элементами в высшей (положительной) степени окисления. Окислительные и восстановительные свойства веществ, образованных элементами в промежуточных степенях окисления.
Классификация окислительно-восстановительных реакций. Реакции межатомного и межмолекулярного окисления-восстановления. Реакции внутримолекулярного окисления-восстановления. Реакции самоокисления-самовосстановления (диспропорционирования).
Методы составления уравнений окислительно-восстановительных реакций. Метод электронного баланса. Влияние среды на протекание окислительно-восстановительных процессов.
Химические источники тока. Электродные потенциалы. Ряд стандартных электродных потенциалов (электрохимический ряд напряжений металлов). Гальванические элементы и принципы их работы. Составление гальванических элементов. Образование гальванических пар при химических процессах. Гальванические элементы, применяемые в жизни: свинцовая аккумуляторная батарея, никель-кадмиевые батареи, топливные элементы.
Электролиз расплавов и водных растворов электролитов. Процессы, происходящие на катоде и аноде. Уравнения электрохимических процессов. Электролиз водных растворов с инертными электродами. Электролиз водных растворов с растворимыми электродами. Практическое применение электролиза.
Демонстрации. Восстановление оксида меди(II) углем и водородом. Окислительные свойства азотной кислоты. Окислительные свойства дихромата калия. Гальванические элементы и батарейки. Электролиз раствора хлорида меди(II).
Лабораторные опыты. Взаимодействие металлов с неметаллами, с растворами солей и растворами кислот. Взаимодействие серной и азотной кислот с медью. Окислительные свойства перманганата калия в различных средах.
Изучив раздел студент должен:
знать:
Уметь:
1.10. Классификация веществ. Простые вещества
Классификация неорганических веществ. Простые и сложные вещества. Оксиды, их классификация. Гидроксиды (основания, кислородсодержащие кислоты, амфотерные гидроксиды). Кислоты, их классификация. Основания, их классификация. Соли средние, кислые, оснóвные и комплексные.
Металлы. Положение металлов в Периодической системе и особенности строения их атомов. Простые вещества – металлы: строение кристаллов и металлическая химическая связь. Общие физические свойства металлов и их восстановительные свойства: взаимодействие с неметаллами (кислородом, галогенами, серой, азотом, водородом), водой, кислотами, растворами солей, органическими веществами (спиртами, галогеналканами, фенолом, кислотами), со щелочами. Оксиды и гидроксиды металлов. Зависимость свойств этих соединений от степеней окисления металлов. Значение металлов в природе и жизни организмов.
Коррозия металлов. Понятие коррозии. Химическая коррозия. Электрохимическая коррозия. Способы защиты металлов от коррозии.
Общие способы получения металлов. Металлы в природе. Металлургия и ее виды: пиро-, гидро- и электрометаллургия. Электролиз расплавов и растворов соединений металлов и его практическое значение.
Неметаллы. Положение неметаллов в периодической системе, особенности строения их атомов. Электроотрицательность.
Благородные газы. Электронное строение атомов благородных газов и особенности их химических и физических свойств.
Неметаллы – простые вещества. Атомное и молекулярное их строение. Аллотропия. Химические свойства неметаллов. Окислительные свойства: взаимодействие с металлами, водородом, менее электроотрицательными неметаллами, некоторыми сложными веществами. Восстановительные свойства неметаллов в реакциях с фтором, кислородом, сложными веществами-окислителями (азотной и серной кислотами и др.).
Демонстрации. Коллекция «Классификация неорганических веществ» и образцы представителей классов. Коллекция «Классификация органических веществ» и образцы представителей классов. Модели кристаллических решеток металлов. Коллекция металлов с разными физическими свойствами. Взаимодействие лития, натрия, магния и железа с кислородом; щелочных металлов с водой, спиртами; цинка с растворами соляной и серной кислот; натрия с серой; алюминия с иодом; железа с раствором медного купороса. Коррозия металлов в зависимости от условий. Защита металлов от коррозии: образцы «нержавеек», защитных покрытий. Коллекция руд. Электролиз растворов солей. Модели кристаллических решеток иода, алмаза, графита. Аллотропия фосфора, серы, кислорода. Взаимодействие водорода с кислородом; хлорной и сероводородной воды; обесцвечивание бромной воды этиленом или ацетиленом.
Лабораторные опыты. Ознакомление с образцами представителей классов неорганических веществ. Ознакомление с образцами представителей классов органических веществ. Ознакомление с коллекцией руд.
Получение и свойства кислорода. Получение и свойства водорода. Получение пластической серы, химические свойства серы. Взаимодействие металлов с растворами кислот и солей. Свойства угля: адсорбционные, восстановительные. Взаимодействие цинка или алюминия с растворами кислот и щелочей. Окрашивание пламени катионами щелочных и щелочноземельных металлов.
Изучив раздел студент должен:
знать:
классификацию и номенклатуру неорганических соединений;
вещества и материалы, широко используемые в практике: основные металлы и сплавы.
Уметь:
называть: изученные вещества по правилам номенклатуры;
характеризовать: общие химические свойства металлов, неметаллов;
объяснять: зависимость свойств химического элемента и образованных им веществ от положения в Периодической системе Д.И. Менделеева.
1.11. Основные классы неорганических и органических соединений
Водородные соединения неметаллов. Получение аммиака и хлороводорода синтезом и косвенно. Физические свойства. Отношение к воде: кислотно-основные свойства.
Оксиды и ангидриды карбоновых кислот. Несолеобразующие и солеобразующие оксиды. Кислотные оксиды, их свойства. Оснóвные оксиды, их свойства. Амфотерные оксиды, их свойства. Зависимость свойств оксидов металлов от степени окисления. Ангидриды карбоновых кислот как аналоги кислотных оксидов.
Кислоты органические и неорганические. Кислоты в свете теории электролитической диссоциации. Кислоты в свете протолитической теории. Классификация органических и неорганических кислот. Общие свойства кислот: взаимодействие органических и неорганических кислот с металлами, оснóвными и амфотерными оксидами и гидроксидами, с солями, образование сложных эфиров. Особенности свойств концентрированной серной и азотной кислот.
Основания органические и неорганические. Основания в свете теории электролитической диссоциации. Основания в свете протолитической теории. Классификация органических и неорганических оснований. Химические свойства щелочей и нерастворимых оснований. Свойства бескислородных оснований: аммиака и аминов. Взаимное влияние атомов в молекуле анилина.
Амфотерные органические и неорганические соединения. Амфотерные основания в свете протолитической теории. Амфотерность оксидов и гидроксидов переходных металлов: взаимодействие с кислотами и щелочами.
Соли. Классификация и химические свойства солей. Особенности свойств солей органических и неорганических кислот.
Генетическая связь между классами органических и неорганических соединений. Понятие о генетической связи и генетических рядах в неорганической и органической химии. Генетические ряды металла (на примере кальция и железа), неметалла (серы и кремния), переходного элемента (цинка). Генетические ряды и генетическая связь в органической химии. Единство мира веществ.
Демонстрации. Коллекции кислотных, оснóвных и амфотерных оксидов, демонстрация их свойств. Взаимодействие концентрированных азотной и серной кислот, а также разбавленной азотной кислоты с медью. Реакция «серебряного зеркала» для муравьиной кислоты. Взаимодействие раствора гидроксида натрия с кислотными оксидами, амфотерными гидроксидами. Взаимодействие аммиака с хлороводородом и водой. Взаимодействие аминокислот с кислотами и щелочами. Осуществление переходов:
Са СаО Са3(РО4)2 Са(ОН)2
Р Р2О5 Н3РО4
Сu CuO CuSO4 Cu(OH)2 CuO Cu
C2H5OH C2H4 C2H4Br2
Лабораторные опыты. Получение и свойства углекислого газа. Свойства соляной, серной (разбавленной) и уксусной кислот. Взаимодействие гидроксида натрия с солями (сульфатом меди(II) и хлоридом аммония). Разложение гидроксида меди. Получение и амфотерные свойства гидроксида алюминия. Получение жесткой воды и изучение ее свойств. Устранение временной и постоянной жесткости.
Практическая работа. Получение хлороводорода и соляной кислоты, их свойства. Получение аммиака, его свойства.
Изучив раздел студент должен:
знать:
Уметь:
называть: изученные вещества по «тривиальной» или международной номенклатурам;
определять: принадлежность веществ к разным классам неорганических и органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в неорганической и органической химии;
характеризовать: общие химические свойства основных классов неорганических и органических соединений;
выполнять химический эксперимент по распознаванию важнейших неорганических и органических веществ, получению конкретных веществ, относящихся к изученным классам соединений;
проводить расчеты по химическим формулам и уравнениям реакций.
1.12. Химия элементов
s-Элементы.
Водород. Двойственное положение водорода в Периодической системе. Изотопы водорода. Тяжелая вода. Окислительные и восстановительные свойства водорода, его получение и применение. Роль водорода в живой и неживой природе.
Вода. Роль воды как средообразующего вещества клетки. Экологические аспекты водопользования.
Элементы IА-группы. Щелочные металлы. Общая характеристика щелочных металлов на основании положения в Периодической системе элементов Д.И. Менделеева и строения атомов. Получение, физические и химические свойства щелочных металлов. Катионы щелочных металлов как важнейшая химическая форма их существования, регулятивная роль катионов калия и натрия в живой клетке. Природные соединения натрия и калия, их значение.
Элементы IIА-группы. Общая характеристика щелочноземельных металлов и магния на основании положения в Периодической системе элементов Д.И. Менделеева и строения атомов. Кальций, его получение, физические и химические свойства. Важнейшие соединения кальция, их значение и применение. Кальций в природе, его биологическая роль.
р-Элементы.
Алюминий. Характеристика алюминия на основании положения в Периодической системе элементов Д.И.Менделеева и строения атома. Получение, физические и химические свойства алюминия. Важнейшие соединения алюминия, их свойства, значение и применение. Природные соединения алюминия.
Углерод и кремний. Общая характеристика на основании их положения в Периодической системе Д.И. Менделеева и строения атома. Простые вещества, образованные этими элементами. Оксиды и гидроксиды углерода и кремния. Важнейшие соли угольной и кремниевой кислот. Силикатная промышленность.
Галогены. Общая характеристика галогенов на основании их положения в Периодической системе элементов Д.И.Менделеева и строения атомов. Галогены – простые вещества: строение молекул, химические свойства, получение и применение. Важнейшие соединения галогенов, их свойства, значение и применение. Галогены в природе. Биологическая роль галогенов.
Халькогены. Общая характеристика халькогенов на основании их положения в Периодической системе элементов Д.И. Менделеева и строения атомов. Халькогены – простые вещества. Аллотропия. Строение молекул аллотропных модификаций и их свойства. Получение и применение кислорода и серы. Халькогены в природе, их биологическая роль.
Элементы VА-группы. Общая характеристика элементов этой группы на основании их положения в Периодической системе элементов Д.И. Менделеева и строения атомов. Строение молекулы азота и аллотропных модификаций фосфора, их физические и химические свойства. Водородные соединения элементов VА-группы. Оксиды азота и фосфора, соответствующие им кислоты. Соли этих кислот. Свойства кислородных соединений азота и фосфора, их значение и применение. Азот и фосфор в природе, их биологическая роль.
Элементы IVА-группы. Общая характеристика элементов этой группы на основании их положения в Периодической системе элементов Д.И. Менделеева и строения атомов. Углерод и его аллотропия. Свойства аллотропных модификаций углерода, их значение и применение. Оксиды и гидроксиды углерода и кремния, их химические свойства. Соли угольной и кремниевых кислот, их значение и применение. Природообразующая роль углерода для живой и кремния – для неживой природы.
d-Элементы.
Особенности строения атомов d-элементов (IB-VIIIB-групп). Медь, цинк, хром, железо, марганец как простые вещества, их физические и химические свойства. Нахождение этих металлов в природе, их получение и значение. Соединения d-элементов с различными степенями окисления. Характер оксидов и гидроксидов этих элементов в зависимости от степени окисления металла.
Демонстрации. Коллекции простых веществ, образованных элементами различных электронных семейств. Коллекции минералов и горных пород. Получение аллотропных модификаций. Химические свойства водорода, кислорода, серы, фосфора, галогенов, углерода.
Оксиды серы, азота, углерода, железа, марганца, меди с различными степенями окисления, их свойства.
Гидроксиды серы, хрома, марганца, железа, меди, алюминия и цинка, их получение и химические свойства.
Лабораторные опыты. Изучение свойств простых веществ и соединений s-элементов.
Изучение свойств простых веществ и соединений р-элементов.
Изучение свойств простых веществ и соединений d-элементов.
Практическая работа. Получение гидроксидов алюминия и цинка и исследование их свойств. Получение и исследование свойств оксидов серы, углерода, фосфора.
Изучив раздел студент должен:
знать:
классификацию и номенклатуру неорганических соединений;
вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, минеральные удобрения, минеральные кислоты, щелочи, аммиак.
Уметь:
называть: изученные вещества;
определять: принадлежность веществ к разным классам неорганических соединений; типы реакций в неорганической химии;
характеризовать: общие химические свойства основных классов неорганических соединений;
объяснять: зависимость свойств неорганических веществ от их состава и строения;
выполнять химический эксперимент по распознаванию важнейших неорганических веществ, получению конкретных веществ, относящихся к изученным классам соединений;
проводить расчеты по химическим формулам и уравнениям реакций;
1.13. Химия в жизни общества
Химия и производство. Химическая промышленность и химические технологии. Сырье для химической промышленности. Вода в химической промышленности. Энергия для химического производства. Научные принципы химического производства. Защита окружающей среды и охрана труда при химическом производстве. Основные стадии химического производства. Сравнение производства аммиака и метанола.
Химия в сельском хозяйстве. Химизация сельского хозяйства и ее направления. Растения и почва, почвенный поглощающий комплекс. Удобрения и их классификация. Химические средства защиты растений. Отрицательные последствия применения пестицидов и борьба с ними. Химизация животноводства.
Химия и экология. Химическое загрязнение окружающей среды. Охрана гидросферы от химического загрязнения. Охрана почвы от химического загрязнения. Охрана атмосферы от химического загрязнения. Охрана флоры и фауны от химического загрязнения. Биотехнология и генная инженерия.
Химия и повседневная жизнь человека. Домашняя аптека. Моющие и чистящие средства. Средства борьбы с бытовыми насекомыми. Средства личной гигиены и косметики. Химия и пища. Маркировка упаковка пищевых и гигиенических продуктов и умение их читать. Экология жилища. Химия и генетика человека.
Демонстрации. Модели производства серной кислоты и аммиака. Коллекция удобрений и пестицидов. Образцы средств бытовой химии и лекарственных препаратов.
Лабораторные опыты. Ознакомление с коллекцией удобрений и пестицидов. Ознакомление с образцами средств бытовой химии и лекарственных препаратов.
Изучив раздел студент должен:
знать:
роль химии в естествознании и ее значение в жизни современного общества;
вещества и материалы, широко используемые в практике: основные металлы и сплавы, графит, кварц, минеральные удобрения, минеральные и органические кислоты, щелочи, аммиак, углеводороды, фенол, анилин, метанол, этанол, этиленгликоль, глицерин, формальдегид, ацетальдегид, ацетон, глюкоза, сахароза, крахмал, клетчатка, аминокислоты, белки, искусственные волокна, каучуки, пластмассы, жиры, мыла и моющие средства.
Уметь:
использовать приобретенные знания и умения в практической деятельности и повседневной жизни:
для понимания глобальных проблем, стоящих перед человечеством: экологических, энергетических и сырьевых;
объяснения химических явлений, происходящих в природе, быту и на производстве;
экологически грамотного поведения в окружающей среде;
оценки влияния химического загрязнения окружающей среды на организм человека и другие живые организмы;
безопасной работы с веществами в лаборатории, быту и на производстве;
определения возможности протекания химических превращений в различных условиях и оценки их последствий;
распознавания и идентификации важнейших веществ и материалов;
оценки качества питьевой воды и отдельных пищевых продуктов;
критической оценки достоверности химической информации, поступающей из различных источников.
Раздел 2
Органическая химия
2.1. Предмет органической химии. Теория строения органических соединений
Предмет органической химии. Понятие об органическом веществе и органической химии. Краткий очерк истории развития органической химии. Витализм и его крушение. Особенности строения органических соединений. Круговорот углерода в природе.
Теория строения органических соединений А.М. Бутлерова. Предпосылки создания теории строения. Основные положения теории строения А.М.Бутлерова. Химическое строение и свойства органических веществ. Понятие об изомерии. Способы отображения строения молекулы (формулы, модели). Значение теории А.М. Бутлерова для развития органической химии и химических прогнозов.
Строение атома углерода. Электронное облако и орбиталь,
s- и
р-орбитали. Электронные и электронно-графические формулы атома углерода в основном и возбужденном состояниях. Ковалентная химическая связь и ее классификация по способу перекрывания орбиталей (- и -связи). Понятие гибридизации. Различные типы гибридизации и форма атомных орбиталей, взаимное отталкивание гибридных орбиталей и их расположение в пространстве в соответствии с минимумом энергии. Геометрия молекул веществ, образованных атомами углерода в различных состояниях гибридизации.
Классификация органических соединений. Классификация органических веществ в зависимости от строения углеродной цепи. Понятие функциональной группы. Классификация органических веществ по типу функциональной группы.
Основы номенклатуры органических веществ. Тривиальные названия. Рациональная номенклатура как предшественница номенклатуры IUPAC. Номенклатура IUPAC: принципы образования названий, старшинство функциональных групп, их обозначение в префиксах и суффиксах названий органических веществ.
Типы химических связей в органических соединениях и способы их разрыва. Классификация ковалентных связей по электроотрицательности связанных атомов, способу перекрывания орбиталей, кратности, механизму образования. Связь природы химической связи с типом кристаллической решетки вещества и его физическими свойствами. Разрыв химической связи, как процесс, обратный ее образованию. Гомолитический и гетеролитический разрывы связей, их сопоставление с обменным и донорно-акцепторным механизмами их образования. Понятие свободного радикала, нуклеофильной и электрофильной частицы.
Классификация реакций в органической химии. Понятие о типах и механизмах реакций в органической химии. Субстрат и реагент. Классификация реакций по изменению в структуре субстрата (присоединение, отщепление, замещение, изомеризация) и типу реагента (радикальные, нуклеофильные, электрофильные). Реакции присоединения (АN, АЕ), элиминирования (Е), замещения (SR, SN, SE), изомеризации. Разновидности реакций каждого типа: гидрирование и дегидрирование, галогенирование и дегалогенирование, гидратация и дегидратация, гидрогалогенирование и дегидрогалогенирование, полимеризация и поликонденсация, перегруппировка. Особенности окислительно-восстановительных реакций в органической химии.
Современные представления о химическом строении органических веществ. Основные направления развития теории строения А.М. Бутлерова. Изомерия органических веществ и ее виды. Структурная изомерия: межклассовая, углеродного скелета, положения кратной связи и функциональной группы. Пространственная изомерия: геометрическая и оптическая. Понятие асимметрического центра. Биологическое значение оптической изомерии. Взаимное влияние атомов в молекулах органических веществ. Электронные эффекты атомов и атомных групп в органических молекулах. Индукционный эффект, положительный и отрицательный, его особенности. Мезомерный эффект (эффект сопряжения), его особенности.
Демонстрации. Коллекции органических веществ (в том числе лекарственных препаратов, красителей), материалов (природных и синтетических каучуков, пластмасс и волокон) и изделий из них (нити, ткани, отделочные материалы).
Модели молекул СН4, С2Н4, С2Н2, С6Н6, СН3ОН – шаростержневые и объемные. Модели отталкивания гибридных орбиталей с помощью воздушных шаров.
Взаимодействие натрия с этанолом и отсутствие взаимодействия с диэтиловым эфиром.
Опыты, подтверждающие наличие функциональных групп у соединений различных классов.
Лабораторные опыты. Изготовление моделей молекул – представителей различных классов органических соединений.
Практические работы. Обнаружение углерода и водорода в органическом соединении. Обнаружение галогенов (проба Бейльштейна).
Изучив раздел студент должен:
знать:
важнейшие химические понятия: пространственное строение молекул, углеродный скелет, функциональная группа, гомология, структурная и пространственная изомерия, индуктивный и мезомерный эффекты, электрофил, нуклеофил, основные типы реакций в органической химии;
основные теории химии; строения органических соединений;
классификацию и номенклатуру органических соединений.
Уметь:
определять: изомеры и гомологи, принадлежность веществ к разным классам органических соединений; характер взаимного влияния атомов в молекулах, типы реакций в органической химии;
объяснять: зависимость реакционной способности органических соединений от строения их молекул.
2.2. Предельные углеводороды
Гомологический ряд алканов. Понятие об углеводородах. Особенности строения предельных углеводородов. Алканы как представители предельных углеводородов. Электронное и пространственное строение молекулы метана и других алканов. Гомологический ряд и изомерия парафинов. Нормальное и разветвленное строение углеродной цепи. Номенклатура алканов и алкильных заместителей. Физические свойства алканов. Алканы в природе.
Химические свойства алканов. Реакции SR-типа: галогенирование (работы Н.Н. Семенова), нитрование по Коновалову. Механизм реакции хлорирования алканов. Реакции дегидрирования, горения, каталитического окисления алканов. Крекинг алканов, различные виды крекинга, применение в промышленности. Пиролиз и конверсия метана, изомеризация алканов.
Применение и способы получения алканов. Области применения алканов. Промышленные способы получения алканов: получение из природных источников, крекинг парафинов, получение синтетического бензина, газификация угля, гидрирование алкенов. Лабораторные способы получения алканов: синтез Вюрца, декарбоксилирование, гидролиз карбида алюминия.
Циклоалканы. Гомологический ряд и номенклатура циклоалканов, их общая формула. Понятие о напряжении цикла. Изомерия циклоалканов: межклассовая, углеродного скелета, геометрическая. Получение и физические свойства циклоалканов. Химические свойства циклоалканов. Специфика свойств циклоалканов с малым размером цикла. Реакции присоединения и радикального замещения.
Демонстрации. Модели молекул метана, других алканов, различных конформаций циклогексана. Растворение парафина в бензине и испарение растворителя из смеси. Плавление парафина и его отношение к воде (растворимость, плотность, смачивание). Разделение смеси бензин–вода с помощью делительной воронки. Горение метана, парафина в условиях избытка и недостатка кислорода. Восстановление оксидов тяжелых металлов парафином. Отношение циклогексана к бромной воде и раствору перманганата калия.
Лабораторные опыты. Изготовление моделей молекул алканов и галогеналканов. Изготовление парафинированной бумаги, испытание ее свойств: отношение к воде и жирам. Обнаружение воды, сажи, углекислого газа в продуктах горения свечи. Ознакомление со свойствами твердых парафинов: плавление, растворимость в воде и органических растворителях, химическая инертность (отсутствие взаимодействия с бромной водой, растворами перманганата калия, гидроксида натрия и серной кислоты).
Практическая работа. Получение метана и изучение его свойств: горение, отношение к бромной воде и раствору перманганата калия.
Изучив раздел студент должен:
знать:
Уметь:
называть: предельные углеводороды по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи; характер взаимного влияния атомов в молекулах предельных углеводородов;
характеризовать: строение предельных углеводородов; их общие химические свойства;
объяснять: зависимость реакционной способности предельных углеводородов от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших предельных углеводородов;
проводить расчеты по химическим формулам и уравнениям реакций.
2.3. Этиленовые и диеновые углеводороды
Гомологический ряд алкенов. Электронное и пространственное строение молекулы этилена и алкенов. Гомологический ряд и общая формула алкенов. Изомерия этиленовых углеводородов: межклассовая, углеродного скелета, положения кратной связи, геометрическая. Особенности номенклатуры этиленовых углеводородов, названия важнейших радикалов. Физические свойства алкенов.
Химические свойства алкенов. Электрофильный характер реакций, склонность к реакциям присоединения, окисления, полимеризации. Правило Марковникова и его электронное обоснование. Реакции галогенирования, гидрогалогенирования, гидратации, гидрирования. Механизм AE-реакций. Понятие о реакциях полимеризации. Горение алкенов. Реакции окисления в мягких и жестких условиях. Реакция Вагнера и ее значения для обнаружения непредельных углеводородов, получения гликолей.
Применение и способы получения алкенов. Использование высокой реакционной способности алкенов в химической промышленности. Применение этилена и пропилена. Промышленные способы получения алкенов. Реакции дегидрирования и крекинга алканов. Лабораторные способы получения алкенов.
Алкадиены. Понятие и классификация диеновых углеводородов по взаимному расположению кратных связей в молекуле. Особенности электронного и пространственного строения сопряженных диенов. Понятие о -электронной системе. Номенклатура диеновых углеводородов. Особенности химических свойств сопряженных диенов, как следствие их электронного строения. Реакции 1,4-присоединения. Полимеризация диенов. Способы получения диеновых углеводородов: работы С.В. Лебедева, дегидрирование алканов.
Основные понятия химии высокомолекулярных соединений на примере продуктов полимеризации алкенов, алкадиенов и их галогенпроизводных. Мономер, полимер, реакция полимеризации, степень полимеризации, структурное звено. Типы полимерных цепей: линейные, разветвленные, сшитые. Понятие о стереорегулярных полимерах. Полимеры термопластичные и термореактивные. Представление о пластмассах и эластомерах. Полиэтилен высокого и низкого давления, его свойства и применение. Катализаторы Циглера–Натта. Полипропилен, его применение и свойства. Галогенсодержащие полимеры: тефлон, поливинилхлорид. Каучуки натуральный и синтетические. Сополимеры (бутадиенстирольный каучук). Вулканизация каучука, резина и эбонит.
Демонстрации. Модели молекул структурных и пространственных изомеров алкенов и алкадиенов. Коллекция «Каучук и резина».
Лабораторные опыты. Обнаружение непредельных соединений в керосине, скипидаре. Ознакомление с образцами полиэтилена и полипропилена. Распознавание образцов алканов и алкенов.
Практическая работа. Получение этилена дегидратацией этилового спирта. Взаимодействие этилена с бромной водой, раствором перманганата калия. Сравнение пламени этилена с пламенем предельных углеводородов (метана, пропан-бутановой смеси).
Изучив раздел студент должен:
знать:
Уметь:
называть: изученные непредельные углеводороды по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, принадлежность веществ к разным классам непредельных углеводородов; характер взаимного влияния атомов в молекулах;
характеризовать: общие химические свойства непредельных углеводородов;
объяснять: зависимость реакционной способности непредельных углеводородов от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших непредельных углеводородов, получению конкретных веществ, относящихся к непредельным углеводородам;
проводить расчеты по химическим формулам и уравнениям реакций.
2.4. Ацетиленовые углеводороды
Гомологический ряд алкинов. Электронное и пространственное строение ацетилена и других алкинов. Гомологический ряд и общая формула алкинов. Номенклатура ацетиленовых углеводородов. Изомерия межклассовая, углеродного скелета, положения кратной связи.
Химические свойства и применение алкинов. Особенности реакций присоединения по тройной углерод-углеродной связи. Реакция Кучерова. Правило Марковникова применительно к ацетиленам. Подвижность атома водорода (кислотные свойства алкинов). Окисление алкинов. Реакция Зелинского. Применение ацетиленовых углеводородов. Поливинилацетат.
Получение алкинов. Получение ацетилена пиролизом метана и карбидным методом.
Демонстрации. Модели молекулы ацетилена и других алкинов. Получение ацетилена из карбида кальция, ознакомление с физическими и химическими свойствами ацетилена: растворимость в воде, горение, взаимодействие с бромной водой, раствором перманганата калия, солями меди(I) и серебра.
Лабораторные опыты. Изготовление моделей молекул алкинов, их изомеров.
Изучив раздел студент должен:
знать:
Уметь:
называть: изученные ацетиленовые углеводороды по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, характер взаимного влияния атомов в молекулах;
характеризовать: общие химические свойства ацетиленовых углеводородов;
объяснять: зависимость реакционной способности ацетиленовых углеводородов от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших ацетиленовых углеводородов, получению конкретных веществ, относящихся к ацетиленовым углеводородам;
проводить расчеты по химическим формулам и уравнениям реакций;
2.5. Ароматические углеводороды
Гомологический ряд аренов. Бензол как представитель аренов. Развитие представлений о строении бензола. Современные представления об электронном и пространственном строении бензола. Образование ароматической -системы. Гомологи бензола, их номенклатура, общая формула. Номенклатура для дизамещенных производных бензола: орто-, мета-, пара-расположение заместителей. Физические свойства аренов.
Химические свойства аренов. Примеры реакций электрофильного замещения: галогенирование, алкилирование (катализаторы Фриделя–Крафтса), нитрование, сульфирование. Реакции гидрирования и присоединения хлора к бензолу. Особенности химических свойств гомологов бензола. Взаимное влияние атомов на примере гомологов аренов. Ориентация в реакциях электрофильного замещения. Ориентанты I и II рода.
Применение и получение аренов. Природные источники ароматических углеводородов. Ароматизация алканов и циклоалканов. Алкилирование бензола.
Демонстрации. Шаростержневые и объемные модели молекул бензола и его гомологов. Разделение смеси бензол–вода с помощью делительной воронки. Растворяющая способность бензола. Отношение бензола к бромной воде, раствору перманганата калия. Получение нитробензола.
Изготовление и использование простейшего прибора для хроматографии.
Изучив раздел студент должен:
знать:
Уметь:
называть: изученные ароматические углеводороды по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, принадлежность веществ к ароматическим углеводородам; характер взаимного влияния атомов в молекулах;
характеризовать: общие химические свойства ароматических углеводородов;
объяснять: зависимость реакционной способности ароматических углеводородов от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших ароматических углеводородов, получению конкретных веществ, относящихся к ароматическим углеводородам;
проводить расчеты по химическим формулам и уравнениям реакций;
2.6. Природные источники углеводородов
Нефть. Нахождение в природе, состав и физические свойства нефти. Топливно-энергетическое значение нефти. Промышленная переработка нефти. Ректификация нефти, основные фракции ее разделения, их использование. Вторичная переработка нефтепродуктов. Ректификация мазута при уменьшенном давлении. Крекинг нефтепродуктов. Различные виды крекинга, работы В.Г. Шухова. Изомеризация алканов. Алкилирование непредельных углеводородов. Риформинг нефтепродуктов. Качество автомобильного топлива. Октановое число.
Природный и попутный нефтяной газ. Сравнение состава природного и попутного газов, их практическое использование.
Каменный уголь. Основные направления использования каменного угля. Коксование каменного угля, важнейшие продукты этого процесса: кокс, каменноугольная смола, надсмольная вода. Соединения, выделяемые из каменноугольной смолы. Продукты, получаемые из надсмольной воды.
Экологические аспекты добычи, переработки и использования горючих ископаемых.
Демонстрации. Коллекция «Природные источники углеводородов». Сравнение процессов горения нефти и природного газа. Образование нефтяной пленки на поверхности воды. Каталитический крекинг парафина (или керосина).
Лабораторные опыты. Определение наличия непредельных углеводородов в бензине и керосине. Растворимость различных нефтепродуктов (бензин, керосин, дизельное топливо, вазелин, парафин) друг в друге.
Изучив раздел студент должен:
знать:
2.7. Гидроксильные соединения
Строение и классификация спиртов. Классификация спиртов по типу углеводородного радикала, числу гидроксильных групп и типу атома углерода, связанного с гидроксильной группой. Электронное и пространственное строение гидроксильной группы. Влияние строения спиртов на их физические свойства. Межмолекулярная водородная связь. Гомологический ряд предельных одноатомных спиртов. Изомерия и номенклатура алканолов, их общая формула.
Химические свойства алканолов. Реакционная способность предельных одноатомных спиртов. Сравнение кислотно-оснóвных свойств органических и неорганических соединений, содержащих ОН-группу: кислот, оснований, амфотерных соединений (воды, спиртов). Реакции, подтверждающие кислотные свойства спиртов. Реакции замещения гидроксильной группы. Межмолекулярная дегидратация спиртов, условия образования простых эфиров. Сложные эфиры неорганических и органических кислот, реакции этерификации. Окисление и окислительное дегидрирование спиртов.
Способы получения спиртов. Гидролиз галогеналканов. Гидратация алкенов, условия ее проведения. Восстановление карбонильных соединений.
Отдельные представители алканолов. Метанол, его промышленное получение и применение в промышленности. Биологическое действие метанола. Специфические способы получения этилового спирта. Физиологическое действие этанола.
Многоатомные спирты. Изомерия и номенклатура представителей двух- и трехатомных спиртов. Особенности химических свойств многоатомных спиртов, их качественное обнаружение. Отдельные представители: этиленгликоль, глицерин, способы их получения, практическое применение.
Фенол. Электронное и пространственное строение фенола. Взаимное влияние ароматического кольца и гидроксильной группы.
Химические свойства фенола как функция его химического строения. Бромирование фенола (качественная реакция), нитрование (пикриновая кислота, ее свойства и применение). Образование окрашенных комплексов с ионом Fe3+. Применение фенола. Получение фенола в промышленности.
Демонстрации. Модели молекул спиртов и фенолов. Растворимость в воде алканолов, этиленгликоля, глицерина. Сравнение скорости взаимодействия натрия с этанолом, пропанолом-2, 2-метилпропанолом-2, глицерином. Получение бромэтана из этанола. Качественные реакции на фенол. Распознавание водных растворов фенола и глицерина.
Лабораторные опыты. Ректификация смеси этанол–вода. Обнаружение воды в азеотропной смеси воды и этилового спирта.
Практическая работа. Изучение растворимости спиртов в воде. Окисление спиртов различного строения. Получение диэтилового эфира. Получение глицерата меди.
Изучив раздел студент должен:
знать:
классификацию и номенклатуру гидроксильных соединений;
вещества и материалы, широко используемые в практике: фенол, метанол, этанол, этиленгликоль, глицерин.
Уметь:
называть: изученные вещества по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, принадлежность веществ к разным классам гидроксильных соединений; характер взаимного влияния атомов в их молекулах;
характеризовать: общие химические свойства гидроксильных соединений; их строение;
объяснять: зависимость реакционной способности гидроксильных соединений от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших гидроксильных соединений, получению конкретных веществ, относящихся к изученным классам гидроксильных соединений;
проводить расчеты по химическим формулам и уравнениям реакций.
2.8. Альдегиды и кетоны
Гомологические ряды альдегидов и кетонов. Понятие о карбонильных соединениях. Электронное строение карбонильной группы. Изомерия и номенклатура альдегидов и кетонов. Физические свойства карбонильных соединений.
Химические свойства альдегидов и кетонов. Реакционная способность карбонильных соединений. Реакции окисления альдегидов, качественные реакции на альдегидную группу. Реакции поликонденсации: образование фенолоформальдегидных смол.
Применение и получение карбонильных соединений. Применение альдегидов и кетонов в быту и промышленности. Альдегиды и кетоны в природе (эфирные масла, феромоны). Получение карбонильных соединений окислением спиртов, гидратацией алкинов, окислением углеводородов. Отдельные представители альдегидов и кетонов, специфические способы их получения и свойства.
Демонстрации. Шаростержневые и объемные модели молекул альдегидов и кетонов. Получение уксусного альдегида окислением этанола. Качественные реакции на альдегидную группу.
Лабораторные опыты. Окисление этанола в этаналь.
Практическая работа. Изучение восстановительных свойств альдегидов: реакция «серебряного зеркала», восстановление гидроксида меди(II).
Изучив раздел студент должен:
знать:
классификацию и номенклатуру карбонильных соединений;
вещества и материалы, широко используемые в практике: формальдегид, ацетальдегид, ацетон.
Уметь:
называть: изученные вещества по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, принадлежность веществ к разным классам карбонильных соединений; характер взаимного влияния атомов в молекулах, типы реакций органической химии;
характеризовать: общие химические свойства карбонильных соединений; строение и свойства (альдегидов и кетонов;
объяснять: зависимость реакционной способности карбонильных соединений от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших карбонильных соединений, получению конкретных веществ, относящихся к карбонильным соединениям;
проводить расчеты по химическим формулам и уравнениям реакций.
2.9. Карбоновые кислоты и их производные
Гомологический ряд предельных одноосновных карбоновых кислот. Понятие о карбоновых кислотах и их классификация. Электронное и пространственное строение карбоксильной группы. Гомологический ряд предельных одноосновных карбоновых кислот, их номенклатура и изомерия. Межмолекулярные водородные связи карбоксильных групп, их влияние на физические свойства карбоновых кислот.
Химические свойства карбоновых кислот. Реакции, иллюстрирующие кислотные свойства и их сравнение со свойствами неорганических кислот. Образование функциональных производных карбоновых кислот. Реакции этерификации. Ангидриды карбоновых кислот, их получение и применение.
Способы получения карбоновых кислот. Отдельные представители и их значение. Общие способы получения: окисление алканов, алкенов, первичных спиртов, альдегидов. Важнейшие представители карбоновых кислот, их биологическая роль, специфические способы получения, свойства и применение муравьиной, уксусной, пальмитиновой и стеариновой; акриловой и метакриловой; олеиновой, линолевой и линоленовой; щавелевой; бензойной кислот.
Сложные эфиры. Строение и номенклатура сложных эфиров, межклассовая изомерия с карбоновыми кислотами. Способы получения сложных эфиров. Обратимость реакции этерификации и факторы, влияющие на смещение равновесия. Образование сложных полиэфиров. Полиэтилентерефталат. Лавсан как представитель синтетических волокон. Химические свойства и применение сложных эфиров.
Жиры. Жиры как сложные эфиры глицерина. Карбоновые кислоты, входящие в состав жиров. Зависимость консистенции жиров от их состава. Химические свойства жиров: гидролиз, омыление, гидрирование. Биологическая роль жиров, их использование в быту и промышленности.
Соли карбоновых кислот. Мыла. Способы получения солей: взаимодействие карбоновых кислот с металлами, основными оксидами, основаниями, солями; щелочной гидролиз сложных эфиров. Химические свойства солей карбоновых кислот: гидролиз, реакции ионного обмена. Мыла, сущность моющего действия. Отношение мыла к жесткой воде. Синтетические моющие средства – СМС (детергенты), их преимущества и недостатки.
Демонстрации. Знакомство с физическими свойствами важнейших карбоновых кислот. Отношение различных карбоновых кислот к воде. Сравнение рН водных растворов уксусной и соляной кислоты одинаковой молярности. Получение сложного эфира. Отношение сливочного, подсолнечного, машинного масел и маргарина к бромной воде и раствору перманганата калия.
Лабораторные опыты. Взаимодействие раствора уксусной кислоты с магнием, оксидом цинка, гидроксидом железа (III), раствором карбоната калия и стеарата калия. Ознакомление с образцами сложных эфиров. Отношение сложных эфиров к воде и органическим веществам. «Выведение» жирного пятна с помощью сложного эфира. Растворимость жиров в воде и органических растворителях. Сравнение моющих свойств хозяйственного мыла и СМС в жесткой воде.
Практическая работа. Растворимость различных карбоновых кислот в воде. Взаимодействие уксусной кислоты с металлами. Получение изоамилового эфира уксусной кислоты. Сравнение степени ненасыщенности твердого и жидкого жиров. Омыление жира. Получение мыла и изучение его свойств: пенообразование, реакции ионного обмена, гидролиз, выделение свободных жирных кислот.
Изучив раздел студент должен:
знать:
классификацию и номенклатуру карбоновых кислот и их производных;
вещества и материалы, широко используемые в практике: органические кислоты, жиры, мыла и моющие средства.
Уметь:
называть: изученные вещества по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, принадлежность веществ к классам карбоновых кислот и их производных; характер взаимного влияния атомов в молекулах;
характеризовать: строение и общие химические свойства карбоновых кислот и их производных;
объяснять: зависимость реакционной способности карбоновых кислот и их производных от строения их молекул;
выполнять химический эксперимент по распознаванию карбоновых кислот и их производных, получению конкретных веществ, относящихся к карбоновым кислотам и их производным;
проводить расчеты по химическим формулам и уравнениям реакций.
2.10. Углеводы
Понятие об углеводах. Классификация углеводов. Моно-, ди- и полисахариды, представители каждой группы углеводов. Биологическая роль углеводов, их значение в жизни человека и общества.
Моносахариды. Строение и оптическая изомерия моносахаридов. Их классификация по числу атомов углерода и природе карбонильной группы. Формулы Фишера и Хеуорса для изображения молекул моносахаридов. Отнесение моносахаридов к D- и L-ряду. Важнейшие представители моноз.
Глюкоза, строение ее молекулы и физические свойства. Таутомерия. Химические свойства глюкозы: реакции по альдегидной группе («серебряного зеркала», окисление азотной кислотой, гидрирование). Реакции глюкозы как многоатомного спирта: взаимодействие глюкозы с гидроксидом меди(II) при комнатной температуре и нагревании. Различные типы брожения (спиртовое, молочнокислое). Глюкоза в природе. Биологическая роль и применение глюкозы. Фруктоза как изомер глюкозы. Сравнение строения молекулы и химических свойств глюкозы и фруктозы. Фруктоза в природе и ее биологическая роль.
Пентозы. Рибоза и дезоксирибоза как представители альдопентоз. Строение молекул.
Дисахариды. Строение дисахаридов. Способ сочленения циклов. Восстанавливающие и невосстанавливающие свойства дисахаридов как следствие сочленения цикла. Строение и химические свойства сахарозы. Технологические основы производства сахарозы. Лактоза и мальтоза как изомеры сахарозы.
Полисахариды. Общее строение полисахаридов. Строение молекулы крахмала, амилоза и амилопектин. Физические свойства крахмала, его нахождение в природе и биологическая роль. Гликоген. Химические свойства крахмала. Строение элементарного звена целлюлозы. Влияние строения полимерной цепи на физические и химические свойства целлюлозы. Гидролиз целлюлозы, образование сложных эфиров с неорганическими и органическими кислотами. Понятие об искусственных волокнах: ацетатный шелк, вискоза. Нахождение в природе и биологическая роль целлюлозы. Сравнение свойств крахмала и целлюлозы.
Демонстрации. Образцы углеводов и изделий из них. Получение сахарата кальция и выделение сахарозы из раствора сахарата кальция. Взаимодействие глюкозы с фуксинсернистой кислотой. Отношение растворов сахарозы и мальтозы к Cu(OH)2 при нагревании. Ознакомление с физическими свойствами крахмала и целлюлозы. Набухание целлюлозы и крахмала в воде. Коллекция волокон.
Лабораторные опыты. Ознакомление с физическими свойствами глюкозы. Кислотный гидролиз сахарозы. Знакомство с образцами полисахаридов. Обнаружение крахмала с помощью качественной реакции в меде, хлебе, йогурте, маргарине, макаронных изделиях, крупах.
Практическая работа. Реакция «серебряного зеркала» глюкозы. Взаимодействие глюкозы с гидроксидом меди (II) при различных температурах. Действие аммиачного раствора оксида серебра на сахарозу. Обнаружение лактозы в молоке. Действие иода на крахмал.
Изучив раздел студент должен:
знать:
классификацию и номенклатуру углеводов;
вещества и материалы, широко используемые в практике: глюкоза, сахароза, крахмал, клетчатка, искусственные волокна.
Уметь:
называть: изученные вещества по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, принадлежность веществ к углеводам;
характеризовать: строение и общие химические свойства углеводов;
объяснять: зависимость реакционной способности углеводов от строения их молекул;
выполнять химический эксперимент по распознаванию важнейших углеводов;
проводить расчеты по химическим формулам и уравнениям реакций.
2.11. Амины, аминокислоты, белки
Классификация и изомерия аминов. Понятие об аминах. Первичные, вторичные и третичные амины. Классификация аминов по типу углеводородного радикала и числу аминогрупп в молекуле. Гомологические ряды предельных алифатических и ароматических аминов, изомерия и номенклатура.
Химические свойства аминов. Амины как органические основания, их сравнение с аммиаком и другими неорганическими основаниями. Сравнение химических свойств алифатических и ароматических аминов. Образование амидов. Анилиновые красители. Понятие о синтетических волокнах. Полиамиды и полиамидные синтетические волокна.
Применение и получение аминов. Получение аминов. Работы Н.Н.Зинина.
Аминокислоты. Понятие об аминокислотах, их классификация и строение. Оптическая изомерия -аминокислот. Номенклатура аминокислот. Двойственность кислотно-оснóвных свойств аминокислот и ее причины. Биполярные ионы. Реакции конденсации. Пептидная связь. Синтетические волокна: капрон, энант. Классификация волокон. Получение аминокислот, их применение и биологическая функция.
Белки. Белки как природные полимеры. Первичная, вторичная, третичная и четвертичная структуры белков. Фибриллярные и глобулярные белки. Химические свойства белков: горение, денатурация, гидролиз, качественные (цветные) реакции. Биологические функции белков, их значение. Белки как компонент пищи. Проблема белкового голодания и пути ее решения.
Демонстрации. Физические свойства метиламина: агрегатное состояние, цвет, запах, отношение к воде. Горение метиламина. Взаимодействие анилина и метиламина с водой и кислотами. Окрашивание тканей анилиновыми красителями. Обнаружение функциональных групп в молекулах аминокислот. Нейтрализация щелочи аминокислотой. Нейтрализация кислоты аминокислотой. Растворение и осаждение белков.
Лабораторные опыты. Изготовление шаростержневых и объемных моделей изомерных аминов. Растворение белков в воде и их коагуляция. Обнаружение белка в курином яйце и молоке.
Практическая работа. Образование солей глицина. Получение медной соли глицина. Денатурация белка. Цветные реакции белков.
Изучив раздел студент должен:
знать:
классификацию и номенклатуру аминов, аминокислот, белков;
вещества и материалы, широко используемые в практике: анилин, аминокислоты, белки.
Уметь:
называть: изученные вещества по «тривиальной» или международной номенклатурам;
определять: пространственное строение молекул, изомеры и гомологи, принадлежность веществ к разным классам аминов, аминокислот, белков;
характеризовать: общие химические свойства аминов, аминокислот, белков;
объяснять: зависимость реакционной способности аминов и аминокислот от строения их молекул;
выполнять химический эксперимент по распознаванию аминов, аминокислот, белков;
проводить расчеты по химическим формулам и уравнениям реакций.
2.12. Азотсодержащие гетероциклические соединения. Нуклеиновые кислоты
Нуклеиновые кислоты. Нуклеиновые кислоты как природные полимеры. Нуклеотиды, их строение, примеры. АТФ и АДФ, их взаимопревращение и роль этого процесса в природе. Понятие ДНК и РНК. Строение ДНК, ее первичная и вторичная структура. Работы Ф. Крика и Д. Уотсона. Комплементарность азотистых оснований. Репликация ДНК. Особенности строения РНК. Типы РНК и их биологические функции. Понятие о троичном коде (кодоне). Биосинтез белка в живой клетке. Генная инженерия и биотехнология. Трансгенные формы растений и животных.
Демонстрации. Модели молекул важнейших гетероциклов. Коллекция гетероциклических соединений. Действие раствора пиридина на индикатор. Взаимодействие пиридина с соляной кислотой. Модель молекулы ДНК, демонстрация принципа комплементарности азотистых оснований. Образцы продуктов питания из трансгенных форм растений и животных. Лекарства и препараты, изготовленные методами генной инженерии и биотехнологии.
Лабораторные опыты. Изготовление объемных и шаростержневых моделей азотистых гетероциклов.
Изучив раздел студент должен:
знать:
Уметь:
называть: изученные вещества;
определять: принадлежность веществ к разным классам изученных органических соединений; характер взаимного влияния атомов в молекулах;
характеризовать: строение и общие химические свойства изученных органических соединений;
объяснять: зависимость реакционной способности изученных органических соединений от строения их молекул.
2.13. Биологически активные соединения
Ферменты. Понятие о ферментах как о биологических катализаторах белковой природы. Особенности строения и свойств в сравнении с неорганическими катализаторами. Классификация ферментов. Особенности строения и свойств ферментов: селективность и эффективность. Зависимость активности ферментов от температуры и рН среды. Значение ферментов в биологии и применение в промышленности.
Витамины. Понятие о витаминах. Их классификация и обозначение. Норма потребления витаминов. Водорастворимые (на примере витаминов С, группы В и Р) и жирорастворимые (на примере витаминов А, D и Е). Авитаминозы, гипервитаминозы и гиповитаминозы, их профилактика.
Гормоны. Понятие о гормонах как биологически активных веществах, выполняющих эндокринную регуляцию жизнедеятельности организмов. Классификация гормонов: стероиды, производные аминокислот, полипептидные и белковые гормоны. Отдельные представители: эстрадиол, тестостерон, инсулин, адреналин.
Лекарства. Понятие о лекарствах как химиотерапевтических препаратах. Краткие исторические сведения о возникновении и развитии химиотерапии. Группы лекарств: сульфамиды (стрептоцид), антибиотики (пенициллин), антипиретики (аспирин), анальгетики (анальгин). Механизм действия некоторых лекарственных препаратов, строение молекул, прогнозирование свойств на основе анализа химического строения. Антибиотики, их классификация по строению, типу и спектру действия. Безопасные способы применения, лекарственные формы.
Демонстрации. Образцы витаминных препаратов. Поливитамины. Иллюстрации фотографий животных с различными формами авитаминозов. Плакат с изображением структурных формул эстрадиола, тестостерона, адреналина. Взаимодействие адреналина с раствором FeCl3. Белковая природа инсулина (цветная реакция на белки). Плакаты или кодограммы с формулами амида сульфаниловой кислоты, дигидрофолиевый и ложной дигидрофолиевой кислот, бензилпенициллина, тетрациклина, цефотаксима, аспирина.
Лабораторные опыты. Испытание растворимости адреналина в воде и соляной кислоте. Обнаружение аспирина в готовой лекарственной форме.
Практическая работа. Обнаружение витамина А в подсолнечном масле. Обнаружение витамина С в яблочном соке. Определение витамина D в рыбьем жире или курином желтке. Действие амилозы слюны на крахмал. Действие дегидрогеназы на метиленовый синий. Действие каталазы на пероксид водорода. Анализ лекарственных препаратов, производных салициловой кислоты. Анализ лекарственных препаратов, производных п-аминофенола.
Изучив раздел студент должен:
знать:
Уметь:
Самостоятельная (внеаудиторная) работа.
Подготовка индивидуальных информационных сообщений, рефератов презентаций по темам:
Общая и неорганическая химия
Биотехнология и генная инженерия – технологии XXI века.
Нанотехнология как приоритетное направление развития науки и производства в РФ.
Современные методы обеззараживания воды.
Аллотропия металлов.
Жизнь и деятельность Д.И. Менделеева.
«Периодическому закону будущее не грозит разрушением…».
Синтез 114-го элемента – триумф российских физиков-ядерщиков.
Использование радиоактивных изотопов в технических целях.
Рентгеновское излучение и его использование в технике и медицине.
Плазма – четвертое состояние вещества.
Аморфные вещества в природе, технике, быту.
Охрана окружающей среды от химического загрязнения.
Количественные характеристики загрязнения окружающей среды.
Защита озонового экрана от химического загрязнения.
Грубодисперсные системы, их классификация и использование.
Косметические гели.
Применение суспензий и эмульсий в строительстве.
Минералы и горные породы как основа литосферы.
Растворы вокруг нас.
Вода как реагент и как среда для химического процесса.
Типы растворов.
Устранение жесткости воды на промышленных предприятиях.
Использование минеральных кислот на предприятиях различного профиля.
Оксиды и соли как строительные материалы.
История гипса.
Поваренная соль как химическое сырье.
Многоликий карбонат кальция: в природе, в промышленности, в быту.
Реакция горения на производстве.
Реакция горения в быту.
Виртуальное моделирование химических процессов.
Практическое применение электролиза: рафинирование, гальванопластика, гальваностегия.
История получения и производства алюминия.
Электролитическое получение и рафинирование меди.
Роль металлов в истории человеческой цивилизации.
Современное металлургическое производство.
Специальности, связанные с обработкой металлов.
Роль металлов и сплавов в научно-техническом прогрессе.
Коррозия металлов и способы защиты от коррозии.
Инертные или благородные газы.
Химия металлов в моей профессиональной деятельности.
Химия неметаллов в моей профессиональной деятельности.
Органическая химия
Краткие сведения по истории возникновения и развития органической химии.
Современные представления о теории химического строения.
Экологические аспекты использования углеводородного сырья.
Экономические аспекты международного сотрудничества по использованию углеводородного сырья.
История открытия и разработки газовых и нефтяных месторождений в РФ.
Углеводородное топливо, его виды и назначение.
Синтетические каучуки: история, многообразие и перспективы.
Резинотехническое производство и его роль в научно-техническом прогрессе.
Сварочное производство и роль химии углеводородов в ней.
Нефть и ее транспортировка как основа взаимовыгодного международного сотрудничества.
Ароматические углеводороды как сырье для производства пестицидов.
Углеводы и их роль в живой природе.
Строение глюкозы: история развития представлений и современные воззрения.
Развитие сахарной промышленности в России.
Роль углеводов в моей будущей профессиональной деятельности.
Этанол: величайшее благо и страшное зло.
Алкоголизм и его профилактика.
Многоатомные спирты и моя будущая профессиональная деятельность.
Формальдегид как основа получения веществ и материалов для моей профессиональной деятельности.
Муравьиная кислота в природе, науке и производстве.
Сложные эфиры и их значение в природе, быту и производстве.
Жиры как продукт питания и химическое сырье.
Замена жиров в технике непищевым сырьем.
Нехватка продовольствия как глобальная проблема человечества и пути ее решения.
Мыла: прошлое, настоящее, будущее.
Средства гигиены на основе кислородсодержащих органических соединений.
Синтетические моющие средства (СМС): достоинства и недостатки.
Аммиак и амины – бескислородные основания.
Анилиновые красители: история, производство, перспектива.
Аминокислоты – амфотерные органические соединения.
Аминокислоты – «кирпичики» белковых молекул.
Синтетические волокна на аминокислотной основе.
«Жизнь это способ существования белковых тел…»
Структуры белка и его деструктурирование.
Биологические функции белков.
Белковая основа иммунитета.
Дефицит белка в пищевых продуктах и его преодоление в рамках глобальной продовольственной программы.
Химия и биология нуклеиновых кислот.
Средства обучения
| № | Вид | Средства обучения |
| 1 | Учебно-методическая литература |
| 1.1 | Учебная литература | учебники, учебные пособия, конспекты лекций, справочники, задачники |
| 1.2 | Методическая литература | |
| 2 | Учебно-наглядные пособия |
| 2.1 | Изобразительные пособия | таблицы, плакаты, схемы, модели, стенды, портреты, алгоритмы |
| 2.2 | Натуральные пособия | инструменты, приборы, растворы, химические реактивы |
| 3 | Технические средства обучения |
| 3.1 | Оборудование кабинета в соответствии с требованиями, предъявляемыми к материально-техническому обеспечению дисциплины «Химия»
| см. Паспорт кабинета |
| 3.2 | Аудиовизуальные средства обучения | |
| 3.3 | Информационные средства обучения | персональный компьютер, интерактивная доска, |
Рекомендуемая литература
Для обучающихся обязательная литература
Габриелян О.С. Химия: учеб. для студ. проф. учеб. заведений / О.С. Габриелян, И.Г. Остроумов. – М., 2005.
Габриелян О.С. Химия. 10 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Ф.Н. Маскаев, С.Ю. Пономарев, В.И. Теренин. – М., 2005.
Габриелян О.С. Химия. 11 класс. Профильный уровень: учеб. для общеобразоват. учреждений / О.С. Габриелян, Г.Г.Лысова. – М., 2006.
Габриелян О.С. Химия: орган. химия: учеб. для 10 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, А.А. Карцова – М., 2005.
Габриелян О.С. Общая химия: учеб. для 11 кл. общеобразоват. учреждений с углубл. изучением химии / О.С. Габриелян, И.Г. Остроумов, С.Н. Соловьев, Ф.Н. Маскаев – М., 2005.
Дополнительная литература
Габриелян О.С. Химия в тестах, задачах, упражнениях: учеб. пособие для студ. сред. проф. учебных заведений / О.С. Габриелян, Г.Г. Лысова – М., 2006.
Габриелян О.С. Практикум по общей, неорганической и органической химии: учеб. пособие для студ. сред. проф. учеб. заведений / Габриелян О.С., Остроумов И.Г., Дорофеева Н.М. – М., 2007
Габриелян О.С., Воловик В.В. Единый государственный экзамен: Химия: Сб. заданий и упражнений. – М., 2004.
Габриелян О.С.,Остроумов И.Г. Химия:Пособие для поступающих в вузы.–М.,2005.
Браун Т., Лемей Г.Ю. Химия в центре наук: В 2 т. – М., 1987.
Ерохин Ю.М. Химия. – М., 2003.
Пичугина Г.В. Химия и повседневная жизнь человека. – М., 2004.
Титова И.М. Химия и искусство. – М., 2007.
Титова И.М. Химия и искусство: организатор-практикум для учащихся 10–11 классов общеобразовательных учреждений. – М., 2007.
Ерохин Ю.М., Фролов В.И. Сборник задач и упражнений по химии (с дидактическим материалом): учеб. пособие для студентов средн. проф. завед. – М., 2004.
Габриелян О.С., Лысова Г.Г. Химия в тестах, задачах и упражнениях: учеб. пособие. – М., 2004.
Для преподавателей
Габриелян О.С. Химия для преподавателя: учебно-методическое пособие / О.С. Габриелян, Г.Г. Лысова – М., 2006.
Габриелян О.С. Настольная книга учителя химии: 10 класс / О.С. Габриелян, И.Г. Остроумов – М., 2004.
Габриелян О.С. Настольная книга учителя химии: 11 класс: в 2 ч. / О.С. Габриелян, Г.Г. Лысова, А.Г. Введенская – М., 2004.
Аршанский Е.А.Методика обучения химии в классах гуманитарного профиля – М., 2003.
Кузнецова Н.Е. Обучение химии на основе межпредметной интеграции / Н.Е. Кузнецова, М.А. Шаталов. – М., 2004.
Чернобельская Г.М. Методика обучения химии в средней школе. – М., 2003.
Габриелян О.С. Лысова Г.Г. Химия для преподавателя: методическое пособие. – М., 2004.
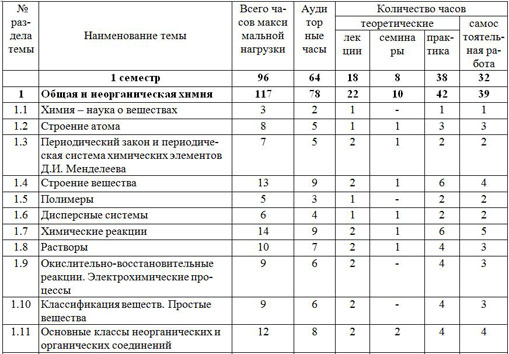

 Получите свидетельство
Получите свидетельство Вход
Вход











 Рабочая программа по химии (1 курс медицинский колледж) (0.12 MB)
Рабочая программа по химии (1 курс медицинский колледж) (0.12 MB)
 0
0 4567
4567 853
853 Нравится
0
Нравится
0





