
медь

I . Исторические сведения
II . Медь – химический элемент:
1) Положение меди в периодической системе
химических элементов Д.И.Менделеева
2) Строение атома.
3) Нахождение в природе
III. Медь – простое вещество
1. Состав. Строение. Свойства .
2 . Получение.
3. Химические свойства
4 . Применение
5. Биологическое значение меди.
IV. Соединения меди
VI . Качественная реакция на медь

I . Исторические сведения
Медь (англ. Copper, франц. Cuivre, нем. Kupfer) - один из первых металлов, которые человек стал применять для технических целей. В древности медь применялась в основном в виде сплава с оловом — бронзы для изготовления оружия. Периоды использования меди и бронзы ознаменовали целые эпохи культурного развития человечества под названием медный век и бронзовый век.
Латинское название меди Cuprum (древн. Aes cuprium, Aes cyprium) произошло от названия острова Кипр, где уже в III в. до н. э. существовали медные рудники и производилась выплавка меди.
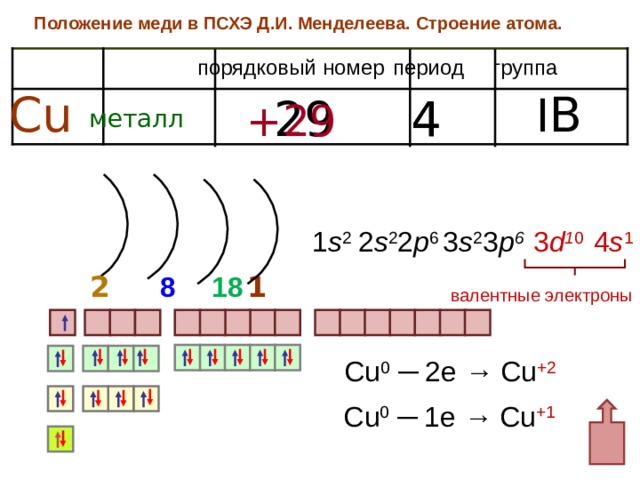
Положение меди в ПСХЭ Д.И. Менделеева. Строение атома.
порядковый номер
группа
период
I B
Cu
4
4
29
+29
металл
4 s 1
2 s 2 2 p 6
1 s 2
3 s 2 3 p 6
3 d 1 0
1 8
1
8
2
валентные электроны
Cu 0 ─ 2e → Cu +2
Cu 0 ─ 1 e → Cu +1

Нахождение меди
в природе
Медь встречается в природе как в соединениях, так и в самородном виде. Промышленное значение имеют халькопирит CuFeS 2 , также известный как медный колчедан, халькозин Cu 2 S и борнит Cu 5 FeS 4 . Вместе с ними встречаются и другие минералы меди: ковеллин CuS, куприт Cu 2 O , азурит Cu 3 (CO 3 ) 2 (OH) 2 , малахит Cu 2 CO 3 (OH) 2 . Иногда медь встречается в самородном виде, масса отдельных скоплений может достигать 400 тонн .
Медь занимает по распространению в природе 23-е место среди всех элементов: ее массовая доля в земной коре равна 0,01%.



Физические свойства
Медь тяжелый розово-красный металл, мягкий и ковкий, плавится при температуре 1084,5°С, очень хорошо проводит электрический ток и теплоту: электрическая проводимость меди в 1,7 раза выше, чем алюминия, в 6 раз выше, чем железа, и лишь немного уступает электрической проводимости серебра
Кристаллическая решётка меди .

Получение меди
Исходным сырьем для промышленного получения меди
являются сульфидные руды. Процесс получения меди из
сульфидных руд относят к пирометаллургическим
(протекающим при повышенной температуре)
Вначале сульфид меди (например, Cu 2 S) подвергают окислительному обжигу:
Cu 2 S + 20 2 = 2CuO + S0 2
К образовавшемуся оксиду, меди (II) добавляют новую порцию сульфида. При высокой температуре протекает реакция: 2CuO + Cu 2 S = 4Сu + S0 2
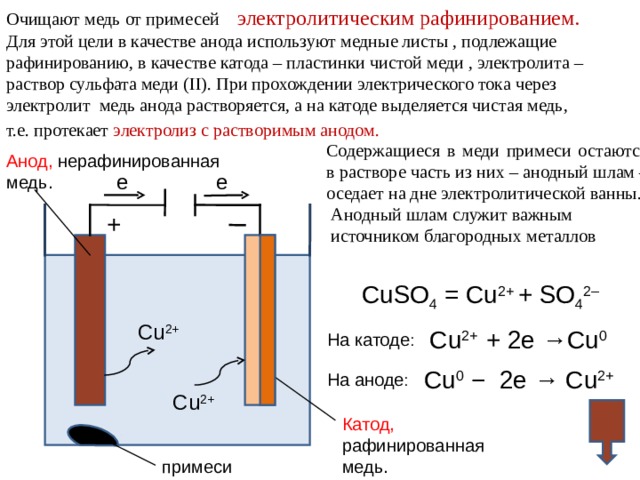
Очищают медь от примесей электролитическим рафинированием.
Для этой цели в качестве анода используют медные листы , подлежащие
рафинированию, в качестве катода – пластинки чистой меди , электролита –
раствор сульфата меди ( II ). При прохождении электрического тока через
электролит медь анода растворяется, а на катоде выделяется чистая медь,
т.е. протекает электролиз с растворимым анодом.
Анод, нерафинированная
медь.
Содержащиеся в меди примеси остаются в растворе часть из них – анодный шлам – оседает на дне электролитической ванны.
Анодный шлам служит важным
источником благородных металлов
е
е
+
CuSO 4 = Cu 2+ + SO 4 2–
Cu 2+
Cu 2+ + 2e →Cu 0
На катоде :
Cu 0 − 2e → Cu 2+
На аноде :
Cu 2+
Катод,
рафинированная
медь.
примеси
 2 Медь, перешедшую в раствор, восстанавливают более активным металлом: CuSO 4 + Fe = FeSO 4 + Cu [Cu(NH 3 ) 4 ](OH) 2 + Zn = Cu + [Zn(NH 3 ) 4 ](OH) 2](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img10.jpg)
Получение меди гидрометаллургическим способом.
Медную руду обрабатывают растворами серной кислоты или
или аммиака:
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 4NH 3 + H 2 O = [Cu(NH 3 ) 4 ](OH) 2
Медь, перешедшую в раствор, восстанавливают более активным металлом:
CuSO 4 + Fe = FeSO 4 + Cu
[Cu(NH 3 ) 4 ](OH) 2 + Zn = Cu + [Zn(NH 3 ) 4 ](OH) 2
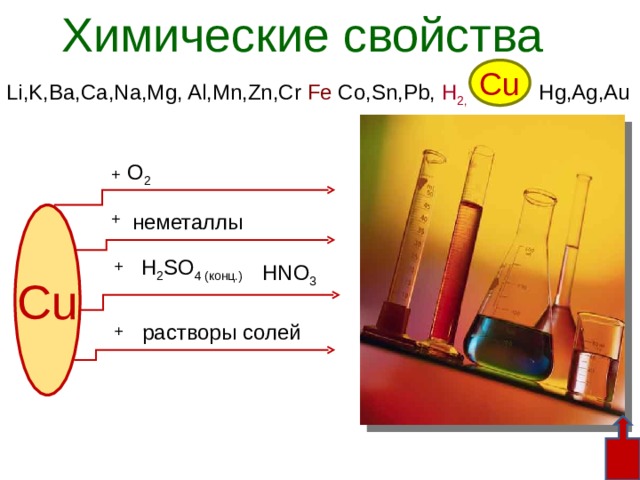
Химические свойства
Cu
Li,K,Ba,Ca,Na,Mg, Al,Mn,Zn,Cr Fe Co,Sn,Pb, H 2, Hg,Ag,Au
О 2
+
+
Cu
неметаллы
H 2 SO 4 (конц.)
HNO 3
+
растворы солей
+

При комнатной температуре медь устойчива на воздухе.
При нагревании на воздухе металл покрывается черной
пленкой оксида меди ( II) . Составьте уравнение реакции.
2Cu + O 2 = 2CuO
При длительном хранении медные изделия покрываются
зеленым налетом .
2Cu + CO 2 + H 2 O + O 2 = (CuOH) 2 CO 3

Взаимодействие с неметаллами:
Медь вступает в реакции с галогенами, серой, селеном.
С водородом, углеродом, азотом медь не взаимодействует
даже при высокой температуре.
Составьте уравнение реакции меди с хлором, бромом, серой. Рассмотрите эти реакции как окислительно-восстановительные. Назовите окислитель и восстановитель.
Cu 0 + Br 2 0 = Cu +2 Br 2 –
Cu 0 ─ 2e → Cu +2 1
Br 2 0 + 2e → 2Br –1 1
Cu 0 ─ восстановитель, процесс окисления
Br 2 – окислитель, процесс восстановления

Взаимодействие хлора с медью
Даже малоактивные металлы энергично взаимодействуют с хлором. Пучок медной проволоки, нагретый в пламени горелки помещают в цилиндр, наполненный хлором. Медь раскаляется, взаимодействует с хлором, с кончика проволоки на дно цилиндра начинает капать расплавленный хлорид меди ( II ).
Cu 0 + Cl 2 0 = Cu +2 Cl 2 –
опыт
Cu 0 ─ 2e → Cu +2 1
Cl 2 0 + 2e → 2Cl –1 1
Cu 0 ─ восстановитель, процесс окисления
Cl 2 – окислитель, процесс восстановления

Взаимодействие серы с медью
Медь - неактивный металл. Но при повышенных температурах она активно взаимодействует с серой. Сера плавится и постепенно закипает. Пробирка наполняется бурыми парами серы. В парах серы медь загорается. Продукт взаимодействия – черный сульфид меди.
Cu + S = CuS
опыт

Взаимодействие с кислотами
В электрохимическом ряду напряжений металлов медь
расположена правее водорода. Кислоты не обладающие
окислительными свойствами, на нее не действуют, но медь
легко растворяется в кислотах-окислителях – концентрирован-
ной серной и азотной. Рассмотрите эти реакции как
окислительно-восстановительные. Назовите окислитель и
восстановитель.
0
+6
+2
+4
Cu + H 2 S O 4 → Cu SO 4 + S O 2 + H 2 O
опыт
Cu 0 ─ 2e → Cu +2 2
S +6 + 4e → S +4` 1
Cu + 2 H 2 SO 4 = CuSO 4 + SO 2 + 2 H 2 O
Cu 0 ─ восстановитель, процесс окисления
H 2 SO 4 (за счет S +6 ) – окислитель, процесс восстановления
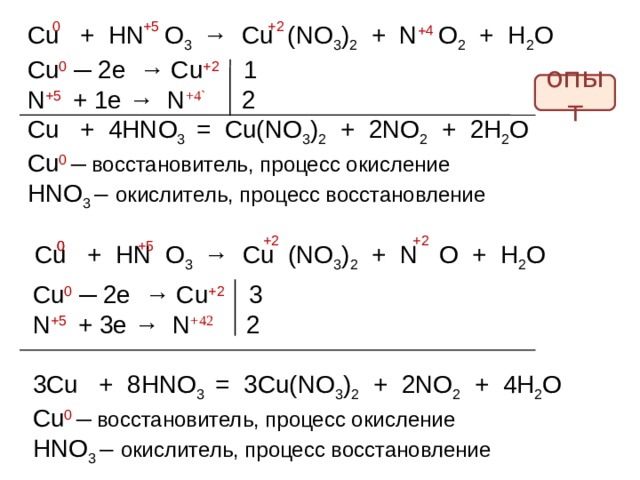
0
+5
+2
Cu + HN O 3 → Cu (NO 3 ) 2 + N O 2 + H 2 O
+4
Cu 0 ─ 2e → Cu +2 1
N + 5 + 1e → N +4` 2
Cu + 4 HNO 3 = Cu(NO 3 ) 2 + 2 NO 2 + 2 H 2 O
Cu 0 ─ восстановитель, процесс окисление
HNO 3 – окислитель, процесс восстановление
опыт
+2
+2
0
+5
0
Cu + HN O 3 → Cu (NO 3 ) 2 + N O + H 2 O
Cu 0 ─ 2e → Cu +2 3
N + 5 + 3 e → N +4 2 2
3 Cu + 8 HNO 3 = 3 Cu(NO 3 ) 2 + 2 NO 2 + 4 H 2 O
Cu 0 ─ восстановитель, процесс окисление
HNO 3 – окислитель, процесс восстановление

Разбавленные серная и соляная кислоты на медь не
действуют. Однако в присутствии кислорода воздуха медь
растворяется в этих кислотах с образованием солей меди (II):
2Cu + O 2 + 2H 2 SO 4 = 2CuSO 4 + 2H 2 O
2Cu + O 2 + 4HCl = 2CuCl 2 + 2H 2 O

Взаимодействие с растворами солей
+ 2
+2
0
0
Cu + Hg(NO 3 ) 2 → Cu(NO 3 ) 2 + Hg
опыт
Рассмотрите эту реакцию как окислительно-восстановительную и
расставьте коэффициенты.
Cu 0 ─ 2e → Cu +2 1
Hg +1 + 2e → Hg 0 1
Cu + Hg(NO 3 ) 2 = Cu(NO 3 ) 2 + Hg
Cu 0 ─ восстановитель, процесс окисления
Hg(NO 3 ) 2 (за счет Hg +2 ) – окислитель, пр . восстановления


Применение меди
в электротехнике
1
теплоотводные устройства
2
производство труб
3
сплавы на основе меди
4
ювелирные сплавы
5
в архитектуре
6
другие сферы применения
7

Из-за низкого удельного сопротивления медь широко применяется в электротехнике для изготовления силовых кабелей, проводов или других проводников, например, при печатном монтаже. Медные провода, в свою очередь, также используются в обмотках энергосберегающих электроприводов и силовых трансформаторов. Для этих целей металл должен быть очень чистый
1

Другое полезное качество меди — высокая теплопроводность. Это позволяет применять её в различных теплоотводных устройствах, теплообменниках, к числу которых относятся радиаторы охлаждения, кондиционирования и отопления.
2

В связи с высокой механической прочностью, но одновременно пригодностью для механической обработки, медные бесшовные трубы круглого сечения получили широкое применение для транспортировки жидкостей и газов, во внутренних системах водоснабжения, отопления, газоснабжения, системах кондиционирования и холодильных агрегатах. В ряде стран трубы из меди являются основным материалом, применяемым для этих целей. Кроме того, трубопроводы из меди и сплавов меди широко используются в судостроении и энергетике для транспортировки жидкостей и пара.
3

В разнообразных областях техники широко используются сплавы с использованием меди, самыми широко распространёнными из которых бронза и латунь, дюралюминий ( w ( Cu) = 4 ,4%)
Медь является важным компонентом твёрдых припоев — сплавов с температурой плавления 590—880°С .
4

В ювелирном деле часто используются сплавы меди с золотом для увеличения прочности изделий к деформациям и истиранию, так как чистое золото — очень мягкий металл и нестойко к этим механическим воздействиям.
Медь применяют для изготовления украшений
5

Широко применяется медь в архитектуре. Кровли и фасады из тонкой листовой меди служат безаварийно по 100—150 лет.
6

Другие сферы применени я
Медь — самый широко употребляемый катализатор полимеризации ацетилена. Из-за этого трубопроводы из меди для транспортировки ацетилена можно применять только при содержании меди в сплаве материала труб не более 64 %.
Прогнозируемым новым массовым применением меди обещает стать её применение в качестве бактерицидных поверхностей в лечебных учреждениях для снижения внутрибольничного бактериопереноса: дверей, ручек, водозапорной арматуры, перил, поручней кроватей, столешниц — всех поверхностей, к которым прикасается рука человека.
7

Биологическая роль
Медь присутствует во всех организмах и принадлежит к числу микроэлементов, необходимых для их нормального развития. В растениях и животных содержание меди варьируется от 10 -15 до 10 -3 %. Всего в организме человека (масса тела 70 кг) содержится 72 мг меди. Основная роль меди в тканях растений и животных — участие в ферментативном катализе. Медь служит активатором ряда реакций и входит в состав медьсодержащих ферментов. Так как медь токсична, в животном организме она находится в связанном состоянии. Медь необходима для осуществления различных функций организма — дыхания, кроветворения (стимулирует усвоение железа и синтез гемоглобина), обмена углеводов и минеральных веществ. Недостаток меди вызывает болезни как растений, так и животных и человека. С пищей человек ежедневно получает 0,5-6 мг меди.

Соединения меди
оксиды
гидроксиды
соли

Соединения меди ( I )
Оксид меди ( I) красного цвета, в
природе встречается в виде минерала
куприта.
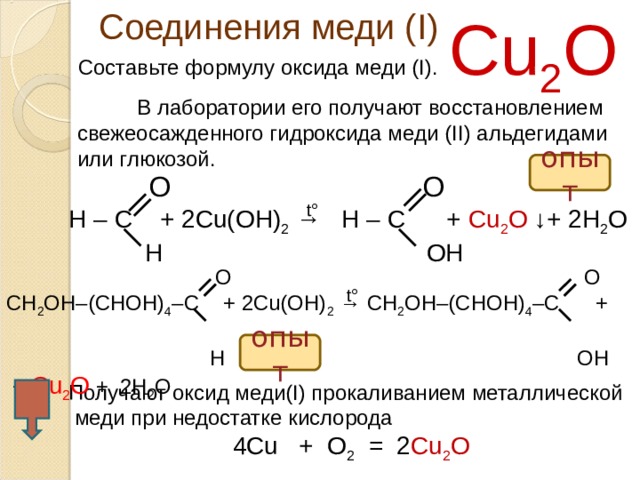
Соединения меди ( I )
Cu 2 O
Составьте формулу оксида меди ( I).
В лаборатории его получают восстановлением свежеосажденного гидроксида меди ( II) альдегидами или глюкозой.
опыт
O O
Н – С + 2 Cu(OH) 2 → H – C + Cu 2 O ↓+ 2 H 2 O
H OH
t°
O O
CH 2 ОН – ( C НОН) 4 – С + 2 Cu(OH) 2 → CH 2 ОН – ( C НОН) 4 – С +
H OH
+ Cu 2 O + 2H 2 O
t°
опыт
Получают оксид меди(I) прокаливанием металлической
меди при недостатке кислорода
4Cu + O 2 = 2 Cu 2 O



Химические свойства Cu 2 O

При нагревании без доступа воздуха разлагается на металлическую медь и оксид меди (II):
Cu 2 O = CuO + Cu
Водородом, оксидом углерода (II), алюминием оксид меди ( II) восстанавливается до металлической меди:
Cu 2 O + H 2 = 2Cu + H 2 O
Cu 2 O + CO = 2Cu + CO 2
3 Cu 2 O + 2 Al = 6 Cu + Al 2 O 3

1) В разбавленной серной и соляной кислотах растворяется только в присутствии кислорода.
2Cu 2 O + 8HCl (разб.) + O 2 = 4CuCl 2 + 4H 2 O
2) В концентрированной серной кислоте растворяется с выделением диоксида серы SO 2 .
С u 2 O + H 2 SO 4 (конц.) → CuSO 4 + SO 2 + H 2 O
3) В концентрированной азотной кислоте растворяется с выделением диоксида азота N O 2
Cu 2 O + HNO 3 → Cu(NO 3 ) 2 + NO 2 + H 2 O
Рассмотрите реакции 2,3 как окислительно-восстановительные. Расставьте коэффициенты. Определите окислитель, восстановитель
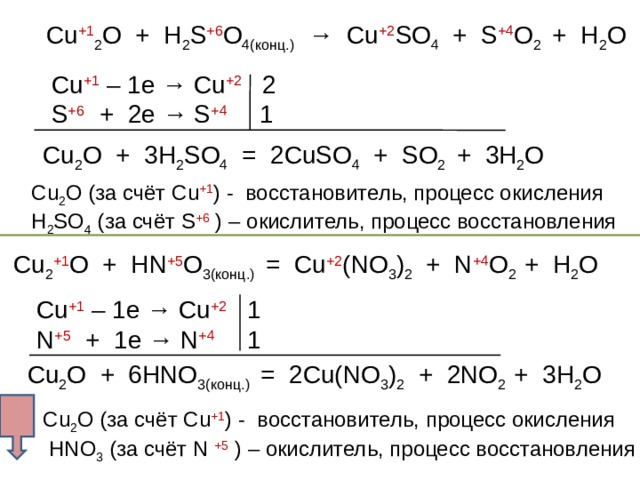
С u +1 2 O + H 2 S +6 O 4( конц.) → Cu +2 SO 4 + S +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 2
S +6 + 2е → S +4 1
С u 2 O + 3 H 2 SO 4 = 2 CuSO 4 + SO 2 + 3 H 2 O
С u 2 O (за счёт С u +1 ) - восстановитель, процесс окисления
H 2 SO 4 (за счёт S +6 ) – окислитель, процесс восстановления
Cu 2 +1 O + HN + 5 O 3( конц.) = Cu +2 (NO 3 ) 2 + N +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 1
N + 5 + 1 е → N +4 1
Cu 2 O + 6HNO 3( конц.) = 2Cu(NO 3 ) 2 + 2NO 2 + 3H 2 O
С u 2 O (за счёт С u +1 ) - восстановитель, процесс окисления
HNO 3 (за счёт N +5 ) – окислитель, процесс восстановления
![Устойчивыми соединениями меди ( I) являются нерастворимые соединения ( CuCl, Cu 2 S ) или комплексные соединения [Cu(NH 3 ) 2 ]OH, [Cu(NH 3 ) 2 ]Cl, которые получают растворением в концентрированном растворе аммиака оксида меди ( I), хлорида меди (I) Cu 2 O + 4 (NH 3 · H 2 O) = 2[Cu(NH 3 ) 2 ]OH + 3Н 2 О CuCl + 2NH 3 = [Cu(NH 3 ) 2 ]Cl Аммиачные растворы солей меди взаимодействуют с алкинами, например, с ацетиленом: CH ≡ CH + 2[Cu(NH 3 ) 2 ]Cl → Cu–C≡C–Cu + 2NH 3 + 2NH 4 Cl](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img39.jpg)
Устойчивыми соединениями меди ( I) являются
нерастворимые соединения ( CuCl, Cu 2 S ) или комплексные соединения [Cu(NH 3 ) 2 ]OH, [Cu(NH 3 ) 2 ]Cl,
которые получают растворением в концентрированном растворе аммиака оксида меди ( I), хлорида меди (I)
Cu 2 O + 4 (NH 3 · H 2 O) = 2[Cu(NH 3 ) 2 ]OH + 3Н 2 О
CuCl + 2NH 3 = [Cu(NH 3 ) 2 ]Cl
Аммиачные растворы солей меди взаимодействуют с
алкинами, например, с ацетиленом:
CH ≡ CH + 2[Cu(NH 3 ) 2 ]Cl → Cu–C≡C–Cu + 2NH 3 + 2NH 4 Cl
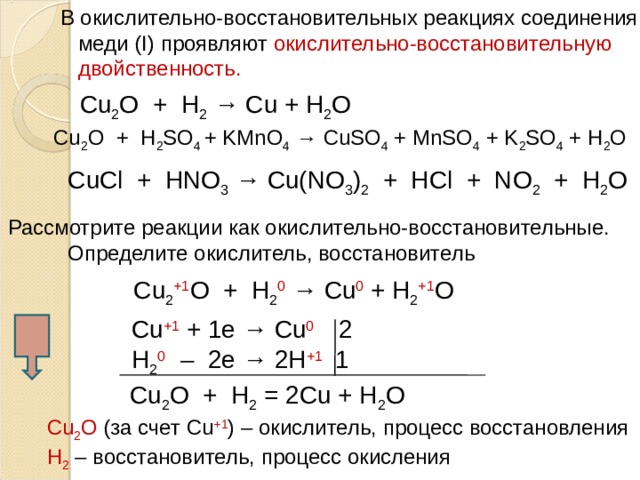
В окислительно-восстановительных реакциях соединения
меди ( I) проявляют окислительно-восстановительную
двойственность.
С u 2 O + H 2 → Cu + H 2 O
С u 2 O + H 2 SO 4 + KMnO 4 → CuSO 4 + MnSO 4 + K 2 SO 4 + H 2 O
С uCl + HNO 3 → Cu(NO 3 ) 2 + HCl + NO 2 + H 2 O
Рассмотрите реакции как окислительно-восстановительные.
Определите окислитель, восстановитель
С u 2 +1 O + H 2 0 → Cu 0 + H 2 +1 O
С u +1 + 1е → Cu 0 2
Н 2 0 – 2е → 2Н +1 1
С u 2 O + H 2 = 2 Cu + H 2 O
С u 2 O (за счет С u +1 ) – окислитель, процесс восстановления
Н 2 – восстановитель, процесс окисления

С u 2 +1 O + H 2 SO 4 + KMn +7 O 4 →Cu +2 SO 4 + Mn +2 SO 4 + K 2 SO 4 + H 2 O
2С u +1 – 2е → 2 Cu +2 5
Mn + 7 + 5 е → Mn + 2 2
5 С u 2 O + 13H 2 SO 4 + 2KMnO 4 = 10CuSO 4 + 2MnSO 4 + K 2 SO 4 +
+ 13H 2 O
С u 2 O (за счет С u +1 ) – восстановитель, процесс окисления
KMnO 4 ( за счет Mn + 7 ) – окислитель, процесс восстановления
С u +1 Cl + HN +5 O 3 → Cu +2 (NO 3 ) 2 + HCl + N +4 O 2 + H 2 O
С u +1 – 1е → Cu +2 5
N + 5 + 1 е → N + 4 1
С uCl + 3 HNO 3( конц.) = Cu(NO 3 ) 2 + HCl + NO 2 + H 2 O
С uCl (за счет С u +1 ) – восстановитель, процесс окисления
HNO 3 ( за счет N + 5 ) – окислитель, процесс восстановления

оксид меди ( II )
Кристаллы чёрного цвета, в обычных условиях довольно устойчивые, практически нерастворимые в воде. В природе встречается в виде минерала тенорита
(мелаконита) чёрного цвета.

CuO
Составьте формулу оксида меди ( II).
Получение оксида меди (II)
Оксид меди ( II ) получают как при взаимодействии меди с
кислородом, так и при разложении гидроксида меди ( II ),
нитрата меди ( II ) и малахита ( CuOH ) 2 CO 3 .
Составьте уравнения реакций получения оксида меди ( II)
t°
2Cu + O 2 = 2CuO
t°
Cu(OH) 2 = CuO + H 2 O
опыт
t°
2Cu(NO 3 ) 2 = 2CuO + 4NO 2 + O 2
t°
опыт
(CuOH) 2 CO 3 = 2CuO + CO 2 + H 2 O


Химические свойства CuO

Оксид меди ( II ) обладает слабыми амфотерными
свойствами, т.е. взаимодействуют как с кислотами так и
со щелочами.
Составьте уравнения реакции взаимодействия CuO
c соляной, серной кислотами.
CuO + 2HCl = CuCl 2 + H 2 O
CuO + 2H + + Cl – = Cu 2+ + 2Cl – + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
опыт
CuO + H 2 SO 4 = CuSO 4 + H 2 O
CuO + 2H + + SO 4 2– = Cu 2+ + SO 4 2– + H 2 O
CuO + 2H + = Cu 2+ + H 2 O
При сплавлении со щелочами CuO образует куприты:
CuO + 2KOH = K 2 CuO 2 + H 2 O


Взаимодействие уксусной кислоты с оксидом меди ( II)
Как и неорганические кислоты, уксусная кислота реагирует с оксидами металлов. При обычных условиях реакция идет очень медленно. При нагревании наблюдается растворение
Н оксида меди ( II ) и появление голубой окраски раствора. В пробирке образовался ацетат меди ( II ).
2 СН 3 СООН + CuO → (CH 3 COO) 2 Cu + H 2 O
опыт

Оксид меди ( II ) при нагревании взаимодействует с аминоуксусной кислотой. Раствор приобретает голубую окраску. Альфа-аминокислоты дают с медью окрашенные, очень устойчивые комплексные соли. Эти комплексные соединения очень прочны и не разрушаются под действием раствора щелочи.
опыт
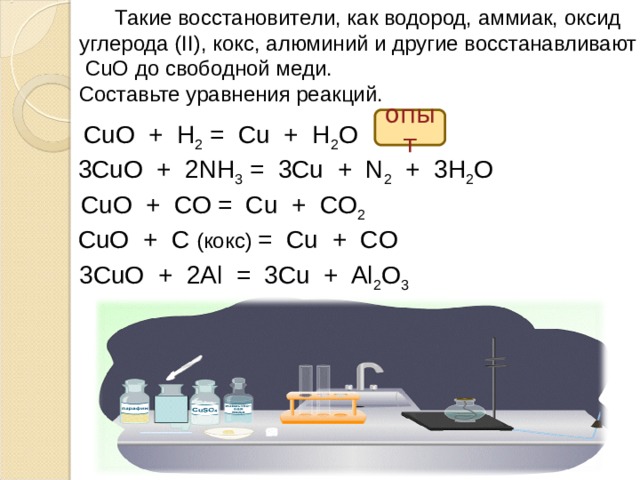
Такие восстановители, как водород, аммиак, оксид
углерода (II), кокс, алюминий и другие восстанавливают
CuO до свободной меди.
Составьте уравнения реакций.
опыт
CuO + H 2 = Cu + H 2 O
3CuO + 2NH 3 = 3Cu + N 2 + 3H 2 O
CuO + C О = Cu + CO 2
CuO + C ( кокс) = Cu + CO
3CuO + 2Al = 3Cu + Al 2 O 3

 2 + 3H 2 O](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img52.jpg)
CuO обладает слабыми амфотерными свойствами.
При сплавлении со щелочами оксид меди ( II ) образует
купраты.
CuO + 2 KOH = K 2 CuO 2 + H 2 O
Оксид меди ( II ) растворяется в водном растворе аммиака
CuO + 4(NH 3 · H 2 O) = [Cu(NH 3 ) 4 ](OH) 2 + 3H 2 O
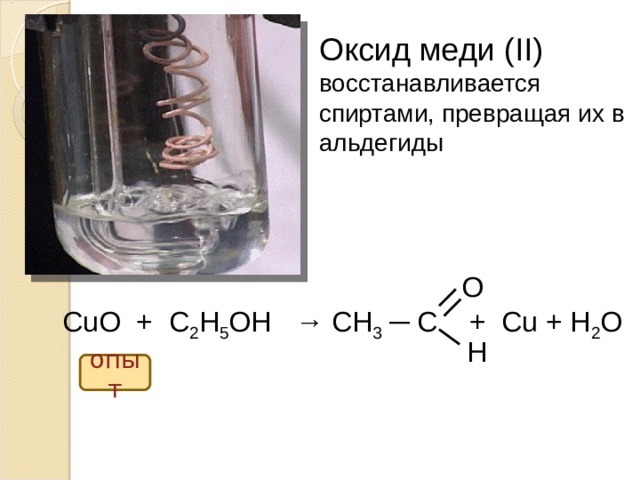
Оксид меди ( II )
восстанавливается
спиртами, превращая их в
альдегиды
O
CuO + C 2 H 5 OH → CH 3 ─ C + Cu + H 2 O
H
опыт

Гидрооксид меди ( II )
Гидроксид меди(II) — голубое аморфное или кристаллическое вещество.

Составьте формулу гидроксида меди ( II).
Cu(OH) 2
Получение гидроксида
меди (II)
Лабораторный опыт.
К раствору сульфата меди ( II ) добавляйте по каплям раствор гидроксида натрия. Образующийся в начале голубой осадок
основной соли в избытке щелочи переходит в синий гидроксид меди ( II ).
Составьте уравнения реакций получения гидроксида
меди( II ), используя сульфат меди ( II ), хлорид меди ( II ) и гидроксид натрия. Рассмотрите реакции с т.зр. ТЭД.
опыт

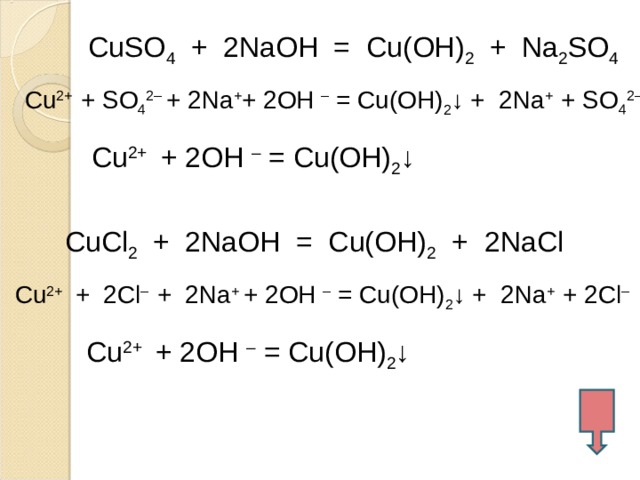
CuSO 4 + 2NaOH = Cu(OH) 2 + Na 2 SO 4
Cu 2+ + SO 4 2– + 2Na + + 2OH – = Cu(OH) 2 ↓ + 2Na + + SO 4 2–
Cu 2+ + 2OH – = Cu(OH) 2 ↓
CuCl 2 + 2NaOH = Cu(OH) 2 + 2NaCl
Cu 2+ + 2Cl – + 2Na + + 2OH – = Cu(OH) 2 ↓ + 2Na + + 2Cl –
Cu 2+ + 2OH – = Cu(OH) 2 ↓

Химические свойства Cu ( O H) 2
Перечислите свойства нерастворимых оснований.
Составьте уравнения реакций гидроксида меди ( II ) с
растворами кислот (соляной и серной). Рассмотрите
реакции с точки зрения теории электролитической
диссоциации.
Cu(OH) 2 + Н 2 SO 4 = CuSO 4 + 2 H 2 O
опыт
Cu(OH) 2 + 2 Н + + SO 4 2– = Cu 2+ + SO 4 2– + 2 H 2 O
Cu(OH) 2 + 2 Н + = Cu 2+ + 2 H 2 O
Cu(OH) 2 + 2HCl = CuCl 2 + 2 H 2 O
Cu(OH) 2 + 2 Н + + 2Cl – = Cu 2+ + 2Cl – + 2 H 2 O
Cu(OH) 2 + 2 Н + = Cu 2+ + 2 H 2 O

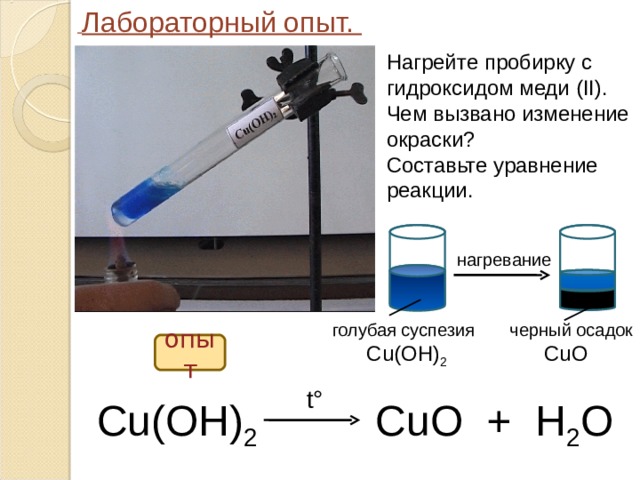
Лабораторный опыт.
Нагрейте пробирку с гидроксидом меди ( II ).
Чем вызвано изменение окраски?
Составьте уравнение реакции.
нагревание
голубая суспезия
Cu(OH) 2
черный осадок
CuO
опыт
t°
С u(OH) 2 CuO + H 2 O
 2 + 4H 2 O или Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img61.jpg)
Гидроксид меди ( II ) очень легко растворяется в избытке аммиака с образованием аммиаката меди. Аммиакат меди имеет интенсивный сине-фиолетовый цвет, поэтому его используют в аналитической химии для определения малых количеств ионов меди(II) в растворе.
Cu(OH) 2 + 4NH 4 OH = [Cu(NH 3 ) 4 ](OH) 2 + 4H 2 O
или
Cu(OH) 2 + 4NH 3 = [Cu(NH 3 ) 4 ](OH) 2

Гидроксид меди ( II ) при нагревании окисляет альдегиды до карбоновых кислот. При этом интенсивная окраска реактива исчезает и образуется кирпично-красный осадок оксида меди ( I ).
опыт
t°
Н-СОН + 2 Cu ( OH ) 2 HCOOH + Cu 2 О + 2 H 2 O
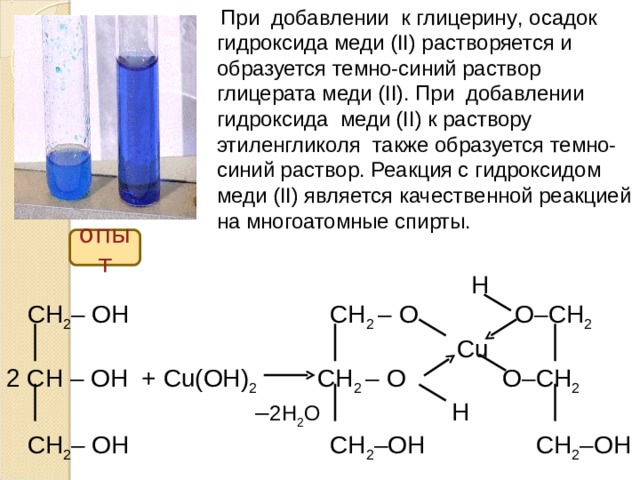
При добавлении к глицерину , осадок гидроксида меди (II) растворяется и образуется темно-синий раствор глицерата меди (II). При добавлении гидроксида меди (II) к раствору этиленгликоля также образуется темно-синий раствор. Реакция с гидроксидом меди (II) является качественной реакцией на многоатомные спирты.
опыт
H
СН 2 – ОН СН 2 – О O– СН 2
Cu
2 СН – ОН + Cu(OH) 2 СН 2 – О O– СН 2
– 2H 2 O H
СН 2 – ОН СН 2 –О H СН 2 – OH

Соли
Сульфат меди(II) (CuSO 4 ) — белые кристаллы, хорошо растворимые в воде. Однако из водных растворов, а также на воздухе хотя бы с незначительным содержанием влаги кристаллизуется голубой пентагидрат CuSO 4 · 5H 2 O — медный купорос. Благодаря этому свойству сульфат меди(II) иногда используется в качестве индикатора влажности помещения
опыт


Малахит (основной карбонат меди) – Cu 2 (OH) 2 CO 3
При нагревании до 200°С разлагается с выделением
углекислого газа и воды, превращаясь в черный оксид
меди ( II )
t°
Cu 2 (OH) 2 CO 3 2CuO + H 2 O + CO 2
опыт
![Для малахита характерна растворимость в кислотах с выделением углекислого газа, а также в аммиаке, который окрашивается при этом в голубой цвет. (CuOH) 2 CO 3 + 4 HCl = 2CuCl 2 + CO 2 + 3 H 2 O (CuOH) 2 CO 3 + 8(NH 3 ·H 2 O) = [Cu(NH 3 ) 4 ]CO 3 + +[Cu(NH 3 ) 4 ](OH) 2 + 8H 2 O С глубокой древности известен способ получения из малахита свободной меди. В условиях неполного сгорания угля, при котором образуется угарный газ, происходит реакция: 2CO+(CuOH) 2 CO 3 =3CO 2 +2Cu+ H 2 O](https://fsd.videouroki.net/html/2020/05/11/v_5eb9745a5fa09/img67.jpg)
Для малахита характерна растворимость в кислотах с выделением углекислого газа, а также в аммиаке, который окрашивается при этом в голубой цвет.
(CuOH) 2 CO 3 + 4 HCl = 2CuCl 2 + CO 2 + 3 H 2 O
(CuOH) 2 CO 3 + 8(NH 3 ·H 2 O) = [Cu(NH 3 ) 4 ]CO 3 + +[Cu(NH 3 ) 4 ](OH) 2 + 8H 2 O
С глубокой древности известен способ получения из малахита свободной меди. В условиях неполного сгорания угля, при котором образуется угарный газ, происходит реакция:
2CO+(CuOH) 2 CO 3 =3CO 2 +2Cu+ H 2 O


Медь можно обнаружить по зелёно-голубой окраске пламени .

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация на тему "Медь" в рамках подготовки к ЕГЭ по химии (6.85 MB)
Презентация на тему "Медь" в рамках подготовки к ЕГЭ по химии (6.85 MB)
 0
0 2939
2939 574
574 Нравится
0
Нравится
0



