
Белки
Преподаватель химии и биологии: Бикешева Анаргуль Жолдыбаевна
Актюбинский колледж промышленных технологий и управления

СОСТАВ БЕЛКОВ
Относительная молекулярная масса ( Mr ) белка может составлять от 10 тысяч до многих миллионов:
инсулин – 6500
белок вируса гриппа – 320 000 000.
Элементарный состав белка колебается незначительно (в % на сухую массу):
C - 51 - 53%,
O - 21,5 - 23,5%,
N - 16,8 - 18,4%,
H - 6,5 - 7,3%,
S - 0,3 - 2,5%.
Некоторые белки содержат P, Se , Fe и др.

ЧТО ТАКОЕ БЕЛОК?
Белок – это органическое соединение, состоящее из аминокислот, соединенных пептидной связью .
Белок – это полимер, мономерами которого являются аминокислоты, соединенные пептидной связью .

Основными структурными компонентами белков являются аминокислоты.
H H O
H C C C
H NH 2 OH
Аминокислоты различаются только радикалом.
Всего существует 20 аминокислот.
- NH 2 аминогруппа
- СООН карбоксильная группа

Строение некоторых аминокислот
Сокращён -
ное обозначение
Название кислоты
Формула
Глицин (аминоуксусная кислота)
гли
H 2 N-CH 2 -COOH
CH 3 -CH- COOH
|
NH 2
Аланин ( -аминоуксусная кислота)
ала
Цистеин ( -амино- -тиолпропионовая кислота)
цис
HS-CH 2 - CH-COOH
|
NH 2
сер
HO-CH 2 - CH-COOH
|
Серин ( -амино- -оксипропионовая кислота)
NH 2
Глутаминовая ( -аминоглутаровая кислота)
глу
HOOC-CH 2 -CH 2 - CH-COOH
|
NH 2
Лизин ( , -диаминокапроновая кислота)
лиз
NH 2 -CH 2 - CH 2 - CH 2 - CH 2 - CH-COOH
|
NH 2
фен
C 6 H 5 -CH 2 - CH-COOH
Фенилаланин ( -амино- -фенилпропионовая кислота)
|
NH 2
Тирозин ( -амино- -( n -оксифенил)- пропионовая кислота
тир
HO-C 6 H 4 -CH 2 - CH-COOH
|
NH 2

Образование пептидной связи
Аминокислоты могут реагировать друг с другом : карбоксильная группа одной аминокислоты реагирует с аминогруппой другой аминокислоты с образованием пептидной связи и молекулы воды.
NH 2 – CH 2 – COOH + NH 2 – CH 2 – COOH =
NH 2 – CH 2 – CO – NH – CH 2 – COOH + H 2 O
- Связь – CO – NH – между аминокислотами называется пептидной.
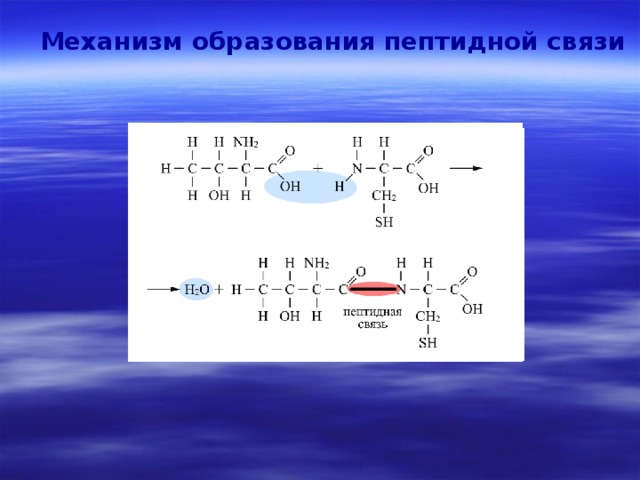
Механизм образования пептидной связи
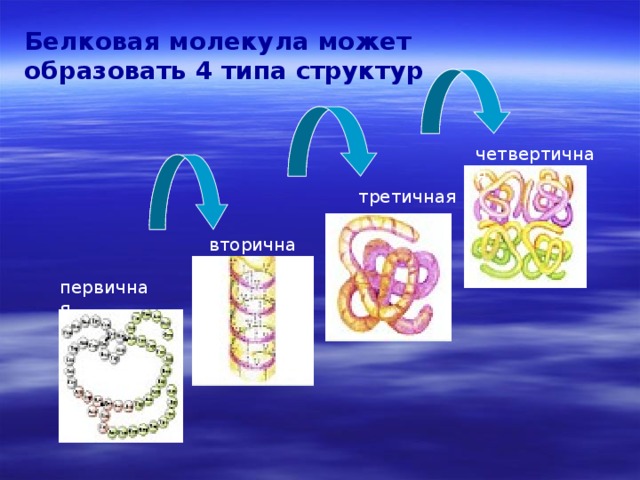
Белковая молекула может образовать 4 типа структур
четвертичная
третичная
вторичная
первичная
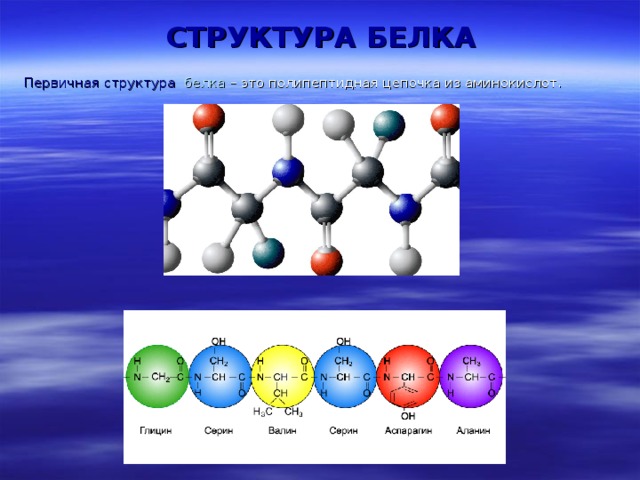
СТРУКТУРА БЕЛКА
Первичная структура белка – это полипептидная цепочка из аминокислот .
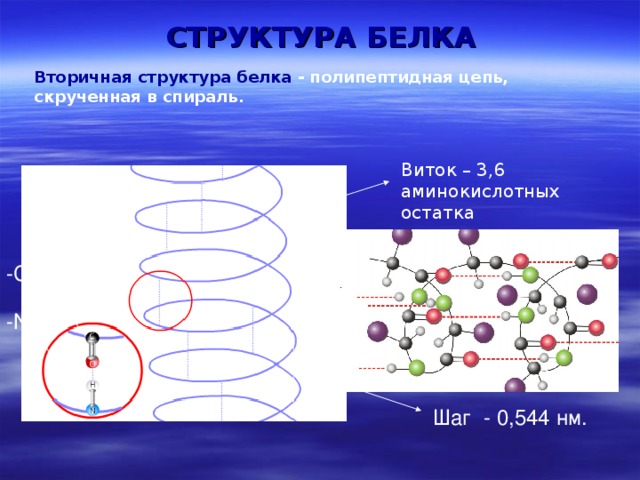
СТРУКТУРА БЕЛКА
Вторичная структура белка - полипептидная цепь, скрученная в спираль.
Виток – 3,6 аминокислотных остатка
-CO-
-NH-
Шаг - 0,544 нм.

СТРУКТУРА БЕЛКА
- Вторичная структура – возникает за счет скручивания первичной структуры в спираль или в гармошку за счет водородных связей между соседними витками или звеньями

СТРУКТУРА БЕЛКА
Третичная структура - трехмерная конфигурация закрученной в пространстве спирали полипептидной цепи (т. е. спираль, скрученная в спираль).
Третичная структура поддерживается связями, возникающими между функциональными группами радикалов.
- Дисульфидные мостики (-S-S-)
- Сложноэфирные мостики между (- COOH) и (- OH) .
- Солевые мостики между (- COOH) и ( - NH2) .
Третичная структура называется глобулой .

СТРУКТУРА БЕЛКА
- Третичная структура – это глобулярная форма, образующаяся за счет гидрофобных связей между радикалами аминокислот вторичной структуры

СТРУКТУРА БЕЛКА
Четвертичная структура - форма взаимодействия между несколькими полипептидными цепями.
Полипептидные цепи соединяются водородными, ионными,гидрофобными связями.
Пространственная структура определяет химические и биологические свойства белков!

СТРУКТУРА БЕЛКА
- Четвертичная структура – представляет собой объединение нескольких глобул с третичной структурой в единый конгломерат

Денатурация белка –
нарушение природной структуры белка.
Факторы вызывающие денатурацию белка: высокая температура, механическое воздействие, действие химических веществ и др.
ДЕНАТУРАЦИЯ – это необратимый процесс! При денатурации могут нарушаться четвертичная, третичная. Вторичная структуры белка.
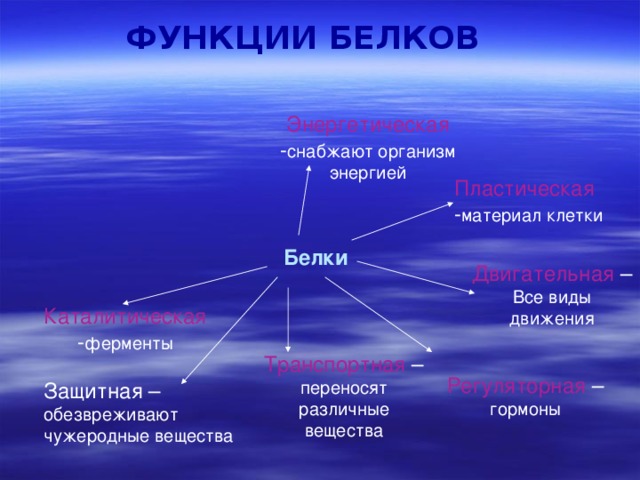
ФУНКЦИИ БЕЛКОВ
Энергетическая - снабжают организм энергией
Пластическая - материал клетки
Белки
Двигательная – Все виды движения
Каталитическая - ферменты
Транспортная – переносят различные вещества
Регуляторная – гормоны
Защитная – обезвреживают чужеродные вещества

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация на тему: " Белки и его свойства" (1.39 MB)
Презентация на тему: " Белки и его свойства" (1.39 MB)
 0
0 851
851 27
27 Нравится
0
Нравится
0


