План–конспект урока биологии для 10 класса
Тема: «Свойства и функции белков».
Цели урока:
Образовательная –сформировать знания об особенностях строения молекул белков, их важнейших свойствах и функциях; углубить и расширить знания о важнейшей роли белков в жизнедеятельности живых организмов; сформировать понятие о ферментах как биологических катализаторах
Развивающая–продолжить развитие умений использовать полученные знания, развитие способов коллективной деятельности, норм и правил общения. Продолжить развитие умений анализировать, сопоставлять, обобщать, систематизировать учебный материал. Развивать способность к мыслительной деятельности. Продолжить развитие интереса к предмету биология при помощи модульной технологии.
Воспитательная–продолжить воспитание самостоятельности в процессе учебы, ответственности за полученный результат.
Тип урока: комбинированный.
Методы, используемые на уроке: репродуктивные, частично - поисковые, проблемные.
Оборудование:
1.Мультимедийный проектор.
2. Мультимедийное приложение к учебнику «Биология. Общая биология»
3. Модель белка первичной и вторичной структуры белка.
4. Таблицы: «Строение белковой молекулы», «Состав клетки «Химические формулы аминокислот», «Структура белка»
5. Технологические карты.
Ход урока
Эпиграф на доске: «Жизнь есть способ существования белковых тел…» Ф. Энгельс.
1.Организационный момент: приветствие; план работы на урок; планируемые результаты работы.
Цель: концентрация внимания обучающихся; создание рабочего настроя на урок.
2. Актуализация опорных знаний: проверка домашнего задания.
1. Работа в парах: спроси своего соседа определения к трём терминам Термины, которые используются при проведении работы:
Биологические полимеры. Полимер. Мономер. Гидрофобное вещество. Гидрофильное вещество. Липопротеиды. Полисахариды. Моносахариды.
2. Задай вопрос : учащийся задаёт вопрос по теме домашнего задания любому ученику класса.
Сформулированные учащимися вопросы можно дополнить следующими:
1. Какие соединения называют углеводами?
2. Какова классификация углеводов? Назовите представителей каждой группы.
3. В составе, каких организмов (животных или растений) больше углеводов?
4. С каким процессом, протекающим в растительных организмах, связано большое содержание в них углеводов по сравнению с животными?
5. Какие углеводы служат энергетическим резервом у растений, какие у животных?
6. Назовите основные функции углеводов.
7. Функции липидов. Какие клетки и ткани наиболее богаты липидами?
3. Да или нет: выберите правильные утверждения (письменно в тетради):
1.Гликоген относится к полисахаридам
2. В состав углеводов входят следующие элементы: C, H, O, N
3.Для всех углеводов характерен сладкий вкус.
4. Глюкоза является мономером крахмала.
5.Полисахариды являются гидрофобными веществами.
6. Моносахариды являются гидрофильными веществами.
7. Растительные жиры – твердые вещества.
8. Одним из компонентов жира является глицерин.
9. Липиды гидрофильные вещества..
10. При расщеплении жиры выделяют в два раза больше энергии, чем углеводы.
11. Гликоген – это энергетический резерв в клетках животных
12. В клетках растений энергетическим резервом служит крахмал.
Ответы: 1,0,0,1,1,1,0,1,0,1,1,1.
3. Изучение нового материала.
Цель: изучение новый материал
В каждый миг и в нужный час
Всегда выручит он нас:
Когда надо, кровь свернет,
Кислород перенесет.
Гормон роста удивит:
Мать гиганта нам родит.
Как вы думаете, о чём идёт речь в данных сти
Как вы думаете, почему эпиграфом нашего урока является высказывание Ф. Энгельса?
Что же нам известно о белках из курса анатомии человека? Как наш организм получает белки? (Из продуктов питания)
Что происходит с белками в кишечнике? (Расщепляются до более растворимых веществ)
Что происходит с аминокислотами? (Поступают в кровь и разносятся по клеткам организма, где происходит синтез белка)
Эпиграф нашего урока выбран не случайно. Полностью это высказывание Ф. Энгельса звучит следующим образом: «Жизнь есть способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природы, причем с прекращением обмена веществ, прекращается и жизнь, что приводит к разложению белка». Белков в клетках больше, чем каких бы то ни было других органических соединений: на их долю приходится свыше 50% общей сухой массы клеток.
Белок является составной частью каждой клетки животного и растения. Это сложное вещество в состав которого входит азот. Ни жиры, ни углеводы азота не содержат, поэтому белки нельзя заменить никакими другими веществами. Белок — это основа жизни.
Человек получает белки с пищей животного и растительного происхождения и использует их в основном как пластический материал. Однако белки животного и растительного происхождения прежде чем стать белком человеческого организма претерпевают сложные изменения в процессе пищеварения и обмена веществ.
В пищеварительном тракте они расщепляются до аминокислот, которые всасываются в кровь. Из последних клетки нашего организма синтезируют своп белок, который отличается от белка животного и растительного происхождения и свойствен только человеку. Белки животного происхождения считаются более полноценными, так как входящие в них аминокислоты более близки к аминокислотам, из которых строятся белки организма человека.
Сегодня на уроке нам предстоит выяснить, каков же состав белковой молекулы?
Самостоятельная работа учащихся: послушать рассказ учителя, обратиться к технологической карте. Прочитав текст параграфа, дополнительный материал и посмотрев презентацию, выполнить задание №1.
Текст параграфа стр.42-44, презентация слайды 6, 8, 9, дополнительный материал 1.
Белки – это сложные органические соединения, состоящие из углерода, водорода, кислорода и азота. В некоторых белках содержится еще и сера. Часть белков образует комплексы с другими молекулами, содержащими фосфор, железо, цинк и медь. Поэтому белки можно классифицировать на:
а. гликопротеиды – аминокислоты + углеводы
б. липопротеиды – аминокислоты + жиры
в. нуклеопротеиды – аминокислоты + нуклеиновая кислота
г. металлопротеиды – аминокислоты + металлы (гемоглобин)
Молекулы белков – цепи, построенные из аминокислот, - очень велики; это макромолекулы, молекулярная масса которых колеблется от нескольких тысяч до нескольких миллионов. В природных белках встречаются двадцать различных аминокислот. Потенциально разнообразие белков безгранично, поскольку каждому белку свойственна своя особая аминокислотная последовательность, генетически контролируемая, то есть закодированная в ДНК клетки, вырабатывающей данный белок.
А как же происходит присоединение АК при образовании белковой молекулы с химической точки зрения?
У большей части аминокислот имеются одна кислотная группа (карбоксильная) и одна основная (аминогруппа); эти аминокислоты называют нейтральными. Существуют и основные аминокислоты – с более чем одной аминогруппой, а также кислые аминокислоты – с более чем одной карбоксильной группой. Остальная часть молекулы представлена R-группой. Ее строение у разных аминокислот сильно варьирует, и именно она определяет уникальные свойства каждой отдельной аминокислоты.
В нейтральных водных растворах аминокислоты ведут себя как амфотерные соединения, то есть проявляются свойства и кислот, и оснований. Амфотерная природа аминокислот существенна в биологическом отношении, так как она означает, что аминокислоты способны в растворах действовать как буферы – препятствовать изменениям рН.
Благодаря взаимодействию аминогруппы одной аминокислоты с карбоксильной группой другой образуется пептидная связь. Реакция, идущая с выделением воды, называется реакцией конденсации, а возникающая ковалентная азот - углеродная связь – пептидной связью.
Соединение, образующееся в результате конденсации двух аминокислот, представляет собой дипептид. На одном конце его молекулы находится свободная аминогруппа, а на другом – свободная карбоксильная группа. Благодаря этому дипептид может присоединять к себе другие аминокислоты. Если таким образом соединяется много аминокислот, то образуется полипептид. Белки это полипептиды, состоящие из сотен и тысяч аминокислот.
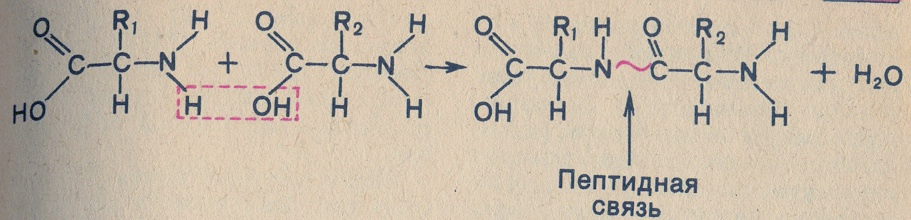
Аминокислота является мономером молекулы белка.
Структурная организация белковой молекулы.
Самостоятельная работа учащихся: послушать рассказ учителя, обратиться к технологической карте. Прочитав текст параграфа, дополнительный материал и посмотрев презентацию, выполнить задание №2, 3.
Текст параграфа стр.43-44, презентация слайды 10.
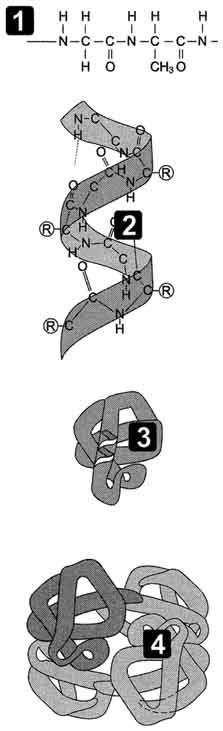
Для более полной характеристики строения молекулы белка необходимо знать его структуры. Каждому белку свойственна своя особая геометрическая форма, или конформация. Выделяют 4 структуры белка: первичную, вторичную, третичную, четвертичную.
Первичная структура. Под первичной структурой белка понимают число и последовательность аминокислот, соединенных друг с другом пептидными связями в полипептидной цепи. Первый белок, для которого удалось выяснить аминокислотную последовательность, как мы уже говорили – это инсулин, аминокислотная последовательность белка определяет его биологическую функцию. В свою очередь эта аминокислотная последовательность однозначно определяется нуклеотидной последовательностью ДНК. Замена одной-единственной аминокислоты в молекулах данного белка может резко изменить его функцию, как это наблюдается, например, при так называемой серповидноклеточной анемии.
Вторичная структура. Для всякого белка характерна помимо первичной, еще и определенная вторичная структура. Обычно белковая молекула напоминает растянутую пружину. Это так называемая α-спираль, стабилизируемая множеством водородных связей, возникающих между находящимися поблизости друг от друга СО- и NH-группами. Атом водорода NH-группы одной аминокислоты образует такую связь с атомом кислорода СО-группы другой аминокислоты, отстоящей от первой на четыре аминокислотных остатка. Таким образом , вторичная структура представляет собой вид спирали, которая образуется в результате скручивания полипептидной цепи за счет водородных связей .
Третичная структура. У большинства белков полипептидные цепи свернуты особым образом в компактную глобулу. Способ свертывания полипептидных цепей глобулярных белков называется третичной структурой. Третичная структура поддерживается связями трех типов – ионными, водородными и дисульфидными, а также гидрофобными взаимодействиями.
Четвертичная структура. Многие белки с особо сложным строением состоят из нескольких полипептидных цепей, удерживаемых в молекуле вместе за счет гидрофобных взаимодействий, а также при помощи водородных и ионных связей. Способ совместной упаковки и укладки этих полипептидных цепей называют четвертичной структурой белка. Четвертичная структура имеется, например, у гемоглобина. Его молекула состоит из четырех отдельных полипептидных цепей.
Таким образом, белки имеют весьма сложное строение и характеризуются полифункциональностью, что отражается на их свойствах.
Функции и свойства белков.
Самостоятельная работа учащихся: послушать рассказ учителя, обратиться к технологической карте. Прочитав текст параграфа, дополнительный материал и посмотрев презентацию, выполнить задание №4,5.
Текст параграфа стр.44-47, презентация слайды 11, 12, дополнительный материал 2.
Какая из всех перечисленных функций белков не встречалась при изучении углеводов и липидов? (Каталитическая)
Каталитическая функция – одна из наиболее важнейших функций белков. Все биохимические реакции протекают с огромной скоростью благодаря участию в них биокатализаторов – ферментов.
Определение: ферменты – это белки, обладающие каталитической активностью, то есть ускоряющие протекание реакций.
Каждый фермент обеспечивает одну реакцию или несколько реакций одного типа. Например, жиры в пищеварительном тракте ( а также внутри клеток) расщепляются специальным ферментом, который не действует на полисахариды (крахмал, гликоген) или на белки. Каждая молекула фермента способна осуществлять от нескольких тысяч до нескольких миллионов одинаковых операций в минуту. В ходе этих реакций ферментный белок не расходуется. Он соединяется с реагирующими веществами, ускоряет их превращения и выходит из реакций неизмененным.
Процесс превращения или синтеза любого вещества в клетке, как правило, разделен на ряд химических операций. Каждую операцию выполняет отдельный фермент. Группа таких ферментов составляет своего рода биохимический конвейер.
Закрепление изученного материала.
Постановка проблемных вопросов.
1. Почему врачи рекомендуют «сбивать» температуру больного, если она превышает 380С?
2. Почему из вареного яйца никогда не появится цыпленок?
А где можно использовать знания о свойствах денатурации белка?
1.Химическая завивка.
Белок волос состоит из полипептидных цепей, между которыми имеются дисульфидные мостики. Если волосы обработать каким либо восстановителем, то сульфидные мостики разрушаются. Волосы становятся мягкими, могут завиваться и их можно растянуть более чем в два раза. После завивки волосы обрабатывают окислителем. Дисульфидные мостики возникают вновь, закрепляя новую форму волос.
2.Обесцвечивание волос.
для обесцвечивания берут разбавленную перекись водорода, которая окисляет молекулы пигмента волос. Побочный эффект обесцвечивания заключается в образовании дополнительных дисульфидных мостиков. А это повышает хрупкость и ломкость волос.
3. Шерсть (белок кератин).
Если шерстяное изделие поместить в горячую воду, происходит разрыв дисульфидных связей, начинается свертывание полипептидных цепей в клубок. Говорят шерстяное изделие «садится».
4. Гемоглобин разрушается при температуре 400.
5. Свертывание крови.
Растворимый белок фибриноген превращается в нерастворимый белок фибрин.
Домашнее задание. Учебник стр.42-47.
Рефлексия.
Закончите фразу:
Лучше всех на уроке работал…
Ещё мне бы хотелось узнать о….
Знания, полученные на уроке, я могу использовать в…
Выберите цвет своей работы: красный (я был активен на уроке), жёлтый (я чувствовал себя неуверенно, работал мало), зелёный ( у меня возникло много вопросов, мне есть над чем поработать дома).
Технологическая карта к уроку «Свойства и функции белков».
Изучение состава белковой молекулы.
Цель: выяснить состав белковой молекулы.
Самостоятельная работа учащихся: послушать рассказ учителя, обратиться к технологической карте. Прочитав текст параграфа стр. 42-44, дополнитель-ный материал 1, посмотрев презентацию слайды 6,8,9, выполнить задание №1.
Дополнительный материал 1.
В клетках и тканях встречается свыше 170 различных аминокислот. В составе белков обнаруживаются лишь 26 из них; обычными же компонентами белка можно считать лишь 20 аминокислот. Они получили название «Волшебных». В отличие от растений животные не могут синтезировать все аминокислоты, в которых они нуждаются; часть из них они должны получать в готовом виде, то есть с пищей. Эти последние принято называть незаменимыми аминокислотами. Тот факт, что белки организмов построены из одних и тех же аминокислот – еще одно доказательство единства живого мира на земле. 20 разных аминокислот можно уподобить 20 буквам химического алфавита, из которых составлены слова длиной в 300-500 букв. С помощью 20 букв можно написать безграничное множество таких длинных слов. Если считать, что замена или перестановка одной буквы в слове придаст ему смысл, то число комбинаций в слове длинной в 500 букв составит 20500 . В каждой клетке содержится несколько тысяч разных видов белковых молекул и для каждой из них характерна строго определенная последовательность аминокислот. Именно порядок чередования аминокислот в данной белковой молекуле определяет ее особые физико-химические и биологические свойства. Для установления структуры белка прежде всего нужно знать какие из 20 аминокислот входят в его состав. Оказалось, что такие белки, как казеин молока, миозин мышц, альбумин яйца содержат набор всех 20 АК. В белке – ферменте инсулин – 18, в сальмине (белок из молок рыб) всего 7. в состав большинства белков входит 300-500 аминокислотных остатков, но есть и более крупные – 1500 и более АК. Аминокислоты имеют биологические названия (таблица) и краткое обозначение В настоящее время установлена последовательность АК в 500 белках. Первым на этом пути был английский ученый Фредерик Сенгер, который в 1955 году расшифровал строение белка инсулина, за что получил Нобелевскую премию и помог людям в борьбе с такой болезнью как сахарный диабет.
Задание №1: ответьте на поставленные вопросы или задания:
1. Какие химические элементы входят в состав белков?
2. Какое из перечисленных органических соединений является мономером белка: глюкоза, глицерин, жирные кислоты, аминокислоты, моносахариды.
3. Почему молекулы белка называются макромолекулами?
4. Запишите общую формулу аминокислот, укажите функциональные группы и их свойства.
5. В организации белковых молекул участвуют всего 20 аминокислот, а разнообразие белков огромно. Чем это объясняется?
6. Изобразите структуру дипептида и укажите пептидную связь.
Изучение структурной организации белковой молекулы.
Цель: выяснить особенности строения белковой молекулы.
Самостоятельная работа учащихся: послушать рассказ учителя, обратиться к технологической карте. Прочитав текст параграфа стр. 43-44 и посмотрев презентацию слайд 10, выполнить задание №2 и № 3.
Задание №2: вставьте пропущенные слова в предложения
Аминокислотную последовательность в составе полипептидной цепочки относят к____________________структуре белка. В результате образования водородных связей между – СО- и - Н- группами разных аминокислотных остатков большинство белков имеют спирали и это_______________ структура белка. Следующий уровень организации белковой молекулы________________________ возникает в результате соединения нескольких макромолекул с третичной структуры в сложный комплекс.
Задание №3: на рисунках 1,2,3,4 изображены структуры белковой молекулы. Напишите цифру и название каждой структуры.
Изучение функций и свойств белков.
Цель: изучить биологические функции белков.
Самостоятельная работа учащихся: послушать рассказ учителя, обратиться к технологической карте. Прочитав текст параграфа стр. 44-47 , дополнительный материал 2 и посмотрев презентацию слайды 11,12, выполнить задание №4, 5.
Дополнительный материал 2.
Природные белковые вещества очень разнообразны: некоторые белки – твердые вещества, нерастворимые в воде и солевых растворах; большинство белков жидкие, растворимые в воде ( например, альбумин – белок куриного яйца). Белки, растворяясь в воде, образуют коллоидные растворы. Добавление к раствору белка солей тяжелых металлов (ртути, свинца, меди) приводит к осаждении белка, не растворяющегося в воде. Поэтому для организма крайне вредны пары тяжелых металлов и их солей. Осаждение белка происходит так же кислотами (азотной, серной и др.), формалином и фенолом, а так же этиловым спиртом. При слабом нагревании белки тоже свертываются. Процессы осаждения и свертывания белков связаны с разрушением их вторичной, третичной структуры и четвертичной структуры, так как происходит разрыв связей, и белок при этом изменяет свое природное состояние. Эти процессы называют денатурацией белка.
Если под действием денатурирующего фактора не затрагивается первичная структура, то при возвращении белковых молекул в нормальные условия среды их структура полностью восстанавливается, т.е. происходит ренатурация. Способность белков к ренатурации лежит в основе раздражимости. При необратимой денатурации (разрушение первичной структуры) белки теряют свои свойства.
Задание № 4: ответьте на поставленные задачи:
- молекулы белков обладают свойством денатурации. Что это такое?
- под влиянием каких факторов происходит денатурация?
- зарисуйте структуру белковой молекулы в активном состоянии и после денатурации.
Задание 5: в тетради начертить таблицу: «Функции белков». По ходу урока и просмотра презентации заполнить ее.
| Функция | Определение | Белок |
| 1.Строительная(пластическая) |
| Каллоген |
| 2.Транспортная |
| Гемоглобин |
| 3.Защитная |
| Иммуноглобулин |
| 4.Двигательная |
| Миозин |
| 5.Регуляторная |
| Гормоны, н-р, инсулин |
| 6.Каталитическая (ферментативная) |
| Все ферменты, н-р, каталаза |
| 7.Энергетическая |
| 17,9 кДж |

 Получите свидетельство
Получите свидетельство Вход
Вход













 Урок биологии "Свойства и функции белков" (0.15 MB)
Урок биологии "Свойства и функции белков" (0.15 MB)
 0
0 3893
3893 408
408 Нравится
0
Нравится
0


