
Основные положения ТЭД
С.А. Аррениус- шведский химик.
В 1887 году сформулировал
основные положения ТЭД.
И.А. Каблуков – русский химик.
Ввел представление
о гидратации ионов.
В.А. Кистяковский – русский
химик. Объединил ТЭД
с теорией растворов
Д.И. Менделеева.
9 класс

1 положение ТЭД.
- Все вещества по способности проводить электрический ток в водных растворах или в расплавах делят на электролиты и неэлектролиты.
Распределите вещества на электролиты и неэлектролиты :
NaCl(р-р), глюкоза(р-р), NaOH(р-р), HCl(р-р), спирт(р-р), сахар(р-р)
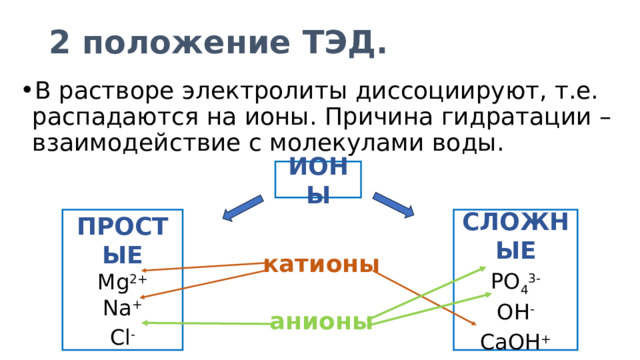
2 положение ТЭД.
- В растворе электролиты диссоциируют, т.е. распадаются на ионы. Причина гидратации – взаимодействие с молекулами воды.
ИОНЫ
ПРОСТЫЕ
СЛОЖНЫЕ
Mg 2+
PO 4 3-
Na +
OH -
CaOH +
Cl -
катионы
анионы

3 положение ТЭД.
- В результате диссоциации образуются гидратированные ионы, т.е. окружённые оболочкой из молекул воды.
кристаллы синего цвета
бесцветные кристаллы

4 положение ТЭД.
- Сильные и слабые электролиты по-разному диссоциируют на ионы.
Из приведённых формул веществ выпишите отдельно формулы сильных и слабых электролитов:
H 2 CO 3 , Al 2 (SO 4 ) 3 , HNO 2 , NaOH, Na 2 SO 3 , Ca(OH) 2
Mg(NO 3 ) 2 , NH 3 *H 2 O, KOH, NH 4 Cl

Кислоты как электролиты.
- Кислоты – электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка .
HBr = H + + Br -
HNO 3 = H + + NO 3 −
Многоосновные кислоты диссоциируют ступенчато:

Основания как электролиты.
- Основания – электролиты, которые при диссоциации образуют катионы металла (или ионы аммония) и гидроксид-анионы .
КОН = К + + ОН -
Са(ОН) 2 = Са 2+ + 2 ОН -
NaOH = Na + + OH -
Гидрат аммиака диссоциирует по-особому:

Соли как электролиты.
- Соли – сильные электролиты, которые при диссоциации образуют катионы металла (или аммония NH 4 + ) и анионы кислотных остатков.
NH 4 Cl = NH 4 + + Cl −
К 3 РО 4 = 3 К + + РО 4 3-
Кислые соли диссоциируют ступенчато:

Домашнее задание.
- Изучить п. 5 (Габриелян О.С., Остроумов И.Г., Сладков С.А., «Просвещение», 2024 г.)
- Выполнить письменно упражнения № 7, 8, 11

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к уроку по теме "Основные положения теории электролитической диссоциации" (8.73 MB)
Презентация к уроку по теме "Основные положения теории электролитической диссоциации" (8.73 MB)
 0
0 385
385 35
35 Нравится
0
Нравится
0





