
Всё познаётся в сравнении .
Тема урока : Гидролиз солей
Составил преподаватель химии
Бринцева С.В.
2017 год

Цели урока :
- Ознакомиться с понятием гидролиза солей.
- Рассмотреть типы гидролиза.
- Научиться составлять ионные уравнения гидролиза солей.
- Научиться определять тип гидролиза соли по её формуле.

- * Какие вещества называются электролитами?
- *Какие вещества называются неэлектролитами?
- * Что показывает степень электролитической диссоциации?
- * По степени диссоциации электролиты делятся?
- *Какие вы знаете индикаторы?

1. Результат взаимодействия воды с молекулами растворенного вещества.
2. Электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
3. Процесс распада электролитов на ионы.
4. Автор теории электролитической диссоциации.
5. Электролиты, диссоциирующие на катионы металла и гидроксид-анионы.
6. Вещества, которые в растворах распадаются на ионы.
7. Отрицательно заряженный ион.
8. Реакция между основанием и кислотой
9. Соль серной кислоты
10. Гомогенная система, состоящая из молекул воды и частиц растворенного вещества.
11. Электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
12. Растворимые основания.

Самооценка и оценка учащихся: нет ошибок – «5», 1-2 ошибки – «4», 3 ошибки и более – «3».
 [OH – ] [H+] [H + ] = [OH – ] pH =7 pH pH 7 " width="640"
[OH – ] [H+] [H + ] = [OH – ] pH =7 pH pH 7 " width="640"
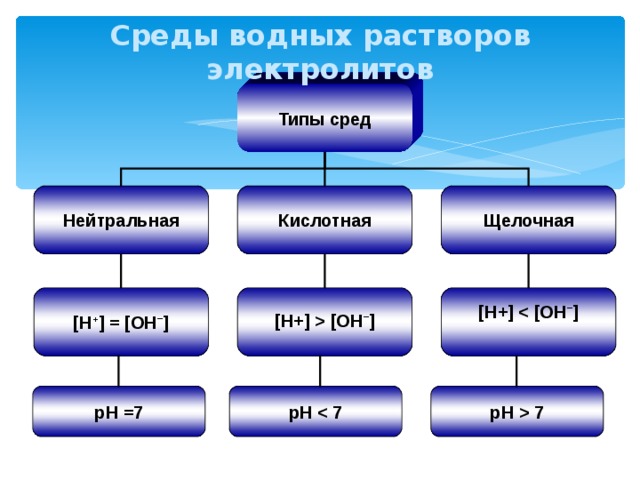
Среды водных растворов электролитов
Типы сред
Щелочная
Кислотная
Нейтральная
[H+] [OH – ]
[H+]
[H + ] = [OH – ]
pH =7
pH
pH 7
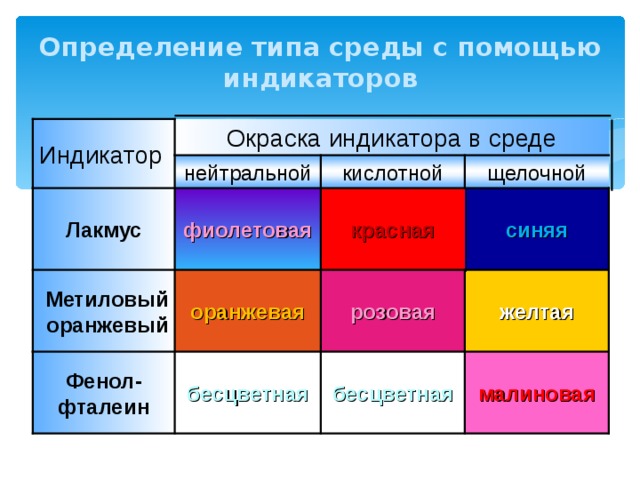
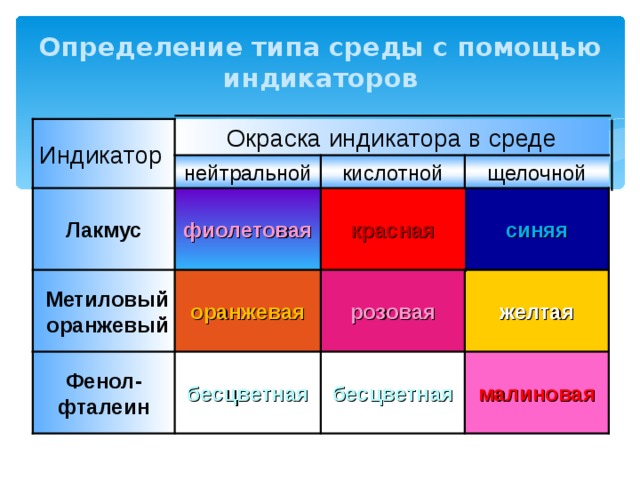
Определение типа среды с помощью индикаторов
Индикатор
Окраска индикатора в среде
нейтральной
кислотной
щелочной
красная
фиолетовая
Лакмус
синяя
розовая
оранжевая
Метиловый оранжевый
желтая
Фенол- фталеин
бесцветная
бесцветная
малиновая

Что такое гидролиз?
- Гидролиз
(от греческого hydro – вода ;
lysis – разложение)

Определение гидролиза
- Гидролиз соли – это химическая реакция обмена соли с водой , в результате которой ионы слабого электролита , входящие в состав соли , соединяются с составными частями воды : H + и OH - .
Гидролиз обратимый процесс.

 7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой нейтральная среда ( pH = 7) гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
7) гидролиз по аниону слабой кислотой Сильным основанием гидролиз по катиону 2. кислотная ( pH сильной кислотой Слабым основанием 3. нейтральная среда ( pH = 7) не подверга-ются гидро-лизу Сильным основанием сильная кислотой нейтральная среда ( pH = 7) гидролиз по катиону и аниону слабой кислотой 4. Слабым основанием " width="640"
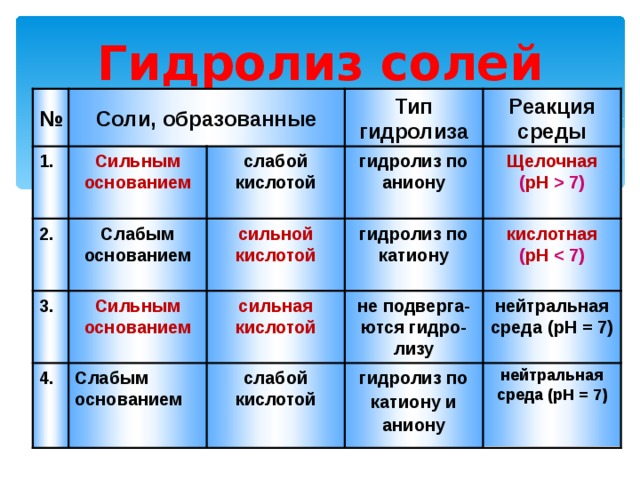
Гидролиз солей
№
Соли, образованные
Реакция среды
Тип гидролиза
1.
Щелочная ( pH 7)
гидролиз по аниону
слабой кислотой
Сильным основанием
гидролиз по катиону
2.
кислотная ( pH
сильной кислотой
Слабым основанием
3.
нейтральная среда ( pH = 7)
не подверга-ются гидро-лизу
Сильным основанием
сильная кислотой
нейтральная среда ( pH = 7)
гидролиз по
катиону и
аниону
слабой кислотой
4.
Слабым основанием

- Проблема: Чем можно объяснить различные среды растворов солей?
- Гипотеза : в водных растворах соли подвергаются гидролизу. Окраска раствора зависит от силы исходной кислоты и исходного основания.
- Объект исследования : процесс гидролиза солей.
- Предмет исследования : факторы, влияющие на окраску раствора солей .


Помни, каждый ученик, Знай, любая кроха: Безопасность — ……………., А халатность — ……….!

При работе с веществами не берите их …
И не пробуйте на … , реактивы не арбуз:
Слезет кожа с языка и отвалится рука

Чтобы опыт получился,
Пользуйся посудой … !

Меры предосторожности
Чай и вкусный бутерброд
Очень просятся в твой ...
Не обманывай себя –
Есть и … у нас нельзя!
Это, друг, химкабинет,
для еды условий нет.

Задания по группам:
1 группа: установить причину щелочной реакции среды раствора Na 2 CO 3
2 группа: установить причину кислой реакции среды раствора ZnSO 4
3 группа: проанализируйте состав соли CH 3 COONH 4
4 группа: установить причину нейтральной среды раствора Na Cl
Определение типа среды с помощью индикаторов
Индикатор
Окраска индикатора в среде
нейтральной
кислотной
щелочной
красная
фиолетовая
Лакмус
синяя
розовая
оранжевая
Метиловый оранжевый
желтая
Фенол- фталеин
бесцветная
бесцветная
малиновая
 7) По аниону «-» и по катиону «+» Кислая (рНZnSO 4 Сильная кислота CH 3 COONH 4 Нейтральная, кислая или щелочная - NaCL Нейтральная (рН=7) " width="640"
7) По аниону «-» и по катиону «+» Кислая (рНZnSO 4 Сильная кислота CH 3 COONH 4 Нейтральная, кислая или щелочная - NaCL Нейтральная (рН=7) " width="640"
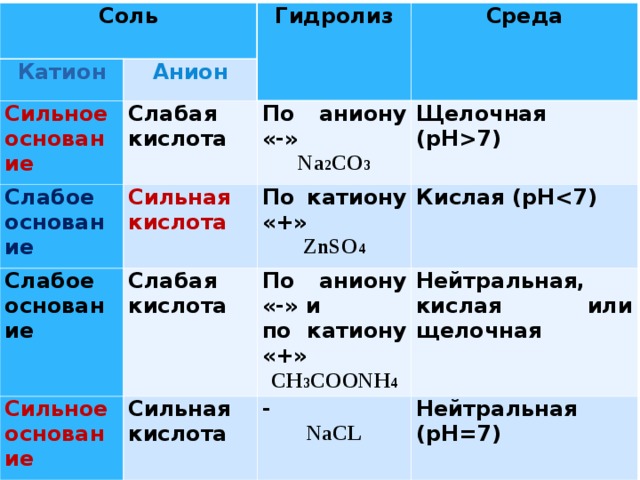
Соль
Катион
Анион
Сильное основание
Гидролиз
Среда
Слабая кислота
Слабое основание
Слабое основание
По аниону «-»
Сильная кислота
Сильное основание
Слабая кислота
По катиону «+»
Na 2 CO 3
Щелочная (рН7)
По аниону «-» и
по катиону «+»
Кислая (рН
ZnSO 4
Сильная кислота
CH 3 COONH 4
Нейтральная, кислая или щелочная
-
NaCL
Нейтральная (рН=7)

- Химический диктант
- - да, - нет

- 1. В чистой воде рН=7.
- 2. Раствор соляной кислоты – слабый электролит.
- 3. Na 2 CO 3 образован сильным основанием и слабой кислотой.
- 4. ALCL 3 образован слабым основанием и сильной кислотой.
- 5. Водный раствор соли NaCl имеет рН
- 6. Водный раствор соли K 2 SO 4 имеет рН=7.
- 7. Водный раствор соли Al 2 ( SO 4 ) 3 имеет рН
- 8. Соль KNO 3 подвергается необратимому гидролизу с выпадением осадка.
- 9. Раствор соли Na 2 SiO 3 при действии фенолфталеина окрасится в малиновый цвет.
- 10. Раствор соли K 2 SO 3 при действии фенолфталеина остается бесцветным

Оценки по оценочной шкале:
«5» - 9-10 правильных ответов,
«4» - 7-8 правильных ответов,
«3» - 5-6 правильных ответов .

Домашнее задание
- 1 . Придумать 4 соли, дающих разную среду при гидролизе и записать уравнения их взаимодействия с водой
- 2.Написать уравнение реакций взаимодействия с водой следующих солей:
- С aC О 3 ; AlCI 3 ; MgSO 4 ; (CH 3 COO) 2 Fe .

Уже прозвенел долгожданный звонок,
Увы, но к концу подошел наш урок.
А я благодарность вам всем объявляю,
Большое спасибо я вам говорю.
Мы цели достигли. Благодарю!


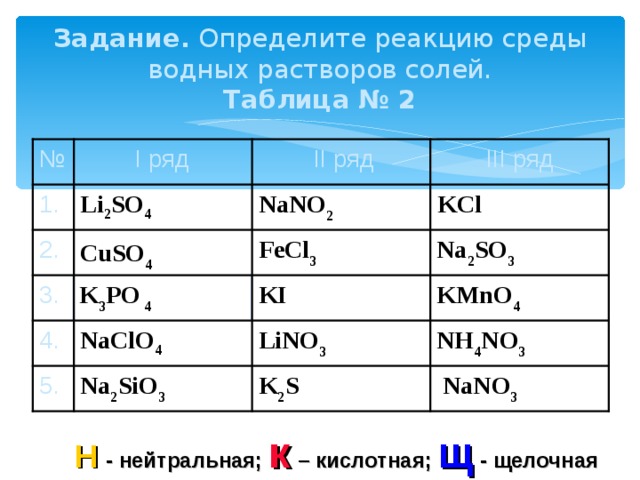
Задание. Определите реакцию среды водных растворов солей. Таблица № 2
II ряд
III ряд
I ряд
№
KCl
NaNO 2
Li 2 SO 4
1.
FeCl 3
2.
Na 2 SO 3
CuSO 4
KMnO 4
KI
3.
K 3 PO 4
NH 4 NO 3
NaClO 4
LiNO 3
4.
Na 2 SiO 3
5.
NaNO 3
K 2 S
Н - нейтральная; к – кислотная; щ - щелочная

Задание. Определите реакцию среды водных растворов солей. Таблица № 2
III ряд
№
II ряд
I ряд
KCl
NaNO 2
Li 2 SO 4
1.
Н
Н
Щ
Na 2 SO 3
2.
CuSO 4
FeCl 3
Щ
К
К
3.
KI
KMnO 4
K 3 PO 4
Щ
Н
Н
NH 4 NO 3
LiNO 3
NaClO 4
4.
Н
К
Н
Na 2 SiO 3
K 2 S
5.
NaNO 3
Щ
Щ
Н
н -нейтральная; к – кислотная; щ - щелочная

 Получите свидетельство
Получите свидетельство Вход
Вход












 Презентация к уроку по теме:"Гидролиз солей" (2.34 MB)
Презентация к уроку по теме:"Гидролиз солей" (2.34 MB)
 0
0 2245
2245 139
139 Нравится
0
Нравится
0


