

В одном мгновенье видеть вечность, Огромный мир – в зерне песка, В единой горсти – бесконечность И небо - в чашечке цветка.
Тема: Строение атома.
Цель урока: изучить строение атома

Проблемный вопрос:
Что такое атом? Как он устроен?

Строение атома
Демокрит
460 – 370 до н.э.
Э. Резерфорд
1871-1937гг.
Дж. Дж. Томсон
Дж. Чедвик
1824-1907гг.
1891-1974гг.

Гипотеза о том, что вещества состоят из большого числа атомов, зародилась свыше двух тысячелетий назад.
Позиция Демокрита:
«Существует предел деления – атом».
Позиция Аристотеля:
« Делимость вещества бесконечна».

Модель строения атома Томсона
- Атом – шар, по всему объёму которого равномерно распределён положительный заряд.
- Внутри шара находятся электроны.
- Каждый электрон может совершать колебательные движения около своего положения равновесия.
- Положительный заряд шара равен по модулю суммарному заряду электронов, поэтому заряд атома в целом равен нулю.

Модель атома Томсона
Далее

Модель атома Томсона
Атом представляет собой непрерывно заряженный положительным зарядом шар радиуса порядка 10 -10 м, внутри которого около своих положений равновесия колеблются электроны.
Недостатки модели:
- не объясняла дискретный характер излучения атома и его устойчивость;
- не дает возможности понять, что определяет размеры атомов;
- оказалась в полном противоречии с опытами по исследованию распределения положительного заряда в атоме (опыты, проводимые Эрнестом Резерфордом).
Джозеф Джон Томсон
(1856 – 1940)

Резерфорд Эрнест (1871–1937)
– английский физик, основоположник ядерной физики. Его исследования посвящены атомной и ядерной физике, радиоактивности.
Своими фундаментальными открытиями в этих областях заложил основы современного учения о радиоактивности и теории строения атома.
В 1899 г. открыл альфа - и бета-лучи. Вместе с Ф. Содди в 1903 г. разработал теорию радиоактивного распада и установил закон радиоактивных превращений. В 1903 г. доказал, что альфа-лучи состоят из положительно заряженных частиц. Предсказал существование трансурановых элементов.
В 1908 г. ему была присуждена Нобелевская премия.
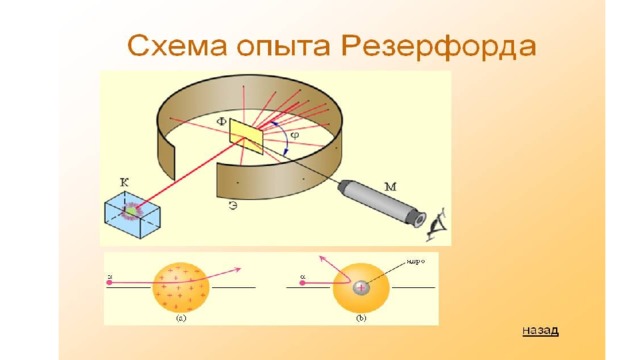

Идея опыта Резерфорда:
- Зондировать атом альфа–частицами.
- Альфа-частицы возникают при распаде радия.
- Масса альфа-частицы в 8000 раз больше массы электрона.
- Электрический заряд альфа-частицы в 2 раза больше заряда электрона.
- Скорость альфа-частицы около 15 000 км/с.
- Альфа-частица является ядром атома гелия .

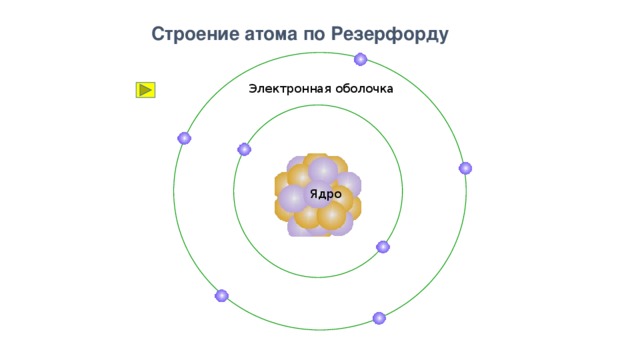
Строение атома по Резерфорду
Электронная оболочка
Ядро

Планетарная модель атома (солнечная)

Особенности планетарной модели:
1. Атом пустой, состоит из расположенного в его центре заряженного ядра и обращающихся вокруг него электронов.
2. Ядро имеет положительный заряд; его размеры в десятки тысяч раз меньше размеров атома, и обладают массой, составляющей 99,96% массы всего атома.
3. Вокруг ядра под действием кулоновских электрических сил вращаются электроны, которые имеют отрицательный заряд, так что в целом атом нейтрален.

Джеймс Чедвик является английским физиком, учеником Эрнеста Резерфорда. В 1932 он открыл нейтроны. Существование данной частицы предсказывал еще Резерфорд за 10 лет до опытов Чедвика. Новая частица отличается от протонов, открытых еще Резерфордом в 1919 году, электрическими свойствами, но очень близка к ним по массе и размеру. Чедвик доказал, что ядра атомов тоже делимы! Они состоят из протонов и нейтронов, которые связаны между собой мощным ядерным воздействием. Так как в целом атом электрически нейтрален, а заряд протона равен модулю заряда электрона, то число протонов в ядре равно числу электронов в атомной оболочке.
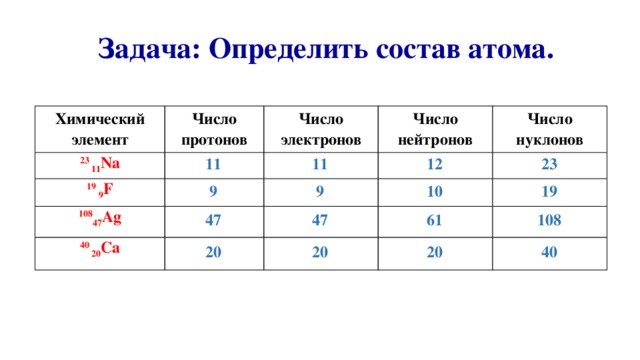
Задача: Определить состав атома.
Химический элемент
Число протонов
23 11 Na
Число электронов
19 9 F
Число нейтронов
108 47 Ag
Число нуклонов
40 20 Ca
11
9
11
12
47
9
23
20
10
47
19
61
20
108
20
40

Проблемный вопрос:
Что такое атом? Как он устроен?

Эрнест Резерфорд

Быть может, эти электроны-
Миры, где пять материков,
Искусства, знанья, войны, троны
И память сорока веков.
Еще, быть может, каждый атом -
Вселенная, где сто планет,
Там все, что здесь, в объеме сжатом,
Но так же то, чего здесь нет.
Их меры малы, но все та же
Их бесконечность, как и здесь,
Там скорбь и страсть, как здесь, и даже,
Там та же мировая спесь.
Их мудрецы, свой мир бескрайний
Поставив центром бытия,
Спешат проникнуть в искры тайны,
И умствуют, как ныне я.


 Получите свидетельство
Получите свидетельство Вход
Вход




































 Презентация по физике на тему "Строение атома" (19.28 MB)
Презентация по физике на тему "Строение атома" (19.28 MB)
 1
1 1676
1676 114
114 Нравится
0
Нравится
0


