
Тема: Основания

Повторение
1. Дать определение оксидам
2. Классификация оксидов
3.Как дается название оксидов?
CaO, Na2O, СО2, SO3 , N2O5
4 .Способы получения оксидов
5.Какие химические свойства характерны для:
-кислотных оксидов
-основных оксидов

Цель урока:
- 1. Познакомить учащихся с новым классом неорганических соединений – основаниями.
- 2. Рассмотреть классификацию, состав и номенклатуру оснований .
- 3.Химические свойства и получение оснований.

Основания
– это сложные вещества, состоящие из металлов и связанных с ними одного или нескольких гидроксид-ионов.

Схема образования гидроксида натрия:

Номенклатура:
Название металла в родительном падеже
валентность римскими цифрами
Название
основания
Гидроксид
- Ca(OH) 2 – гидроксид кальция
- Fe(OH) 2 – гидроксид железа ( II)
- Fe(OH) 3 – гидроксид железа ( III)
Al(OH) 3
Zn(OH) 2
Cu(OH) 2
CuOH
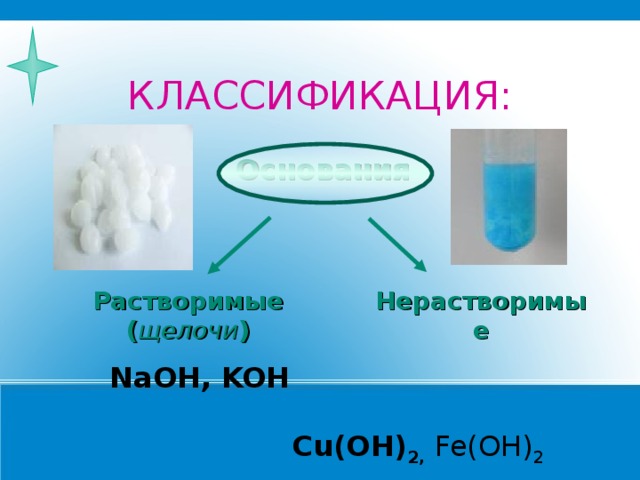
КЛАССИФИКАЦИЯ:
Основания
Растворимые ( щелочи )
Нерастворимые
NaOH, KOH Cu(OH) 2 , Fe(OH) 2

Получение
- 1.Расстворимые в воде основания -щелочи
А) активный металл + вода
2Na + 2НOH = 2NaOH +Н 2
Б)основной оксид + вода
СаО + Н 2 О = Са(ОН)2
В) электролиз растворов хлоридов активных металлов
- 2. Нерастворимые в воде основания
- Соль+основание
- FeCL 3 +3 NaOH =Fe( OH ) 3 ↓+3NaCL
- CuSO 4 + 2NaOH = Cu(OH) 2 ) ↓ + Na 2 SO 4

Физические свойства щелочей
Гидроксиды щелочных металлов (едкие щёлочи) представляют собой твердые, белые, очень гигроскопичные вещества. Щёлочи — сильные основания, очень хорошо растворимые в воде, причём реакция сопровождается значительным тепловыделением. Сила основания и растворимость в воде возрастает с увеличением радиуса катиона в каждой группе периодической системы. Кроме того, едкие щёлочи растворимы в этаноле и метаноле.

Индикаторы –
вещества под действием других веществ изменяют окраску.
Качественные реакции для щелочей
Нейтральная среда
Индикатор
Щелочная среда
Лакмус
фиолетовый
синий
Метиловый оранжевый
оранжевый
жёлтый
Фенолфталеин
бесцветный
малиновый

Химические свойства
1.С кислотами
Основание + кислота = Соли + вода
NaOH + HCl = NaCl + H 2 O
Реакцию между кислотой и основанием, в результате которой образуется соль и вода, называются реакциями нейтрализации
2. С солями
Щёлочь + соли = (новое) основание + (новая) соль.
Ba(OH) 2 + Na 2 SO 4 = BaSO 4 + 2NaOH
3. Слабые основания при нагреве разлагаются :
Cu(OH) 2 = CuO + H 2 O

4. С кислотными оксидами Щёлочь + кислотный оксид = соль + вода (р-ция обмена)
Ca(OH) 2 + CO 2 = CaCO 3 + H 2 O
Р 2 О 5 + 6КОН = 2К 3 РО 4 + 3Н 2 О

Закрепление
1. Что такое основание?
2. Какими по растворимости бывают основания?
3. Каким оксидам соответствуют основания?
4. Составить основания и назвать:
K 2 O , BaO , Cr 2 O 3 .
5. Составить оксиды и назвать:
LiOH , Ca ( OH) 2 .

Установите соответствие
Гидроксид кальция
KOH
Mg(OH) 2
Гидроксид железа (III)
Ca(OH) 2
Гидроксид натрия
Fe(OH) 3
Гидроксид магния
NaOH
Гидроксид калия

Щёлочи
Щёлочи — гидроксиды щелочных и щелочноземельных металлов и аммония. К щелочам относят хорошо растворимые в воде основания. При диссоциации щелочи образуют ионы OH − и ион металла.
К щелочам относятся гидроксиды металлов подгрупп I-ой и II-ой периодической системы, например NaOH (едкий натр), KOH (едкое кали), Ba(OH) 2 . Едкие щёлочи — тривиальное название гидроксидов лития LiOH, натрия NaOH, калия КОН, рубидия RbOH, и цезия CsOH.

Применение

§31, упр.1,6 с.99
ДОМАШНЕЕ ЗАДАНИЕ


 Получите свидетельство
Получите свидетельство Вход
Вход




























 Презентация к уроку химии "Основания" (1.87 MB)
Презентация к уроку химии "Основания" (1.87 MB)
 0
0 612
612 56
56 Нравится
0
Нравится
0


