Практическая работа 5.
Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов.
Предварительное пояснение
В этой работе мы будем получать соединения, которые содержат углерод: это углекислый газ и угольная кислота. В качестве исходных веществ мы будем использовать соли угольной кислоты. Напомню, что соли – это производные от кислот, когда металл замещает ионы водорода, а кислотный остаток остается на своем месте. Такие соли называют средними. Все соли, с которыми вы когда-либо работали, были средними. Но существует еще две разновидности солей:
соли, полученные из кислот, где металл заместил не все ионы водорода – кислые NаHCO3, гидрокарбонат натрия.
соли, полученные из оснований, где не все группы –ОН заместились кислотным остатком – основные (СuOH)2CO3 дигидроксокарбонат меди (II), или основный карбонат меди.
Цель работы: получить углекислый газ в л.у. и изучить его свойства, научиться распознавать карбонат-ионы (СО32-) в растворах.
Оборудование: малахит (основный карбонат меди) (СuOH)2CO3 , известковая вода Ca(OH)2, спиртовка, штатив, пробирка с газоотводной трубкой, гидрокарбонат натрия NаHCO3, лучинка, растворы K2СО3, AgNO3, K3PO4.
Ход работы
1.Получение углекислого газа разложением основного карбоната меди и его распознавание с помощью известковой воды.
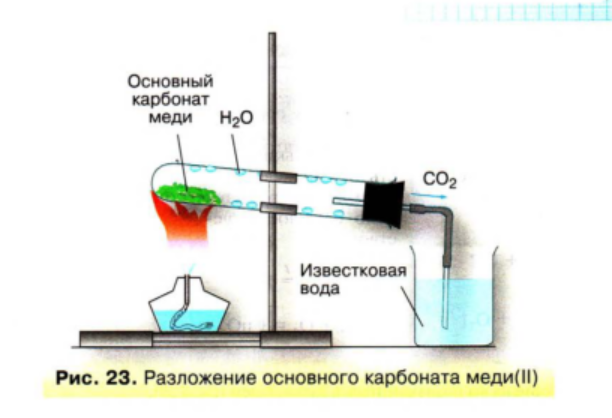
(СuOH)2CO3 → 2СuO + H2O + CO2↑
зеленый черный
СO2 + Ca(OH)2 = CaCO3 ↓ + H2O
прозрачный белый
2. Получение углекислого газа действием соляной кислоты на гидрокарбонат натрия и его распознавание по затуханию горящей лучинки.
HCl

 NaHCO3 + HCl = NaCl + H2O + CO2↑
NaHCO3 + HCl = NaCl + H2O + CO2↑
NaHCO3
3. Распознавание карбонат-ионов в растворе
|
| HCl
|
| K2СО3 | K2СО3 + 2HCl = 2KCl + H2O + CO2↑
|
| AgNO3 | AgNO3 + HCl = AgCl↓ + HNO3
|
| K3PO4 | K3PO4 + HCl ≠ |
Вывод: углекислый газ в л.у. получают разложением основного карбоната меди или действием соляной кислоты на карбонаты. Углекислый газ не имеет ни цвета, ни запаха, он тяжелее воздуха. Его распознают по помутнению известковой воды или затуханию горящей лучинки. Карбонат-ионы распознают по характерному «вскипанию» раствора, которое получается из-за образующегося углекислого газа. Для распознавания карбонат-ионов можно использовать растворимые кислоты.
ДЗ:
подготовить письменное сообщение на одну из тем:
Устройство углекислотного огнетушителя.
Изобретение противогаза Зелинским.
Как работает активированный уголь.
Карат – единица массы драгоценных камней.
Химический состав тонера для лазерного принтера.

 Получите свидетельство
Получите свидетельство Вход
Вход












 Практическая работа 6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов. (169.59 KB)
Практическая работа 6. Получение оксида углерода (IV) и изучение его свойств. Распознавание карбонатов. (169.59 KB)
 0
0 1761
1761 81
81 Нравится
0
Нравится
0


