
Готовимся к ЕГЭ
Окислительно-восстановительные реакции

Окислительно-восстановительные реакции (ОВР) -
– химические реакции, в которых происходит изменение степеней окисления атомов, входящих в состав реагирующих веществ.

Степень окисления
- Степень окисления атомов элементов простых веществ равна нулю
- Степень окисления водорода в соединениях +1, кроме гидридов
- Степень окисления кислорода в соединениях -2, кроме пероксидов и соединений с фтором
- Сумма всех степеней окисления атомов в соединении равна нулю
- Сумма всех степеней окисления атомов в ионе равна значению заряда иона
Mg º, Cl 2 º, O 2 º
+1 +1 -1
HCl, H 2 O, NaH
-2 -1 +2
H 2 O, Н 2 О 2 , OF 2
+1 +6 -2
H 2 SO 4
2(+1) +6+4(-2)=0
+6 -2
SO 4
6+4(-2)=-2
 реакция не окислительно-восстановительная +4 -2 +1 -1 +2 -1 0 +1 -2 PbO 2 + 2HCl → PbCl 2 + Cl 2 + 2H 2 O Степень окисления изменяется = реакция окислительно-восстановительная " width="640"
реакция не окислительно-восстановительная +4 -2 +1 -1 +2 -1 0 +1 -2 PbO 2 + 2HCl → PbCl 2 + Cl 2 + 2H 2 O Степень окисления изменяется = реакция окислительно-восстановительная " width="640"
Распознавание уравнений ОВР
- Запишите значения степеней окисления атомов всех элементов в уравнении реакции
- Определите изменяется ли степень окисления атомов элементов.
+2 -2 +1 -1 +2 -1 +1 -2
PbO + 2HCl → PbCl 2 + H 2 O
Степень окисления не изменяется = реакция не окислительно-восстановительная
+4 -2 +1 -1 +2 -1 0 +1 -2
PbO 2 + 2HCl → PbCl 2 + Cl 2 + 2H 2 O
Степень окисления изменяется = реакция окислительно-восстановительная
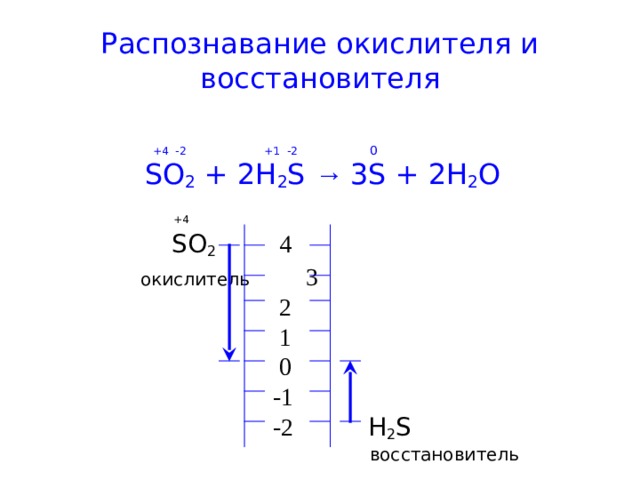
Распознавание окислителя и восстановителя
+4 -2 +1 -2 0
SO 2 + 2H 2 S → 3S + 2H 2 O
+4
SO 2 4
окислитель 3
2
1
0
-1
-2 H 2 S
восстановитель

Метод электронного баланса
+4 -2 +1 -2 0
SO 2 + 2H 2 S → 3S + 2H 2 O
+4 0 +4 _ 0
S → S S +4 e → S 1
_
+4 → 0 взял e – восстановление
+4 +(-4)=0
-2 0 -2 _ 0
S → S S – 2 e → S 2
_
-2 → 0 отдал e – окисление
-2 - (-2)=0
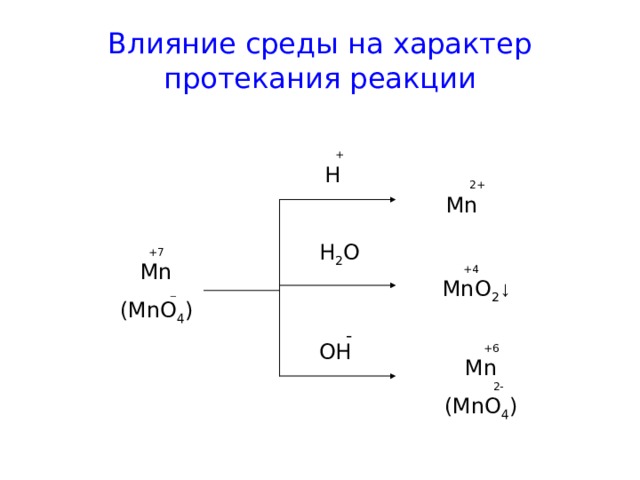
Влияние среды на характер протекания реакции
+
H
2 +
Mn
H 2 O
+7
Mn
_
(MnO 4 )
+4
MnO 2 ↓
-
OH
+6
Mn
2-
(MnO 4 )

Используя метод электронного баланса, составьте уравнение реакции: FeSO 4 +KMnO 4 +…→…+K 2 SO 4 +K 2 MnO 4
- Степень окисления Mn изменяется от +7 до +6 в щелочной среде!
- FeSO 4 окисляется в щелочной среде до Fe ( OH ) 3
- FeSO 4 +KMnO 4 + 3 KOH→ Fe ( OH ) 3 +K 2 SO 4 +K 2 MnO 4
- FeSO 4 – восстановитель, KMnO 4 – окислитель

Используя метод электронного баланса, составьте уравнение p еакции: Zn+KMnO 4 +…→…+K 2 SO 4 +MnSO 4 +Н 2 О
- Степень окисления Mn изменяется от +7 до + 2 в кислой среде!
- Электронный баланс:
Mn +7 + 5 e - → Mn +2 2
Zn 0 – 2e - → Zn +2 5
- 5Zn+2KMnO 4 +8H 2 SO 4 →5ZnSO 4 +
+K 2 SO 4 +2MnSO 4 + 8 Н 2 О

Используя метод электронного баланса, составьте уравнение реакции: K 2 SO 3 +KMnO 4 +…→…+MnO 2 +…
- Степень окисления Mn изменяется от +7 до + 4 в нейтральной среде!
- Электронный баланс:
Mn +7 + 3 e - → Mn +4 2
S +4 – 2e - → S +6 3
3K 2 SO 3 +2KMnO 4 +H 2 O→3K 2 SO 4 +2MnO 2 + 2K О H
![Влияние среды на характер протекания реакции + H 3 + Cr H 2 O + 6 Cr 2- (Cr 2 O 7 ) 2- (CrO 4 ) Cr(OH) 3 ↓ - OH [Cr(OH) 6 ] 3-](https://fsd.videouroki.net/html/2020/11/04/v_5fa28a03b54e7/img10.jpg)
Влияние среды на характер протекания реакции
+
H
3 +
Cr
H 2 O
+ 6
Cr
2-
(Cr 2 O 7 )
2-
(CrO 4 )
Cr(OH) 3 ↓
-
OH
[Cr(OH) 6 ] 3-

Используя метод электронного баланса, составьте уравнение p еакции: H 2 S+K 2 Cr 2 O 7 +…→…+Cr 2 (SO 4 ) 3 +…+H 2 O
- Соли Cr ( III ) образуются в кислой среде!
- Электронный баланс:
2Cr + 6 + 6e - → 2Cr + 3 1
S -2 – 2e - → S 0 3
3H 2 S+K 2 Cr 2 O 7 +4H 2 SO 4 →
3S ↓ +Cr 2 (SO 4 ) 3 +K 2 SO 4 +7H 2 O

Используя метод электронного баланса, составьте уравнение p еакции: H 2 S+K 2 CrO 4 +…→…+Cr(OH) 3 ↓ +KOH
- Гидроксид хрома( III ) образуется в нейтральной среде.
- Электронный баланс:
Cr + 6 +3 e - → Cr + 3 2
S -2 – 2e - → S 0 3
3H 2 S+2K 2 CrO 4 +2H 2 O →3S ↓ +2Cr(OH) 3 ↓ +4KOH
![Используя метод электронного баланса, составьте уравнение p еакции: K 2 CrO 4 +H 2 O 2 +…→K 3 [Cr(OH) 6 ]+O 2 ↑+… Комплексный анион [Cr(OH) 6 ] 3- образуется в щелочной среде. Электронный баланс: Cr + 6 +3 e - → Cr + 3 2 2O -1 – 2e - → O 2 3 2K 2 CrO 4 +3H 2 O 2 +2KOH+2H 2 O →2K 3 [Cr(OH) 6 ]+3O 2 ↑ Т.к. в правой части уравнения в составе гидроксокомплекса содержится уже 6 атомов водорода, вода переносится в левую часть уравнения.](https://fsd.videouroki.net/html/2020/11/04/v_5fa28a03b54e7/img13.jpg)
Используя метод электронного баланса, составьте уравнение p еакции: K 2 CrO 4 +H 2 O 2 +…→K 3 [Cr(OH) 6 ]+O 2 ↑+…
- Комплексный анион [Cr(OH) 6 ] 3- образуется в щелочной среде.
- Электронный баланс:
Cr + 6 +3 e - → Cr + 3 2
2O -1 – 2e - → O 2 3
2K 2 CrO 4 +3H 2 O 2 +2KOH+2H 2 O →2K 3 [Cr(OH) 6 ]+3O 2 ↑
Т.к. в правой части уравнения в составе гидроксокомплекса содержится уже 6 атомов водорода, вода переносится в левую часть уравнения.

Используя метод электронного баланса, составьте уравнение p еакции: NaCrO 2 +…+NaOH→…+NaBr +H 2 O
- Соединения хрома( III ) при окислении в щелочной среде образуют хроматы ( CrO 4 2- ) . Степень окисления хрома увеличивается от +3 до +6, следовательно NaCrO 2 является восстановителем, а окислителем будет служить Br 2 , степень окисления которого снижается от 0 до -1.
- Электронный баланс:
Cr +3 -3e - → Cr +6 2
Br 2 +2e - →2Br - 3
- 2NaCrO 2 +3Br 2 +8NaOH→2 Na 2 CrO 4 +6NaBr +4H 2 O
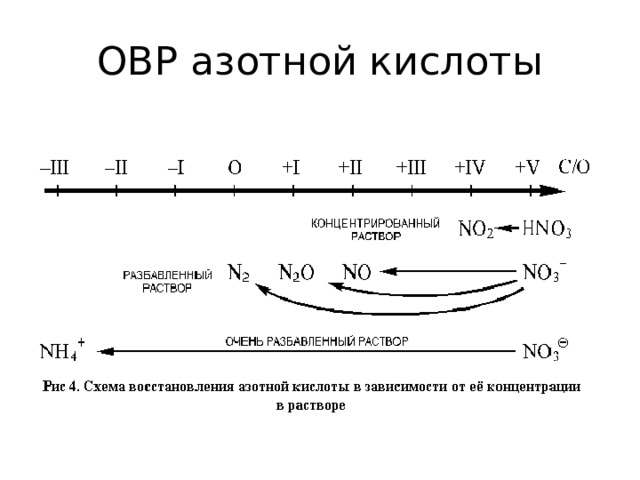
ОВР азотной кислоты
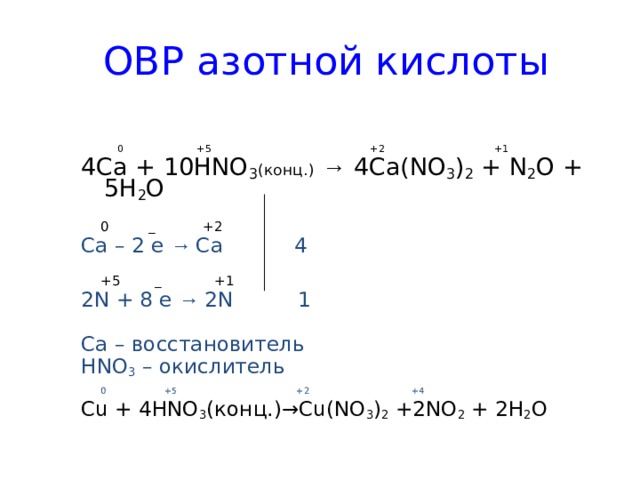
ОВР азотной кислоты
0 +5 +2 +1
4Ca + 10HNO 3 ( конц. ) → 4 Ca(NO 3 ) 2 + N 2 O + 5H 2 O
0 _ +2
Ca – 2 e → Ca 4
+5 _ +1
2N + 8 e → 2N 1
Ca – восстановитель
HNO 3 – окислитель
0 +5 +2 +4
Cu + 4HNO 3 ( конц .)→Cu(NO 3 ) 2 +2NO 2 + 2H 2 O
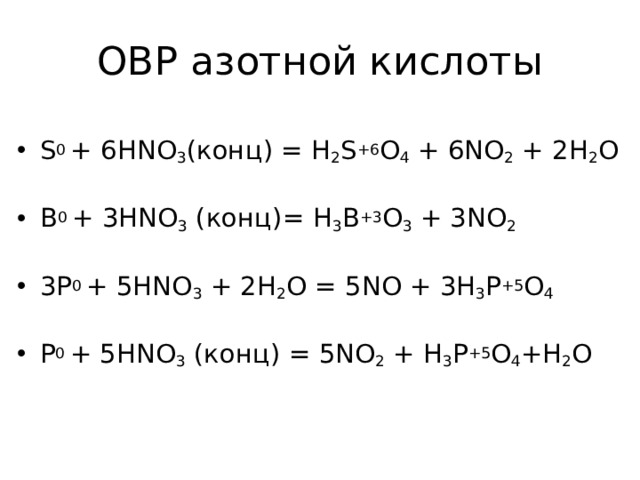
ОВР азотной кислоты
- S 0 + 6HNO 3 (конц) = H 2 S +6 O 4 + 6NO 2 + 2H 2 O
- B 0 + 3HNO 3 (конц)= H 3 B +3 O 3 + 3NO 2
- 3P 0 + 5HNO 3 + 2H 2 O = 5NO + 3H 3 P +5 O 4
- P 0 + 5HNO 3 (конц) = 5NO 2 + H 3 P +5 O 4 +H 2 O

ОВР азотной кислоты
+2 -1 +5 +3 +6 +4
FeS 2 + 18HNO 3 ( конц. ) → Fe(NO 3 ) 3 +2H 2 SO 4 +15NO 2 +7H 2 O
+2 _ + 3
Fe – 1 e → Fe _
– 15 e 1
-1 _ + 6
2S – 14 e → 2S
+5 _ + 4
N + e → N 15
FeS 2 – восстановитель
HNO 3 – окислитель

ОВР с участием органических соединений
Окисление алкенов в нейтральной среде:
C 2 H 4 + 2KMnO 4 + 2H 2 O→ CH 2 OH–CH 2 OH + 2MnO 2 + 2KOH
Окисление алкенов в кислой среде:
CH 3 CH=CH 2 + 2 KMnO 4 + 3 H 2 SO 4 →CH 3 COOH +CO 2 + 2 MnSO 4 +K 2 SO 4 + 4 H 2 O
Окисление алкенов в щелочной среде:
CH 3 CH=CH 2 + 10KMnO 4 + 13KOH→ CH 3 COOK + K 2 CO 3 + 8H 2 O + 10K 2 MnO 4

Окисление алкинов
в нейтральной среде:
3 CH ≡ CH +8 KMnO 4 →3 KOOC – COOK +8 MnO 2 +2КОН +2Н 2 О
2C -1 – 8e - → 2C +3 3
Mn +7 +3e - →Mn +4 8
в кислой среде:
5CH≡CH +8KMnO 4 +12H 2 SO 4 →5HOOC– COOH +8MnSO 4 +4 К 2 SO 4 +12 Н 2 О
CH≡CH + 2KMnO 4 +3H 2 SO 4 =2CO 2 + 2MnSO 4 + 4H 2 O + K 2 SO 4
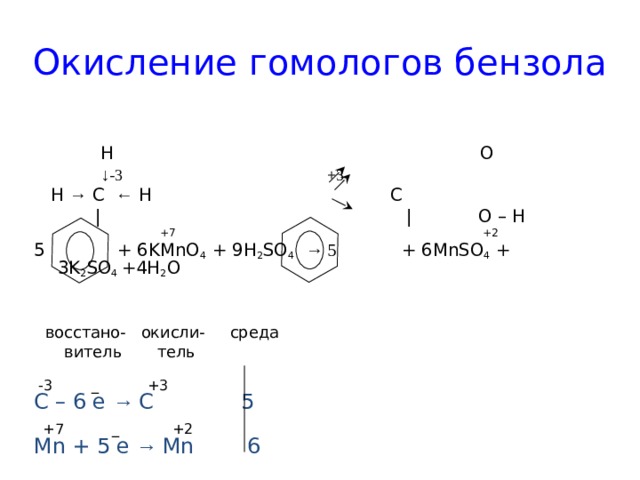
Окисление гомологов бензола
H O
↓ -3 +3
H → C ← H C
| | O – H
+7 +2
5 + 6KMnO 4 + 9H 2 SO 4 → 5 + 6MnSO 4 + 3K 2 SO 4 +4H 2 O
восстано- окисли- среда
витель тель
-3 _ +3
С – 6 e → C 5
+7 _ +2
Mn + 5 e → Mn 6

Окисление гомологов бензола
- Обратите внимание, что только α-углеродные атомы (непосредственно связанные с бензольным кольцом) окисляются до карбоксильных групп, остальные атомы углерода – до углекислого газа.
5C 6 H 5 -CH 2 CH 3 + 12KMnO 4 +18H 2 SO 4 →
→ 5 С 6 Н 5 СООН +CO 2 +12MnSO 4 +6K 2 SO 4 +28H 2 O
C -2 -5e - →C +3 5
C -3 -7e - →C +4
Mn +7 +5e - →Mn +2 12

Окисление стирола
В нейтральной среде:
3C 6 H 5 -CH =CH 2 +2 KMnO 4 + H 2 O→
3C 6 H 5 -CH(OH) -CH 2 (OH)+2MnO 2 +2KOH
В кислой среде:
C 6 H 5 -CH=CH 2 +2KMnO 4 +3H 2 SO 4 →
С 6 Н 5 СООН +CO 2 +2MnSO 4 +K 2 SO 4 +H 2 O
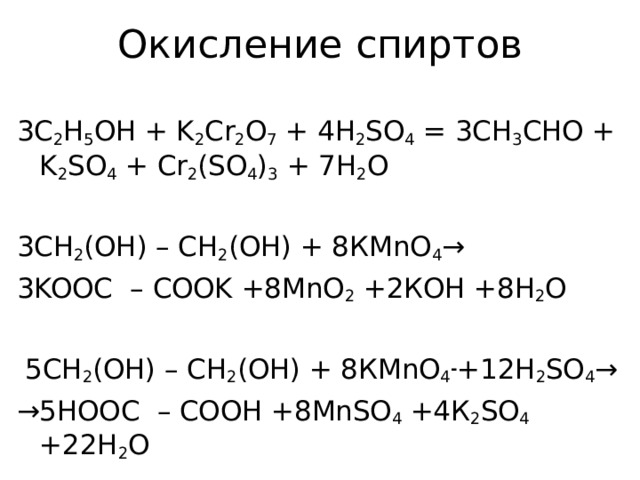
Окисление спиртов
3 C 2 H 5 OH + K 2 Cr 2 O 7 + 4 H 2 SO 4 = 3 CH 3 CHO + K 2 SO 4 + Cr 2 ( SO 4 ) 3 + 7 H 2 O
3СН 2 (ОН) – СН 2 (ОН) + 8К MnO 4 →
3 KOOC – COOK +8 MnO 2 +2КОН +8Н 2 О
5СН 2 (ОН) – СН 2 (ОН) + 8К MnO 4 - +12 H 2 SO 4 →
→ 5 HOOC – COOH +8 MnSO 4 +4К 2 SO 4 +22Н 2 О

Окисление альдегидов
3CH 3 CH=O + 2KMnO 4 = CH 3 COOH +
+ 2CH 3 COOK + 2MnO 2 + H 2 O
3CH 3 CH=O + K 2 Cr 2 O 7 + 4H 2 SO 4 =
= 3CH 3 COOH + Cr 2 (SO 4 ) 3 + 7H 2 O
3 СН 2 О + 2K 2 Cr 2 O 7 + 8H 2 SO 4 =
= 3CO 2 +2K 2 SO 4 + 2Cr 2 (SO 4 ) 3 + 11H 2 O
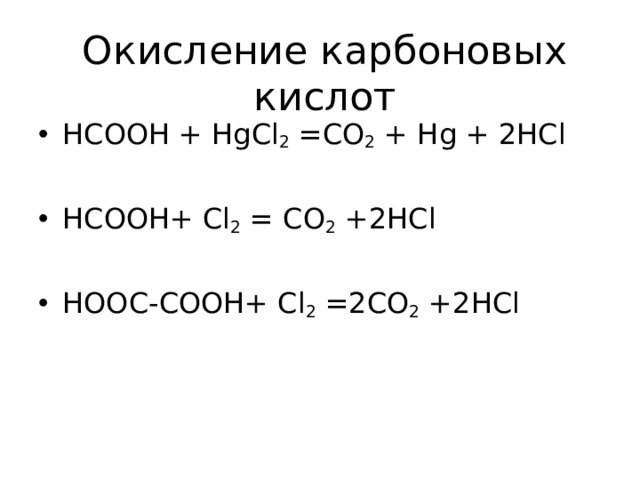
Окисление карбоновых кислот
- НСООН + HgCl 2 =CO 2 + Hg + 2HCl
- HCOOH+ Cl 2 = CO 2 +2HCl
- HOOC-COOH+ Cl 2 =2CO 2 +2HCl

 Получите свидетельство
Получите свидетельство Вход
Вход











 Подготовка к ЕГЭ (239 KB)
Подготовка к ЕГЭ (239 KB)
 0
0 303
303 7
7 Нравится
0
Нравится
0


