
ОСНОВАНИЯ
КЛАССИФИКАЦИЯ
И СВОЙСТВА
презентация подготовлена
учителем химии ГБОУ СОШ № 2047
КОВАЛЕВОЙ Н.Ю.

Определение
Основания – сложные вещества, состоящие из атомов металлов и одной или нескольких гидроксильных (гидроксо) групп

Гидроксильная группа
Гидроксильная (гидроксо) группа- это группа, состоящая из атомов водорода и кислорода -ОН
с валентностью (I)
NaOH – гидроксид натрия
Ba(OH) 2 – гидроксид бария
Al(OH) 3 – гидроксид алюминия
Fe(OH) 3 – гидроксид железа (III)
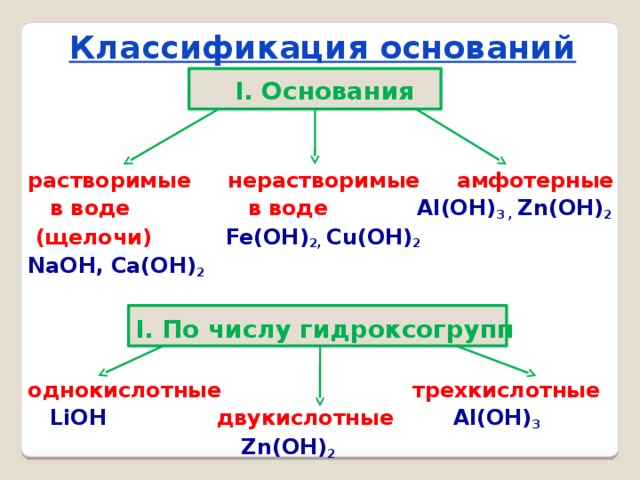
Классификация оснований
I. Основания
растворимые нерастворимые амфотерные
в воде в воде Al(OH) 3 , Zn(OH) 2
(щелочи) Fe(OH) 2, Cu(OH) 2
NaOH, Ca(OH) 2
I. По числу гидроксогрупп
однокислотные трехкислотные
LiOH двукислотные Al(OH) 3
Zn(OH) 2
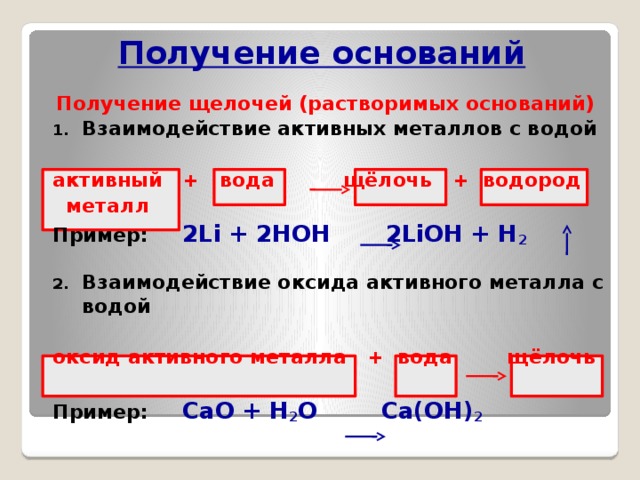
Получение оснований
Получение щелочей (растворимых оснований)
- Взаимодействие активных металлов с водой
активный + вода щёлочь + водород
металл
Пример: 2Li + 2HOH 2LiOH + H 2
- Взаимодействие оксида активного металла с водой
оксид активного металла + вода щёлочь
Пример: CaO + H 2 O Ca(OH) 2
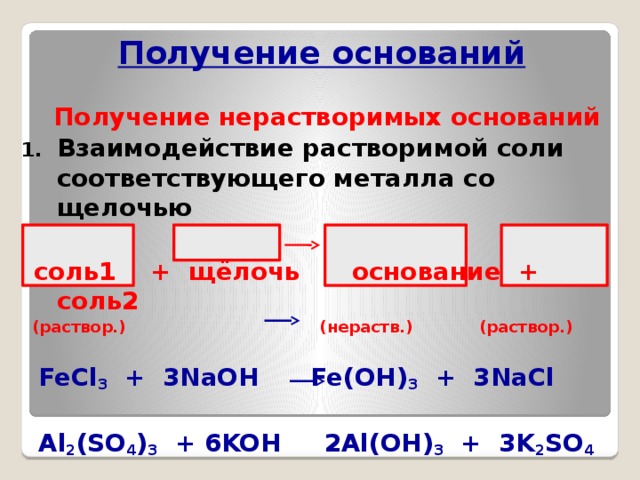
Получение оснований
Получение нерастворимых оснований
- Взаимодействие растворимой соли соответствующего металла со щелочью
соль1 + щёлочь основание + соль2
(раствор.) (нераств.) (раствор.)
FeCl 3 + 3NaOH Fe(OH) 3 + 3NaCl
Al 2 (SO 4 ) 3 + 6KOH 2Al(OH) 3 + 3K 2 SO 4

Химические свойства оснований
1. Все основания взаимодействуют с кислотами (реакция нейтрализации):
основание + кислота соль + вода
Реакция нейтрализации –
реакция между кислотой и основанием, в результате которой образуются соль и вода.
НСl + NaOH NaCl + Н 2 О
2Fe(OH) 3 + 3H 2 SO 4 Fe 2 (SO 4 ) 3 + 6H 2 O

Химич. свойства щелочей
2. Действие индикатора:
Под действием растворов щелочей индикаторы меняют свой цвет:
- Универсальный индикатор приобретает синий оттенок;
- Фиолетовый лакмус становится синим;
- Бесцветный фенолфталеин – малиновым ;
- Метиловый оранжевый – желтый.
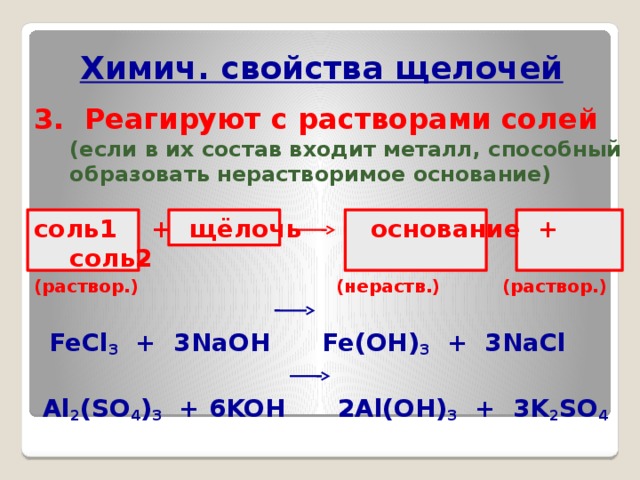
Химич. свойства щелочей
3. Реагируют с растворами солей (если в их состав входит металл, способный образовать нерастворимое основание)
соль1 + щёлочь основание + соль2
(раствор.) (нераств.) (раствор.)
FeCl 3 + 3NaOH Fe(OH) 3 + 3NaCl
Al 2 (SO 4 ) 3 + 6KOH 2Al(OH) 3 + 3K 2 SO 4
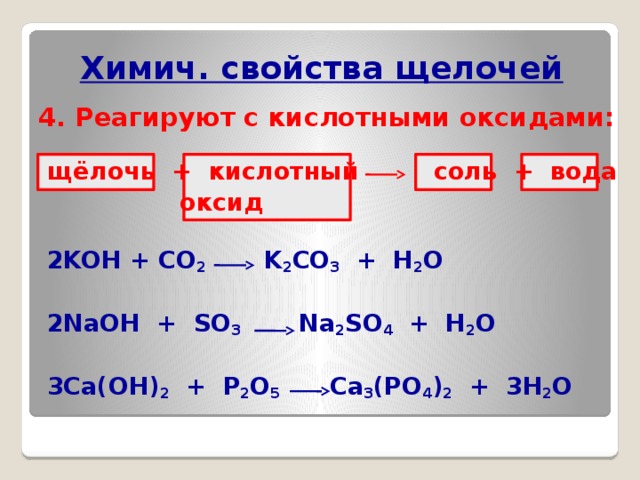
Химич. свойства щелочей
4. Реагируют с кислотными оксидами:
щёлочь + кислотный соль + вода
оксид
2KOH + CO 2 K 2 CO 3 + Н 2 О
2NaOH + SO 3 Na 2 SO 4 + Н 2 О
3Ca(OH) 2 + P 2 O 5 Ca 3 (PO 4 ) 2 + 3Н 2 О
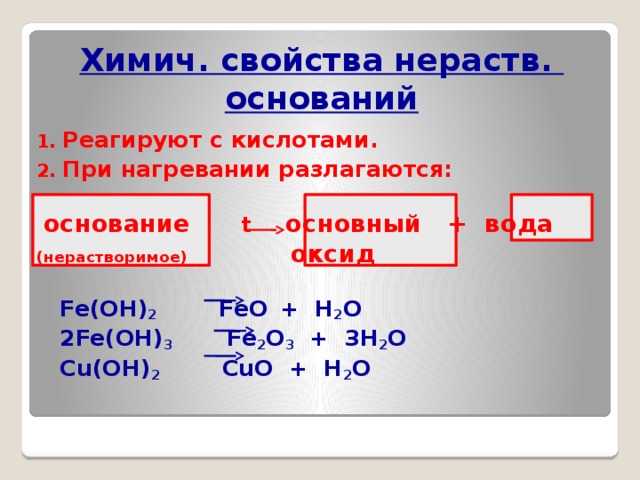
Химич. свойства нераств. оснований
- Реагируют с кислотами.
- При нагревании разлагаются:
основание t основный + вода
(нерастворимое) оксид
Fe(OH) 2 FeO + Н 2 О
2Fe(OH) 3 Fe 2 O 3 + 3Н 2 О
Cu(OH) 2 CuO + Н 2 О


 Получите свидетельство
Получите свидетельство Вход
Вход






















 Основания: классификация и свойства (0.1 MB)
Основания: классификация и свойства (0.1 MB)
 0
0 2568
2568 186
186 Нравится
0
Нравится
0




