Цели урока:
Образовательные:
Обеспечить усвоение учащимися положения неметаллов в Периодической системе химических элементов Д. И. Менделеева, особенностей строения их атомов и физических свойств
Актуализировать знания учащихся на явлении аллотропии, для представления общей характеристики неметаллов
Развивающие:
создать условия для развития умений учащихся анализировать, обобщать, делать выводы, сравнивать.
Воспитательные:
способствовать развитию навыков коммуникативного общения учащихся.
Тип урока: урок усвоения новых знаний.
Методы обучения: словесные (рассказ, объяснение, беседа); иллюстративные (схемы); наглядные (мультимедийное наглядное пособие); проблемно - поисковый.
Ход урока.
І. Организационный момент.
ІІ. Актуализация знаний
С целью актуализации знаний учитель зачитывает цитату из книги Ганты Тибор « Жизнь и ее происхождение».
«Прежде чем приступить к разговору об интересной истории образования Земли, нам необходимо ознакомиться с элементарным составом вселенной. Если бы нам удалось каким – то образом получить усредненный образец материала, из которого построена вселенная, подсчитать и сгруппировать все отдельные атомы, мы с удивлением обнаружили бы, что атомы самого легкого элемента являются самыми распространенными, а также в первенстве ему не уступают еще три химических элемента, которые являются важнейшими компонентами живой материи …»
Вопрос классу: Как вы, думаете, о каких химических элементах идет речь? И определите тему урока.
Итак, тема нашего сегодняшнего урока – «Неметаллы».
III. Изучение нового материала
1. Положение неметаллов в ПСХЭ Д. И. Менделеева.
Неметаллы расположены в основном в правом верхнем углу ПС, условно ограниченном диагональю бор - астат. Самым активным является фтор.
Для атомов неметаллов, по сравнению с атомами металлов характерны:
меньший атомный радиус;
четыре и более электрона на внешнем энергетическом уровне.
Отсюда и такое важнейшее свойство атомов неметаллов – тенденция к приёму недостающих до 8 электронов, т. е. окислительные свойства. Качественной характеристикой атомов неметаллов, т. е. своеобразной мерой их неметалличности, может служить электроотрицательность, т. е. свойство атомов химических элементов поляризовать химическую связь, оттягивать к себе общие электронные пары. Электроотрицательность – мера неметалличности, т. е. чем более электроотрицателен данный химический элемент, тем ярче выражены неметаллические свойства.
Изменение свойств атомов неметаллов
Заполните пробелы в утверждениях
В периоде
Радиус атома ……….
Окислительные свойства ……………. .
Восстановительные свойства …………………. .
Число электронов на внешнем слое …………………….
В группе
Радиус атома ……………….
Окислительные свойства ………………………. .
Восстановительные свойства …………………. .
Число электронов на внешнем слое ……………………. .
Предполагаемые ответы учащихся:
В периоде
Радиус атома уменьшается
Окислительные свойства увеличиваются
Восстановительные свойства уменьшаются
Число электронов на внешнем слое увеличивается
В группе
Радиус атома увеличивается
Окислительные свойства уменьшаются
Восстановительные свойства увеличиваются
Число электронов на внешнем слое не изменяется
2. Кристаллическое строение неметаллов - простых веществ. Аллотропия.
Если металлы – простые вещества образованы за счет металлической связи, то для неметаллов – простых веществ характерна ковалентная неполярная химическая связь. В отличие от металлов неметаллы – простые вещества, характеризуются большим многообразием свойств. Неметаллы имеют различное агрегатное состояние при обычных условиях:
газы – H2, O2, O3, N2, F2, Cl2;
жидкость – Br2;
твердые вещества – модификации серы, фосфора, кремния, углерода и др.
Гораздо богаче у неметаллов и спектр цветов: красный – у фосфора, красно - бурый – у брома, желтый – у серы, желто - зеленый – у хлора, фиолетовый – у паров йода. Элементы – неметаллы более способны, по сравнению с металлами, к аллотропии.
Способность атомов одного химического элемента образовывать несколько простых веществ называется аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
Весь материал - смотрите документ.

 Получите свидетельство
Получите свидетельство Вход
Вход



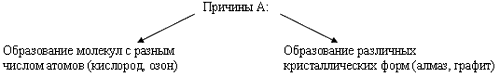









 Неметаллы в периодической системе. Состав воздуха (31.43 КB)
Неметаллы в периодической системе. Состав воздуха (31.43 КB)
 0
0 534
534 37
37 Нравится
0
Нравится
0


