Введение
Данная методическая разработка урока по теме «Гидролиз солей» продолжает изучение закономерностей протекания химических реакций, смещения равновесия обратимых процессов и является одним из существенных вопросов теории растворов.
Процессы гидролиза происходят в любых живых системах, антропогенных комплексов.
При изучении данной темы студентам важно научиться в процессе решения соответствующих задач и тестов умению объяснять сущность гидролиза солей, записывать краткие и полные ионные уравнения реакций гидролиза, объяснять изменение кислотности среды и образование кислых или основных солей в этом процессе. Также важно узнать о практическом значении гидролиза не только солей, но и других соединений. Особо интересен гидролиз в медицине. Умение экспериментально подтверждать основные случаи гидролиза солей также является одним из ведущих умений при изучении химии как науки.
Предлагаемое пособие содержит теоретический, экспериментальный и контрольно-оценочный блоки, что отвечает принципу системности в изучении темы «Гидролиз солей».
Разработка урока по теме «Гидролиз солей»
(11 класс, О.С.Габриелян, базовый уровень)
Тема: Гидролиз солей.
Опыт!
Скажи, чем гордишься ты?
Что ты такое?
Ты - плод ошибок и слез,
Силам потраченным счет.
Всюду: «Что нового?» - слышишь.
Да вдумайся в старое прежде!
В нем для себя найдешь ты нового много!
А. Майков
Цель:
Обучающая: Закрепить у студентов знания теории электролитической
диссоциации, умение разделять вещества на электролиты и не электролиты,
определять характер среды по окраске индикатора. Сформировать знания о
гидролизе, как особом свойстве солей. Доказать влияние состава соли на
направление реакции, и привести учащихся к выводу о смещении равновесия
диссоциации молекул воды, за счет связывания одного из ее ионов ионами
соли. Сформировать умение по составу соли (ее природе) прогнозировать
реакцию среды.
Развивающая: На примере свойств солей, различной природы, их отношение к воде, продолжить развитие умений наблюдать, сравнивать изучаемые явления, выявлять причинно – следственные связи, делать соответствующие выводы.
Воспитывающая: Через проблемный метод обучения раскрыть перед студентами научный путь познания через доказательство гипотезы, способствовать переходу знаний в убеждения. Посредством эксперимента привить навыки трудолюбия, бережного отношения к реактивам, к природе, эстетические качества
Методы обучения: диалогическое изложение, беседа, объяснение, химический эксперимент.
Приемы обучения: постановка и решение учебных проблем, раскрытие причинно-следственных связей, организация наблюдений, сравнения, использование алгоритмов.
Средства обучения: причинно-следственные связи, оборудование и реактивы для эксперимента, таблицы, алгоритмы.
Задачи:
- научить учеников пользоваться опорными знаниями, составлять конспект урока;
- углубить их знание свойств солей
- научить учащихся определять характер среды растворов солей по их составу, составлять ионные уравнения реакций гидролиза значения гидролиза в природе и жизни человека;
- вызвать интерес к предмету, развивать умение логически рассуждать, грамотно выражать свои мысли;
- закрепить умения и навыки химического эксперимента, умение работать с таблицами, справочным материалом, дополнительной литературой.
Тип урока: комбинированный
Вид урока: проблемно-исследовательский.
Учения: эвристическая беседа, лабораторные опыты.
Дидактическое пространство урока:
Мультимедиа проектор
Презентация к уроку в программе MS PowerPoint.
Таблица растворимости, таблица рН среды
Оборудование для эксперимента: штатив с пробирками, растворы лакмуса и фенолфталеина, растворы солей; хлорида натрия, карбоната натрия, хлорида аммония. Для лабораторной работы: растворы следующих солей: KCl; K2S; AlCl3.
Оборудование: учебник О.С. Габриеляна «Химия. 11 класс. Базовый уровень» (2008 год), таблица растворимости, индикаторная шкала, штатив с пробирками; растворы фенолфталеина, метилового оранжевого, соляной кислоты, гидроксида натрия, хлорида железа (III), карбоната натрия, хлорида натрия; образцы сульфата алюминия, нитрата меди (II), хлорида алюминия, карбоната калия, силиката натрия, нитрата калия, сульфата натрия.
Источники информации:
1. Н.С. Ахметов. Актуальные вопросы курса неорганической химии. М.
Просвещение. 1991.с.176-180
2. Глинка, Н.Л. Общая химия [Текст] / Н.Л. Глинка. – М.: Интеграл-
Пресс, 2005. – 728 с.
3. Глинка, Н.Л. Задачи и упражнения по общей химии
4. Н.Л. Глинка. – Л.: Химия, 2008 – 116 с.
5. Г. Фельдман, Г.Е. Рудзитис. Химия. 11-й класс. М. Просвещение.
2008
6. Пособие по химии для старших классов. 8-11 классы. Н.Е. Кузьменко. В.В. Ерёмин. В.А.Попков. М. Оникс 21 век. 2003.
7. Химия для абитуриентов. От средней школы к ВУЗу. Р.А, Лидин. В.А. Молочко. М. Химия. 1993.
8. Методические рекомендации по использованию учебников Л.С. Гузея, Р.П. Суровцева, Г.Г. Лысовой «Химия-10», «Химия-11». При изучении химии на базовых и профильных уровнях. М. Дрофа. 2004.
9. Химия-11 Учебник для общеобразовательных учебных заведений. О.С. Габриэлян, Г.Г. Лысова, М., Дрофа. 2005.
План урока:
1.Организационный момент. Приветственное слово преподавателя. 5 мин
2. Актуализация и систематизация знаний: 25 минут
2.1 Фронтальная беседа, работа с тестом
2.2 Индивидуальная работа, самопроверка, взаимопроверка
3.Изучение нового материала 45 минут
3.1 Беседа с использованием демонстрационного эксперимента.
3.2 Просмотр презентации
3.3 Проведение химического эксперимента гидролиза солей
4. Подведение итогов урока, оценивание работы студентов на уроке, рефлексия 10 минут
5. Объяснение домашнего задания 5 минут
Ход урока:
Актуализация опорных знаний. Содержание урока работы учителя
| Формы и методы работы учителя | Виды деятельности | Результат |
| 1. Опорные вопросы: *Какие вещества называются электролитами? *Какие вещества называются неэлектролитами? * Что показывает степень электролитической диссоциации? *Какие вы знаете * Как индикаторы
| Фронтальный опрос в форме беседы На экране терминала показываем цвета индикаторов в разных средах | Устные ответы на вопросы учителя Объяснение формулы у доски. |
| 2. Подготовка таблицы для занесения результатов опыта | Таблица заранее нарисована на доске | Построение таблицы в тетради
|
| 3.Проведение лабораторного опыта учащимися. *Правила техники безопасности при работе с химическими веществами *Проведение лабораторного опыта | Занести результаты опытов в таблицу на доске . | При проведении лабораторного опыта учащиеся исследуют изменение цвета выданных индикаторов (фенолфталеина, лакмуса и метилового оранжевого) в водной среде |
слайд
Для того чтобы более подробно вспомнить тему ТЭД я предлагаю вам решить кроссворд поработав с терминами.
Работа с терминами. Решение кроссворда.
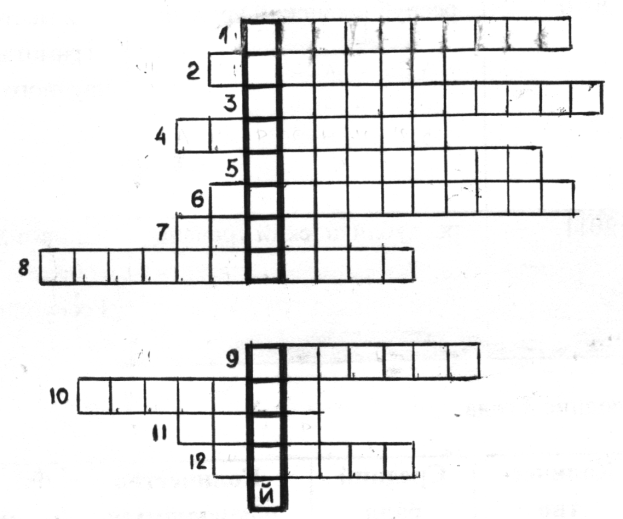
1. Результат взаимодействия воды с молекулами растворенного вещества.
2. Электролиты, диссоциирующие на катионы водорода и анионы кислотного остатка.
3. Процесс распада электролитов на ионы.
4. Автор теории электролитической диссоциации.
5. Электролиты, диссоциирующие на катионы металла и гидроксид-анионы.
6. Вещества, которые в растворах распадаются на ионы.
7. Отрицательно заряженный ион.
8. Реакция между основанием и кислотой
9. Соль серной кислоты
10. Гомогенная система, состоящая из молекул воды и частиц растворенного вещества.
11. Электролиты, диссоциирующие на катионы металла и анионы кислотного остатка.
12. Растворимые основания. слайд
Проверяется правильность решения кроссворда. Самооценка и оценка учащихся: нет ошибок – «5», 1-2 ошибки – «4», 3 ошибки и более – «3». слайд
Правильно решив кроссворд, мы с вами определили тему сегодняшнего урока – «Гидролиз солей».
2. Постановка учебной проблемы
* Учитель формулирует проблемный вопрос:
Сегодня мы с вами выясним: Почему в растворах карбоната натрия и сульфата цинка индикатор изменяет окраску, а в растворах хлорида натрия и ацетата аммония - нет?""
фильм
4. Решение учебной проблемы.
Для выдвижения гипотез преподаватель просит вспомнить студентов о ранее приобретённых знаниях. слайд
* О чём свидетельствует изменение окраски индикатора лакмуса на синий цвет? карточка
* О чём свидетельствует изменение окраски лакмуса на красный цвет?
* Имеются ли в растворах из фильма ионы водорода и гидроксид-ионы, изменяющие цвет индикатора?
* Является ли вода электролитом?
* На какие ионы диссоциирует вода?
Вспомним, что вода – слабый электролит и в чистой воде происходит процесс: НОН ↔ Н+ + ОН- и существует равенство концентрации:
[H+] = [OH –] = 10 – 7 моль/л.
pH = 7
II. Изучение новой темы. слайд
Учащиеся знают, что они исследовали водные растворы.
делают вывод, что вода участвует в гидролизе и дает ионы водорода и гидроксогруппы, избыток которых изменяет цвет индикаторов.
Вопрос: «Что же называется гидролизом? ».
«Гидро» - вода, «лизис» - разложение. слайд
Делается вывод, что гидролиз – это взаимодействие между некоторыми солями и водой.
Запишем: гидролиз – это обратимое взаимодействие между некоторыми солями и водой. слайд
Характеристика слабых и сильных электролитов слайд
Создание проблемной ситуации.
Учитель предлагает убедиться в том, что при взаимодействии кислоты и основания получается соль. работа у доски
* Получите соль хлорид натрия, используя гидроксид натрия и соляную кислоту.
* По результатам составляют уравнение в ионном виде, учитель отмечает изменение среды раствора, она стала нейтральной - реакция нейтрализации - это реакция между кислотами и основаниями.
* Учитель предлагает проверить нейтральность среды растворов следующих солей: карбоната калия, хлорида цинка, ацетата свинца, по ходу выполнения опытов создаётся проблемная ситуация, поскольку в растворах двух солей индикаторы изменили окраску.
Фильм
Демонстрационный опыт. Даны 3 пробирки с растворами ZnSO4, Na2CO3, NaCl CH3COONH4. Водные растворы этих солей имеют разные значения pH и показывают различную реакцию среды – кислую, щелочную, нейтральную. Чем можно объяснить различные среды водных растворов солей? Ведь они не содержат в своем составе ионы H+ и OH-, которые определяют среду раствора. слайд
Учащиеся выдвигают различные гипотезы. Учитель подводит их к формулировке, которая наиболее полно отражает это влияние, предлагает сделать проект по теме «Гидролиз солей».
Проблема: Чем можно объяснить различные среды растворов солей?
Гипотеза: в водных растворах соли подвергаются гидролизу. Окраска раствора зависит от силы исходной кислоты и исходного основания.
Объект исследования: процесс гидролиза солей. слайд
Предмет исследования: факторы, влияющие на окраску раствора солей.
Учитель напоминает учащимся об организации деятельности над проектом:
- формирование групп, выбор координатора группы;
- распределение обязанностей между членами команды;
- работа над проектом по данному заданию (исследование);
- представление результатов работы;
- подведение итогов.
Операционно-исполнительский этап.
Учитель: сегодня на уроке вы работаете в группах. Каждая выполнит собственное исследование согласно инструкциям, которые находятся на столах. слайд Инструкция группе 1.
Цель: установить причину кислой реакции среды раствора ZnSO4,.
Ход работы: поместите в пробирку раствор данной вам соли, добавьте несколько капель раствора лакмуса. Что наблюдаете?
Проанализируйте состав соли.
Соль можно рассматривать как продукт реакции нейтрализации основания кислотой. Определите: а) каким основанием и какой кислотой образована данная соль?; б) сильным или слабым электролитом являются эти основания и кислоты?
Напишите полное и сокращенное ионное уравнение гидролиза.
Среди солей на демонстрационном столе выберите соли, соответствующие вашим условиям.
Планируемый результат: соль образована слабым основанием и сильной кислотой. Раствор такой соли имеет кислую среду, так как имеет избыток ионов Н+ - pH Уравнение гидролиза
я первая стадия гидролизаидролиза
Молекулярное уравнение:
2ZnSO4 + 2H2O ⇄ (ZnOH)2SO4 + H2SO4
Полное ионное уравнение:
2Zn2+ + 2SO42- + 2H2O ⇄ 2ZnOH+ + SO42- + 2H+ + SO42-
Краткое ионное уравнение:
Zn2+ + H2O ⇄ ZnOH+ + H+
Вторая стадия гидролиза
Молекулярное уравнение:
(ZnOH)2SO4 + 2H2O ⇄ 2Zn(OH)2 + H2SO4
Полное ионное уравнение:
2ZnOH+ + SO42- + 2H2O ⇄ 2Zn(OH)2 + 2H+ + SO42-
Краткое ионное уравнение:
ZnOH+ + H2O ⇄ Zn(OH)2 + H+
Т.к. в результате гидролиза образовались ионы водорода (H+), то раствор будет имееть кислую среду (pH
Инструкция группе 2.
Цель: установить причину щелочной реакции среды раствора Na2CO3.
Ход работы: поместите в пробирку раствор данной вам соли, добавьте несколько капель раствора фенолфталеина. Что наблюдаете?
Проанализируйте состав соли.
Соль можно рассматривать как продукт реакции нейтрализации основания кислотой. Определите: а) каким основанием и какой кислотой образована данная соль?; б) сильным или слабым электролитом являются эти основания и кислоты?
Напишите полное и сокращенное ионное уравнение гидролиза.
Среди солей на демонстрационном столе выберите соли, соответствующие вашим условиям.
Планируемый результат: соль образована сильным основанием и слабой кислотой. Раствор такой соли имеет щелочную среду, так как имеет избыток ионов ОН- - рН 7. Среду определяет тот, кто сильнее. В реакцию гидролиза вступает тот, кто слабее.
Уравнение гидролиза:
первая стадия гидролиза
Молекулярное уравнение:
Na2CO3 + НОН ↔ NaOH + NaHCO3
Полное ионное уравнение
2Na+ + СO32- + НОН↔ Na+ + ОН- + Na+ + HCO3-
Краткое ионное уравнение
СO32- + НОН ↔ ОН- + НСO3 - , рН7 [Н+]-]
вторая стадия гидролиза орая рая стадия гидролиза
Молекулярное уравнение:
NaHCO3 + H2O ⇄ H2CO3 + NaOH
Полное ионное уравнение:
Na+ + HCO3- + H2O ⇄ H2CO3 + Na+ + OH-
Краткое ионное уравнение:
HCO3- + H2O ⇄ H2CO3 + OH-
Т.к. в результате гидролиза образовались гидроксид-ионы (OH-), то раствор имеет щелочную среду (pH 7).
Инструкция группе 3.
Цель: установить причину нейтральной среды раствора NaCl.
Ход работы: поместите в пробирку раствор данной вам соли, добавьте несколько капель раствора фенолфталеина. Что наблюдаете?
Проанализируйте состав соли.
Соль можно рассматривать как продукт реакции нейтрализации основания кислотой. Определите: а) каким основанием и какой кислотой образована данная соль?; б) сильным или слабым электролитом являются эти основания и кислоты?
Напишите полное и сокращенное ионное уравнение гидролиза.
Среди солей на демонстрационном столе выберите соли, соответствующие вашим условиям.
Планируемый результат: соль образована сильным основанием и сильной кислотой. Раствор такой соли имеет нейтральную среду, так как Н+ = ОН- - рН=7 . Такие соли гидролизу не подвергаются.
Уравнение гидролиза: NaCl + НОН ↔ NaOH + НС1
Na+ + С1- + НОН ↔ Na+ + ОН- + Н+ + С1-
НОН ↔ ОН- + Н+ , рН = 7, [Н+]=[ОН-]
Инструкция группе 4.
Обратитесь за помощью к тексту учебника на странице 150 видеоролику
Проанализируйте состав соли.
Соль можно рассматривать как продукт реакции нейтрализации основания кислотой. Определите: а) каким основанием и какой кислотой образована данная соль?; б) сильным или слабым электролитом являются эти основания и кислоты?
Выпишите уравнение реакции гидролиза ацетата аммония
Сделайте вывод.
Планируемый результат: соли, образованные слабым основанием и слабой кислотой, подвергаются необратимому гидролизу, т.е. полностью разлагаются с образованием осадка и выделением газа: Реакция гидролиза в молекулярной форме: CH3COONH4 +H2O = NH4OH + CH3COOH
в ионно-молекулярной форме: NH4 + + CH3COO– + H2O NH4OH + CH3COOH. Поскольку концентрация ацетат-ионов и ионов аммония в растворе одинаковы, а константы диссоциации кислоты и основания равны, то реакция среды будет нейтральной (рН=7) Рефлексивно-оценочный этап.
Участники проекта оформляют результаты своей работы на отдельных листах и вывешивают на доске. Основные выводы оформляются в виде таблицы.
Таблица 1.
Гидролиз солей.
| Соль | Гидролиз | Среда | |
| Катион | Анион | ||
| Сильное основание | Слабая кислота | По аниону «-» | Щелочная (рН7) |
| Слабое основание | Сильная кислота | По катиону «+» | Кислая (рН |
| Слабое основание | Слабая кислота | По аниону «-» и по катиону «+» | Нейтральная, кислая или щелочная |
| Сильное основание | Сильная кислота | - | Нейтральная (рН=7) |
VI этап урока - Значение гидролиза в природе и практической деятельности человека.
Учитель. Так ли уж часто следует учитывать процессы гидролиза. Значение гидролиза в природе и в практической деятельности (выступления учащихся).
В древности в качестве моющего средства использовали карбонат калия К2СО3, который в воде гидролизируется по аниону, водный раствор приобретает мылкость за счет образующихся ионов ОН-. В настоящее время основной компонент мыла - это натриевые или калиевые соли высших жирных карбоновых кислот: стеараты, пальминаты, которые гидролизуются.
Проверим результативность нашей совместной исследовательской деятельности: напишем графический диктант, текст которого вы видите на своих столах (приложение №2).
Химический диктант (верны ли данные утверждения)
В чистой воде рН=7.
Раствор соляной кислоты – слабый электролит.
Карбонат натрия образован сильным основанием и слабой кислотой.
Хлорид алюминия образован слабым основанием и сильной кислотой.
Водный раствор соли NaCl имеет рН
Водный раствор соли K2SO4 имеет рН=7.
Водный раствор солиAl2(SO4)3 имеет рН
Соль KNO3подвергается необратимому гидролизу с выпадением осадка.
Раствор соли Na2SiO3 при действии фенолфталеина окрасится в малиновый цвет.
Раствор соли K2SO3 при действии фенолфталеина остается бесцветным Учащиеся обмениваются заполненными бланками, выставляют друг другу оценки по оценочной шкале: «5» - 9-10 правильных ответов, «4» - 7-8 правильных ответов, «3» - 5-6 правильных ответов.
На доске открывается шаблон с правильными ответами. слайд
![]() - да,
- да, ![]() - нет.
- нет.  слайд
слайд
Прошу поднять руку тех учеников, которые справились с графическим диктантам на «хорошо» и «отлично».
V II этап урока - Подведение итогов.
Итак, сегодня мы познакомились с явлением гидролиза солей. Прошу дать краткие ответы на мои вопросы: слайд слайд
Что такое гидролиз?
На какие 4 группы мы разделили все соли?
Как происходит гидролиз каждой группы?
Выставление оценок.
V III этап урока - Домашнее задание. слайд
§ 18, упражнение 7 (а – I вариант, б – II вариант), упражнение 8.
1. Придумать 4 соли, дающих разную среду при гидролизе и записать уравнения их взаимодействия с водой
2.Написать уравнение реакций взаимодействия с водой следующих солей:
СaCО3; AlCI3; MgSO4; (CH3 COO)2Fe;
КОНТРОЛЬНО-ТЕСТОВАЯ ЧАСТЬ
3.1 Тестовый контроль
Выполните предложенный тест
1. Среда раствора карбоната калия
1) щелочная 2) кислая 3) нейтральная 4) слабокислая?
2. Установите соответствие между формулой соли и ионным уравнением гидролиза этой соли. Формула соли
1)CuSO4
2)K2CO3
3)CH3COONa
4)(NH4)2SO4
Ионное уравнение
A) CH3COO– + H2O CH3COOH + OH–Б) NH4+ + H2O NH3*H2O + H+
В) Сu2+ + H2O Cu(OH)+ + H+ Г) СO32– + H2O HCO3– + OH– Д) Сu2+ + 2H2O Cu(OH)2 +2H+
3. Установите соответствие между условиями и состоянием химического равновесия процесса гидролиза солей.
| УСЛОВИЯ СМЕЩЕНИЯ | ХИМИЧЕСКОЕ | ||
| РАВНОВЕСИЯ | РАВНОВЕСИЕ | ||
| 1) | нагревание раствора | А) смещается влево | |
| 2) | добавление продуктов | Б) смещается вправо | |
| гидролиза | В) не смещается | ||
3) охлаждение раствора
4) разбавление раствора
4. Между собой водные растворы сульфата и фосфата натрия можно различить с помощью:
1) гидроксида натрия
2) серной кислоты
3) фенолфталеина
4) фосфорной кислоты
5. Установите соответствие между названиями солей и средой их растворов.
| НАЗВАНИЕ СОЛИ | СРЕДА РАСТВОРА | |
| 1) | нитрит калия | А) кислая |
| 2) | сульфат железа | Б) нейтральная |
| 3) | карбонат калия | В) щелочная |
4)хлорид алюминия
6. Установите соответствие между формулой соли и способностью этой соли к гидролизу.
ФОРМУЛА СОЛИ
1)Zn(CH3COO)2
2)NaBr
3)Li2S
4)(NH4)2SO4
СПОСОБНОСТЬ К ГИДРОЛИЗУ А) гидролиз по катиону Б) гидролиз по аниону
В) гидролиз по катиону и аниону Г) гидролизу не подвергается
Контрольные вопросы и задачи
1. Составьте ионно-молекулярные и молекулярные уравнения
гидролиза солей Pb(NO3)2, Na2CO3, Fe2(SO4)3. Какое значение рН имеют растворы этих солей?
2.Составьте ионно-молекулярные и молекулярные уравнения
гидролиза солей СН3СООК, ZnSO4, Al(NO3)3. Какое значение рН имеют растворы этих солей?
3.Составьте ионно-молекулярные и молекулярные уравнения
гидролиза солей CuCl2, Cs2CO3, Cr(NO3)3. Какое значение рН имеют растворы этих солей?
4.Какое значение рН имеют растворы солей Na2S, AlCl3, NiSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
5.Какое значение рН имеют растворы солей Na3PO4, K2S, CuSO4? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
6.Какое значение рН имеют растворы солей NiSO4; LiNO3; Na3PO4? Для солей, подверженных гидролизу, приведите ионно-молекулярные и молекулярные уравнения гидролиза. В какую сторону будет смещено равновесие гидролиза соли NiSO4 при добавлении серной кислоты?
7.Какое значение рН имеют растворы следующих солей: К3РО4, Pb(NO3)2, Na2S? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
8.К раствору FeCl3 добавили следующие вещества: а)HCl; б)КОН; в)ZnCl2; г)Na2CO3. В каких случаях гидролиз хлорида железа (III) усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
9.При смешивании растворов FeCl3 и Na2CO3 каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролиз ионно молекулярным и молекулярным уравнениями.
10.Составьте ионно-молекулярное и молекулярное уравнения
совместного гидролиза, происходящего при смешивании растворов К2S и СrCl3. Каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты.
11.К раствору Al2(SO4)3 добавили следующие вещества: а)H2SO4; б)КОН; в)Na2SO3; г)ZnSO4. В каких случаях гидролиз сульфата алюминия усилится? Почему? Составьте ионно-молекулярные и молекулярные
уравнения гидролиза соответствующих солей.
12. К раствору Na2CO3 добавили следующие вещества: а) НСl; б) NaOH; в)Cu(NO3)2; г)K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей.
13. При смешивании растворов Al2(SO4)3 и Na2СO3 каждая из взятых солей гидролизуется необратимо до конца с образованием
соответствующих основания и кислоты. Составьте ионно-молекулярное и молекулярное уравнение происходящего совместного гидролиза.
14.При смешивании растворов Al2(SO4)3 и Na2S каждая из взятых солей гидролизуется необратимо до конца с образованием соответствующих основания и кислоты. Выразите этот совместный гидролизионно-молекулярными молекулярным уравнениями.
15.При сливании водных растворов Cr(NO3)3 и Na2S образуется осадок гидроксида хрома (III) и выделяется газ. Составьте молекулярное и ионно молекулярное уравнения происходящей реакции.
16.Какую реакцию имеют растворы солей K2S и CuSO4? Приведите ионно-молекулярные и молекулярные уравнения гидролиза этих солей по первой ступени. Какой газ выделяется при смешивании растворов этих солей? Составьте ионно-молекулярное и молекулярное уравнения происходящего процесса.
17.Какая из двух солей при равных условиях в большей степени
подвергается гидролизу: Na2CO3 или Na2SO3; FeCl3 или FeCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
18.Какие из солей: а) Na2CO3 или (NH4)2CO3; б) Mg(NO3)2 или Ni(NO3)2больше подвержены гидролизу? Составьте ионно-молекулярные и
молекулярные уравнения гидролиза солей. Укажите реакцию растворов этих солей.
19.Какие из солей RbCl, Cr2(SO4)3, Ni(NO3)2, Na2SO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН имеют растворы этих солей?
20.Какие из солей Al2(SO4)3, K2S, Pb(NO3)2, KCl подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН имеют растворы этих солей?
21.Для растворов солей Li2CO3; CdCl2; NaBr укажите реакцию среды, составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. Как усилить гидролиз соли CdCl2?
22.Какие из солей NaBr, Na2S, K2CO3, CоCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН имеют растворы этих солей?
23.Какая из двух солей при равных условиях в большей степени
подвергается гидролизу: NaCN или NaClO; MgCl2 или ZnCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей.
24.Действием, каких факторов можно усилить гидролиз солей LiCl и
Bi(NO3)3? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей. Укажите реакцию растворов этих солей.
25.Какие из солей CrCl3; K2S; NaNO3 подвержены гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза этих солей. Укажите значения рН их растворов. Как усилить гидролиз соли
K2S?
26.Какие из солей К2СО3, FeCl3, K2SO3, ZnCl2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза соответствующих солей. Какое значение рН имеют растворы этих солей?
27.Какая из двух солей при равных условиях в большей степени
подвергается гидролизу Na2S или Na2CO3; CuCl2 или MgCl2? Почему? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей. Укажите реакцию растворов этих солей.
28.Какие из солей ZnCl2; K3PO4; Ca(NO3)2 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей. Укажите реакцию растворов этих солей. Почему при приготовлении водного раствора хлорида цинка его подкисляют соляной кислотой?
29. Какие из солей Fe2(SO4)3; BaCl2; CaCO3 подвергаются гидролизу? Составьте ионно-молекулярные и молекулярные уравнения гидролиза солей. Укажите реакцию растворов этих солей. Как усилить гидролиз соли
Fe2(SO4)3?
30. Какие из приведѐнных ниже солей подвергаются гидролизу? Составьте молекулярные и ионные уравнения гидролиза соответствующих солей. Какое значение рН имеют растворы этих солей?
Таблица 2
Формулы солей для написания гидролиза по контрольным вариантам
| Номер |
| Формулы солей |
| |
| варианта |
|
|
|
|
| 1 | Na2S | KCl | Cr2(SO4)3 | Co(NO3)2 |
| 2 | Na2CO3 | К2СО3 | Cr(NO3)3 | CoSO4 |
| 3 | Na2SiO3 | K3PO4 | CrBr3 | NiCl2 |
| 4 | HCOONa | K2SO4 | CrCl3 | NiI2 |
| 5 | CH3COONa | K2SiO3 | AlCl3 | HgI2 |
| 6 | NaCN | K2SO3 | Al2(SO4)3 | NH4Cl |
| 7 | NaClO4 | Rb2SO4 | CuSO4 | SnSO4 |
| 8 | NaNO2 | CsCl | Cu(NO3)2 | MnSO4 |
| 9 | Na2SO3 | BaBr2 | ZnCl2 | FeCl3 |
| 10 | Na3PO4 | Li2CO3 | ZnI2 | FeCl2 |
| 11 | CaCl2 | LiBr | Zn(NO3)2 | Pb(NO3)2 |

 Получите свидетельство
Получите свидетельство Вход
Вход












 Методическая разработка урока по теме: "Гидролиз солей" (334.01 KB)
Методическая разработка урока по теме: "Гидролиз солей" (334.01 KB)
 0
0 2251
2251 90
90 Нравится
0
Нравится
0


