
Метан и его свойства

Предельные углеводороды. Метан. Алканы.
- Общая формула предельных углеводородов. C n H 2n+2 где n≥1 . При образовании связей атома углерода с водородом образуется четыре SP 3 электрона, взаимно отталкиваясь друг от друга занимает тетраэдрическое положение в пространстве, под углом 109˚28‘, расстояние между атомами 0,154 нм .

Физические свойства.
- Метан – газ, без цвета и запаха, легче воздуха (Мr = 16), малорастворим в воде.

Химические свойства.
- Горит. С воздухом образует взрывчатые смеси.
- СН 4 + 2О 2 → СО 2 + 2Н 2 О
- При недостатке кислорода протекает неполное сгорание.
- СН 4 + О 2 → С + 2Н 2 О
- В присутствии катализаторов (нитрозных газов) могут образоваться метиловый спирт и формальдегид.
- СН 4 + О 2 → Н-С=О + Н 2 О │
Н
- 2СН 4 + О 2 → 2Н 3 С-ОН

- При сильном нагревании получают сажу.
- СН 4 → С + 2Н 2
- Промежуточный продукт
- 2СН 4 → С 2 Н 4 + 2Н 2 ; 2СН 4 → С 2 Н 2 + 3Н 2 Ацетилен в 2 раза дешевле полученного из карбида кальция. Конверсией получают чистый водород.
- Метан стоик при обычных условиях к щелочам, кислотам и окислителям. Он не способен к реакциям присоединения, зато для него характерны реакции замещения.

- На свету с Cl 2 или Br 2 эта реакция протекает по свободно-радикальному механизму со взрывом.
- Cl 2 → 2 Cl *
- СН 4 + Cl * → СН 3 * + НCl СН 3 * + Cl 2 → СН 3 Cl + Cl * СН 3 Cl + Cl * → СН 2 Cl * + НCl СН 2 Cl * + Cl 2 → СН 2 Cl 2 + Cl * СН 2 Cl 2 + Cl * → СНCl 2 * + НCl СНCl 2 * + Cl 2 → СHCl 3 + Cl * СHCl 3 + Cl * → СCl 3 * + HCl СCl 3 * + Cl 2 → СCl 4 + Cl *

Обрыв реакции.
- Реакция может обрываться, если прореагирует два радикала, типа: СН 3 * + СН 3 * → С 2 Н 6 ; СН 3 * + Cl *→ СН 3 Cl; Cl *+ Cl *→ Cl 2
- Хлористый метил – газ легко сжижающийся, используется как хладоагент.
- Остальные жидкости применяются как растворители смол, каучуков и д.р. органических веществ. СCl 4 используется в огнетушителях, там, где нельзя использовать воду.

Метан в природе.
- Метан широко распространён в природе, он является главной составной частью многих природных газов. (90-98%). Образуется при сухой перегонке древесины, торфа, кокса, при крекинге нефти. Кроме метана в попутных газах есть этан, пропан, бутан и пентан.
- Лабораторный способ получения метана.
- CH 3 COONa + NaOH → CH 4 + Na 2 CO 3 Al 4 C 3 + 12H 2 O → 3CH 4 + 4 Al(OH) 3

Синтетический способ получения метана.
Ni(1200 ˚C) C + 2H 2 → CH 4 ; Ni,NiCO3,Co CO + 3H 2 → CH 4 + H 2 O; Ni,NiCO3,Co CO 2 + 4H 2 → CH 4 + 2H 2 O
- Эти способы получения метана имеют промышленное значение .

Применение.
Используется как топливо, для получения водорода, этилена, ацетилена, сажи, для получения спирта и формальдегида.
- Получение синтез-газа который используется в доменном процессе: Ni,MgCO 3 CH 4 + H 2 O → CO + 3H 2 H 2 SO 4 CH 4 + HNO 3 → CH 3 - NO 2 + H 2 O

Задачи:
- Определите плотность метана по воздуху.
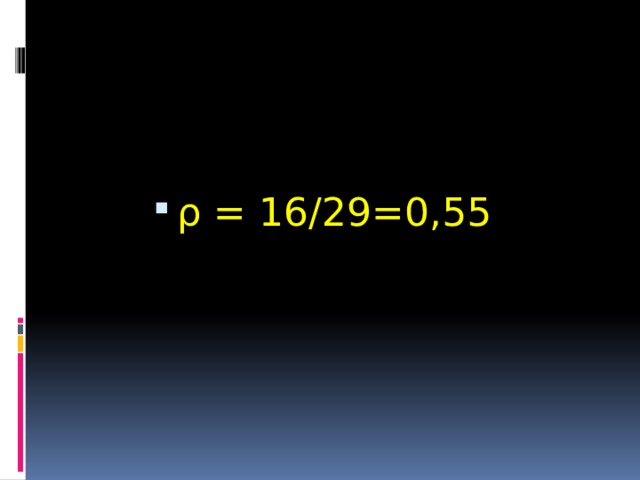
- ρ = 16/29=0,55

- Определите массу 1 литра метана.
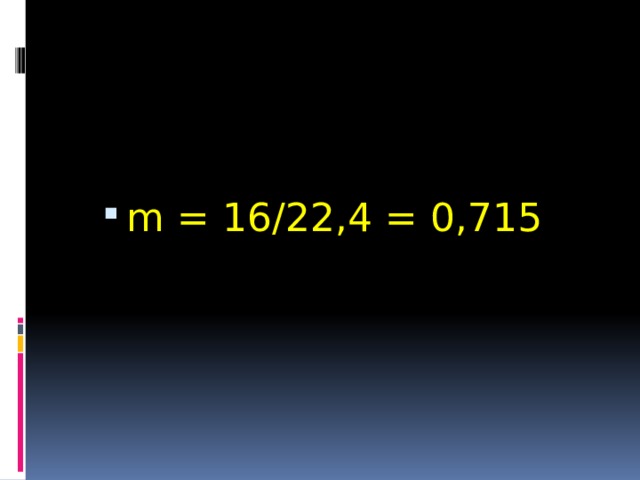
- m = 16/22,4 = 0,715

- Определите массу метана, полученного из 1м 3 природного газа, содержащего 90% метана, находящимся в баллоне под давлением 40 атмосфер.

- 90% от 1м 3 = 900литров; 900литров • 40 атм.= 36 м 3
- 22,4 м 3 – 16кг
- 36 м 3 – Х(=25,7 кг).

 Получите свидетельство
Получите свидетельство Вход
Вход











 Метан и его свойства (60.15 KB)
Метан и его свойства (60.15 KB)
 0
0 2012
2012 21
21 Нравится
0
Нравится
0


