ХИМИЯ
НЕМЕТАЛЛЫ. УГЛЕРОД
9 класс
Л.В. Борисова
Тип урока: урок изучения нового материала.
Вид урока: смешанный
Цель урока. Обеспечить усвоение учащимися на уровне восприятия, осмысления и первичного запоминания знаний состава, строения, свойств и применения углерода; закрепить знания обучающихся об аллотропии. Формирование базовых компетентностей современного человека: учебно-познавательной, информационной, коммуникативной, личностного совершенствования.
Задачи урока:
1. Образовательные: повторить строение атома и аллотропию на примере углерода. Рассмотреть строение, сравнение свойств и применение алмаза и графита. Познакомить учащихся с явлением адсорбции и его практическом значении. Изучить химические свойства углерода. Рассмотреть круговорот углерода в природе.
2. Развивающие: развивать у учащихся умения сравнивать и анализировать теоретические сведения, применять их на практике, делать выводы; развивать логическое мышление.
3. Воспитательные: формировать естественно - научное мировоззрение; информационную культуру; чувство патриотизма на примере научной деятельности русских ученых – химиков (Т.Е. Ловица, Н.Д. Зелинского); бережного отношения к природным ресурсам.
Материально – техническое обеспечение урока: компьютеры; учебник-навигатор «Химия. 9 класс» издательства «Дрофа»; мультимедийный проектор и экран.
Оборудование и реактивы. Периодическая таблица химических элементов Д.И.Менделеева. Модели кристаллических решеток алмаза и графита, репродукции картин В. Боровиковского и фотографии сокровищ Алмазного фонда, образцы изделий из графита (карандаши, электроды и др.) и сажи (тушь, краски, резина и др.), древесный уголь, таблетки карболена, растворы чернил, вишневого компота, сока свеклы; одеколон. Стеклянная трубка диаметром 1,5-2 см (или пробирка с дырявым дном), штатив, вата, речной песок, стакан, колба, прибор для восстановления меди из оксида меди, противогаз, кукурузные палочки, пипетка.
Межпредметные и внутрипредметные связи.
Межпредметная связь с предметами: «Искусство», «География», «Физика», «Биология», «Экология», «ОБЖ», «Геометрия».
Внутрипредметная связь:
– химия, 8 класс - строение атома, химические связи, способы очистки веществ, аллотропия, кристаллические решетки, окислительно-восстановительные свойства;
- химия, 9 класс – получение и химические свойства металлов, химические элементы в клетках живых организмов;
- химия, 10 класс - строение атома углерода, получение метана, природные источники углеводородов;
- химия, 11 класс - валентные возможности атомов химических элементов, неметаллы.
ХОД УРОКА
I. Организационный момент.
Приветствие. Проверка готовности учащихся к учебным занятиям.
II. Актуализация знаний.
Учитель: Из меня состоит все живое,
Я – графит, антрацит и алмаз,
Я на улице, в школе и в поле,
Я в деревьях и в каждом из вас.
Учитель: О каком химическом элементе идет речь в этом стихотворении?
Угадывая название элемента, учащиеся называют тему урока и вместе с учителем формулируют его цель.
Учитель формулирует цель урока:
1. Изучить строение атома углерода, опираясь на положение в Периодической системе химических элементов Д.И. Менделеева.
2. Рассмотреть аллотропные модификации углерода.
3. Изучить химические свойства углерода и познакомиться с его применением.
III. Изучение нового материала
Строение и свойства атомов
Учитель: Охарактеризуйте строение атома углерода на основании его положения в Периодической системе химических элементов Д.И. Менделеева, ответив на вопросы и используя материал электронного учебника:
1. Каков химический знак углерода?
2. Положение в периодической системе химических элементов Д.И. Менделеева (номер периода и его вид, номер группы и тип подгруппы, номер элемента).
3. Каков заряд ядра?
4. Какова атомная масса?
5. Сколько протонов в ядре атома?
6. Сколько нейтронов в ядре атома?
7. Сколько электронов в атоме углерода?
8. Электронная формула атома.
9. Чему равна высшая степень окисления?
10. Чему равна низшая степень окисления?
11. Какие свойства будет проявлять углерод, вступая в химическое взаимодействие?
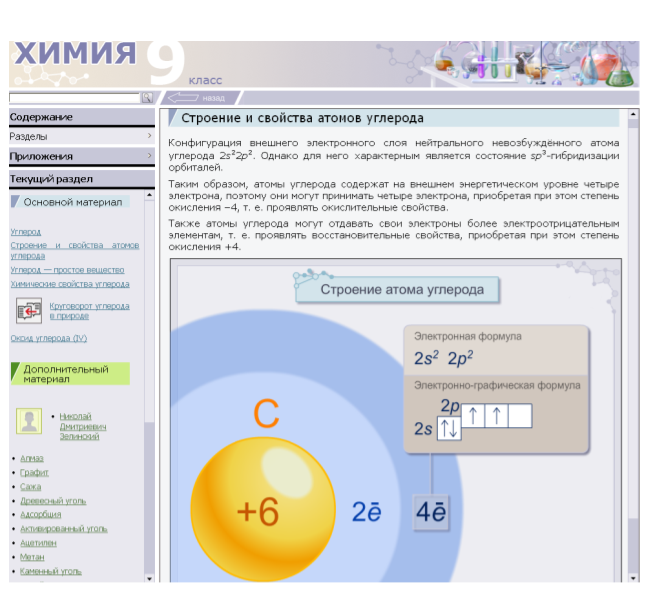
Рис.1 Строение и свойства атомов углерода
Учащиеся характеризуют положение углерода в Периодической системе химических элементов, определяют его порядковый номер и составляют электронную формулу атома, делают соответствующую запись в тетради:
Химический знак – С.
Второй период, малый, IV группа, главная подгруппа, номер элемента – 6.
Заряд ядра +6.
Ar(C) =12.
6 протонов.
6 нейтронов.
6 электронов.
+6С 2  4
4 .
.
Высшая степень окисления +4.
Низшая степень окисления -4.
Исходя из строения атома, прогнозируют окислительно-восстановительные свойства углерода (рис.2):
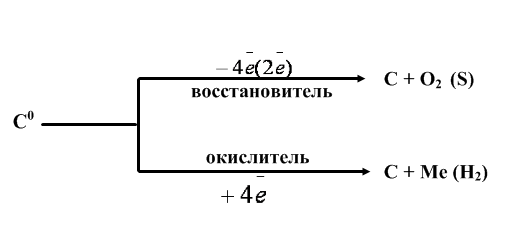
Рис. 2. Окислительно-восстановительные свойства углерода
Аллотропия.
Учитель: Почему углерод – это графит, антрацит и алмаз?
Учащиеся: Углерод образует несколько простых веществ.
Учитель: Как называется такое явление?
Учащиеся: Аллотропия - способность атомов одного химического элемента образовывать несколько простых веществ. Эти простые вещества называются – аллотропными видоизменениями или модификациями.
Учитель: Каковы причины аллотропии углерода?
Учащиеся: Различное строение кристаллических решеток.
Учитель демонстрирует модели решеток алмаза и графита и предлагает учащимся заполнить таблицу «Аллотропные модификации углерода», предварительно ознакомившись с материалом электронного учебника (рис.3).
Рис. 3. Материал электронного учебника
Таблица 1
Аллотропные модификации углерода
| Признаки сравнения | Алмаз | Графит |
| Сходство |
| Качественный состав |
|
|
| Тип вещества |
|
|
| Физические свойства |
|
|
| Различия |
| Кристаллическая решетка |
|
|
| Физические свойства |
|
|
| Применение |
|
|
Заполнив таблицу, учащиеся слушают выступления одноклассников с дополнительной информацией об алмазах, демонстрацией репродукции картин В. Боровиковского и фотографий сокровищ Алмазного фонда.
Учитель: Кроме алмаза и графита, углерод образует и другие аллотропные модификации - это карбин, фуллерен.
Сообщения учащихся о карбине и фуллерене.
Учащиеся (под руководством учителя обобщают полученные знания):
Углерод образует аллотропные модификации: алмаз, графит, карбин, фуллерен. Причина этого явления состоит в разном строении кристаллических решеток:
1) алмаз имеет объемную тетраэдрическую атомную решетку;
2) графит – плоскостную атомную кристаллическую решетку;
3) карбин – линейную;
4) фуллерен – сферическую.
Учитель: Сходное строение с графитом имеют сажа и древесный уголь.
Учащиеся работают с дополнительным материалом электронного учебника.
Рис. 4. Материал электронного учебника
Адсорбция.
Учитель демонстрирует древесный уголь и таблетки карболена (активированный уголь).
Учитель: Что общего между ними?
Учащиеся: И древесный уголь, и активированный уголь обладают способностью поглощать газы и растворенные вещества - адсорбцией.
Учитель демонстрирует адсорбционные свойства угля (Приложение 1).
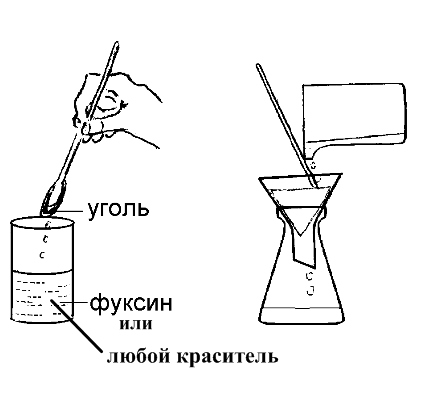
Рис. 5. Адсорбционные свойства угля
Учитель: Открытое русским химиком Т.Е. Ловицем явление адсорбции широко используется для очистки сахара на рафинадных заводах от веществ, придающих ему желтый цвет; для очистки спирта.
На поглотительной способности активированного угля также основано и действие противогазов – устройства для защиты от вредных примесей, имеющихся в воздухе. Первый противогаз был изобретен Н.Д.Зелинским и спас жизнь тысячам солдат в период Первой мировой войны.
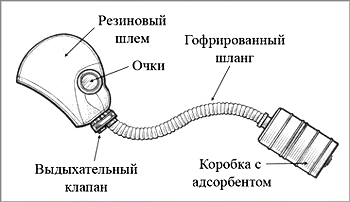
Рис. 6. Устройство противогаза
Учащиеся знакомятся с биографией ученого по дополнительному материалу из электронного учебника.
Химические свойства углерода.
Учитель: Рассмотрим химические свойства углерода. Итак, исходя из электронного строения атома углерода, мы выяснили, что углерод может проявлять восстановительные и окислительные свойства. Причем при обычных условиях углерод химически малоактивен, однако при нагревании он реагирует со многими веществами. Таким образом, все реакции углерода протекают при высоких температурах (от 600-17000С). Самой активной формой является аморфный углерод, менее активен - графит, самый инертный – алмаз.
Учащиеся записывают уравнения химических реакций и проводят виртуальный лабораторный опыт «Горение угля в кислороде» (табл.2).
Таблица 2
| Углерод - восстановитель | Углерод - окислитель |
| При нагревании углерод соединяется с кислородом, образуя оксид углерода (IV), или углекислый газ: С + O2 = CO2
Виртуальный лабораторный опыт «Горение угля в кислороде». При недостатке кислорода образуется оксид углерода (II) или угарный газ: 2С + О2 = 2СО | С водородом углерод соединяется только при высоких температурах и в присутствии катализаторов. В зависимости от температуры образуются различные углеводороды, например, метан: С + 2H2 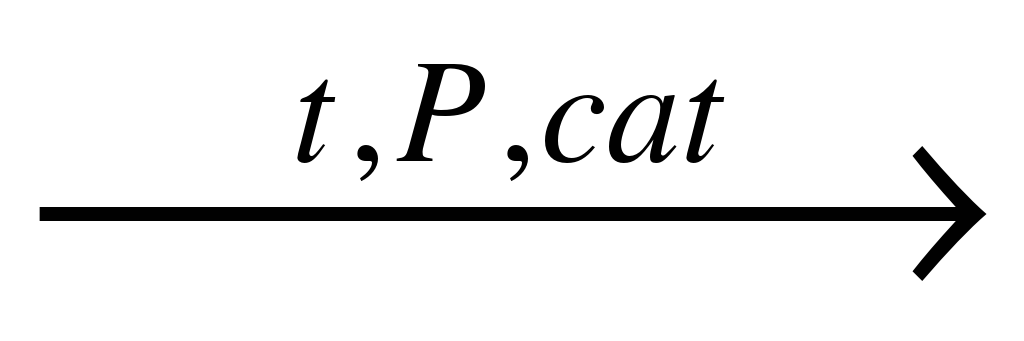 CH4 CH4 |
| Углерод взаимодействует при нагревании с серой и фтором: С + 2S = CS2 (сероуглерод); С + 2F2 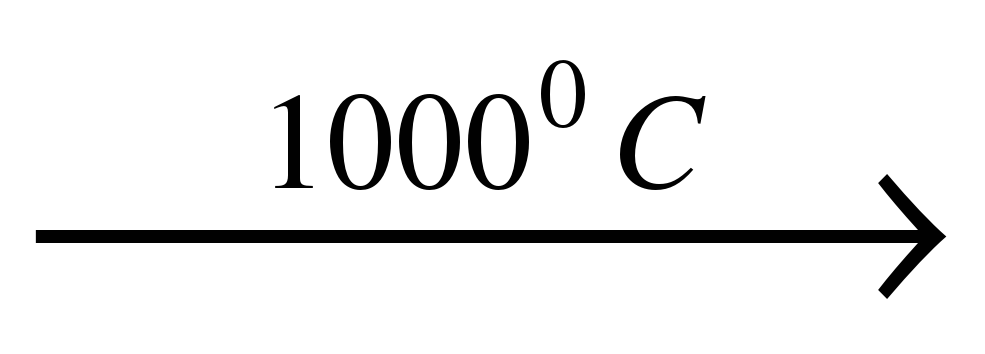 CF4 (фторид углерода) CF4 (фторид углерода) | С металлами или их оксидами углерод образует карбиды: 4Al + 3C = Al4C3 CaO + 2C = CaC2 + СО |
| При нагревании с водяным паром он вытесняет из воды водород: Н2O + С = СО + Н2 |
|
| Углерод восстанавливает многие металлы из их оксидов: 2CuO + C = CO2 + 2Cu Демонстрационный опыт «Восстановление меди из оксида меди (II) углем» |
|
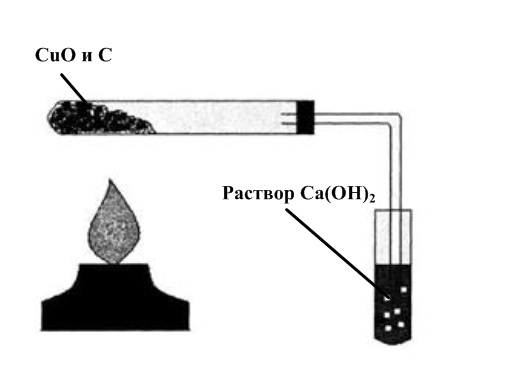
Рис.7. восстановление меди из оксида меди (II) углем
Учитель проводит демонстрационный опыт «Восстановление меди из оксида меди (II) углем» (Приложение 2).
Природные соединения углерода.
Учитель: Итак, мы выяснили, что атомы углерода могут соединяться разнообразными способами между собой и с атомами многих других элементов, образуя огромное многообразие веществ. А в каком же виде углерод встречается в природе?
Учащиеся: В природе углерод встречается как в свободном виде (алмаз, графит), так и в связанном. В связанном состоянии углерод входит в состав карбонатов (CaCO3 - мел, известняк, мрамор, MgCO3 – магнезит, CaCO3·MgCO3- доломит), в каменных и бурых углях, торфе. Углерод входит в состав всех живых и растительных организмов, нефти, природного газа, углей.
Учащиеся знакомятся с природными соединениями углерода по дополнительному материалу из электронного учебника.
Круговорот углерода в природе.
Учитель: Все перечисленные источники углерода участвуют в круговороте его в природе.
Учащиеся работают по материалу «Круговорот углерода в природе» электронного учебника (рис. 8).
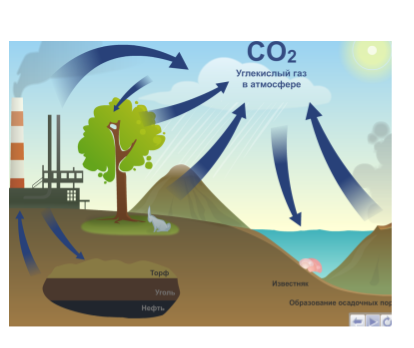
Рис. 8. Круговорот углерода в природе
IV. Этап первичного закрепления в обобщающей беседе.
Учитель задает вопросы, учащиеся отвечают на них.
- Почему алмаз, графит и уголь называют «родными братьями»?
- От чего зависит твердость алмаза и мягкость графита?
- Для каких целей применяют алмаз и графит?
- О каком явлении рассказывается в сказке «Мороз Иванович»?
“Между тем Рукодельница воротится, воду процедит, в кувшины нальёт, да ещё какая затейница: коли вода нечиста, так свернет лист бумаги, наложит в неё угольков да песку крупного насыплет, вставит ту бумагу в кувшин да нальёт в неё воды, а вода-то, знай, проходит сквозь песок да сквозь уголья и капает в кувшин чистая, словно хрустальная”.
- Где еще в настоящее время широко используется явление адсорбции?
(Медицина, военное дело, химическая промышленность.)
- Назовите природные соединения углерода.
- Каковы химические свойства углерода?
- В каких условиях протекает большинство реакций с участием углерода?
- Чем объясняется невысокая химическая активность углерода?
- Какая из модификаций углерода химически наиболее активна?
V. Рефлексивно-оценочный этап (первичный контроль) - тестирование.
Учитель предлагает проверить, как дети внимательно слушали друг друга и что запомнили.
Учащиеся работают в интерактиве «Характеристика углерода» электронного учебника.
После того, как они выполнили задания, на экран мультимедийного проектора отображаются критерии оценивания.
Учащиеся оценивают свою работу. Рефлексия с помощью сигнальных карточек.
Учащиеся работают с сигнальными карточками, которые показывают итог тестирования. Красные – рейтинг 5; синие – рейтинг 4; зеленые – рейтинг 3.
По желанию учащихся, полученные оценки можно выставить в журнал.
VI. Домашнее задание.
Предлагается учащимся в двух формах:
1) обычной - по учебнику О.С. Габриеляна «Химия 9 класс» (М.: Дрофа, 2009) § 29, упр. 6,8;
2) творческой (по желанию):
• Выполнить творческое задание в программе Microsoft Power Point по теме «Алмаз - уникальный камень» или написать сказку с участием углерода и прислать на электронный адрес учителя.
• Проделать дома опыт, доказывающий адсорбционные свойства угля.
Налейте в емкость воду объемом 40-50 см3 и добавьте 1-3 капли чернил, чтобы получился слабо окрашенный раствор. Затем добавьте 3-5 таблеток активированного угля и круговыми движениями колбы интенсивно перемешайте смесь. Дайте смеси отстоятся. Если обесцвечивания не произошло, добавьте еще 2-3 таблетки угля и повторите перемешивание. Убедившись, что адсорбция произошла полностью, профильтруйте смесь.
VII. Подведение итогов. Рефлексия.
Учитель: Прочитайте цель урока. Достигли ли вы цели урока? В какой степени? Оцените свою работу на уроке.
Учитель подводит итог урока, проводит рефлексию, где учащиеся показывают результаты усвоения новых знаний, оценивают и комментируют работу наиболее активных учащихся.
Уходя с урока, учащиеся дорисовывают волосы заранее нарисованным рожицам: грустной или веселой в зависимости от их настроения и эмоционального состояния. По их шевелюре можно понять понравился ли урок или нет.
Литература
1. Габриелян, О.С. Химия. 9 класс [Текст]: учебник для общеобразовательных учреждений / О.С. Габриелян. - М.: Дрофа, 2012.
2. Габриелян, О.С. Настольная книга учителя. Химия. 9 класс [Текст] / О.С. Габриелян. - М.: Дрофа, 2002.
3. Габриелян, О.С. Химия 9 класс: рабочая тетрадь [Текст]/ О.С. Габриелян. - М.: Дрофа, 2013.
4. Габриелян, О.С. Программа курса химии для 8-11 классов общеобразовательных учреждений [Текст] / О.С. Габриелян. - М.: Дрофа, 2012.
5. Книга для чтения по неорганической химии [Текст]: в 2 ч. Ч. 2 / сост. В.А.Крицман. – М.: Просвещение, 1992.
6. Габриелян, О.С. Химия. 9 класс. Учебник – навигатор [Текст] / О.С. Габриелян, В.И. Сивоглазов, С.А. Сладков. - М.: Дрофа, 2013.
7. Химический эксперимент в школе [Текст] /Т.С. Назарова, А.А. Грабецкий, В.Н. Лаврова.- М.:Просвещение, 1987.
8. Химия: Большой справочник для школьников и поступающих в вузы [Текст] /Е.А.Алферова, Н.С.Ахметов, Н.В.Богомолова и др. - М.: Дрофа,1999.
Приложение 1.
Адсорбционные свойства угля.
1. В стеклянную трубочку (можно использовать пробирку без дна) или стеклянную воронку помещают рыхлый слой ваты, порошок растертого карболена (таблетки активированного угля) и небольшое количество предварительно промытого и высушенного речного песка. Трубку закрепляют в лапке штатива (воронку кладут на кольцо) и наливают в нее разбавленные растворы чернил, перманганата калия, медного купороса, вишневого компота, сока столовой свеклы и т.д. Для собирания жидкости, прошедшей через слой адсорбента, под трубку помещают стакан. В него стекает бесцветная, прозрачная жидкость.
2. Колбу предварительно заполняют оксидом азота(IV) и плотно закрывают ее пробкой. Оксид азота(IV) можно получить взаимодействием концентрированной азотной кислоты с медью. В колбу с бурым NO2 насыпают измельченный карболен или древесный уголь и несколько раз ее встряхивают. Бурая окраска исчезает.
3. В сухую колбу капают одну каплю одеколона и колбу нагревают до образования пара. В нее опускают немного измельченного древесного угля и встряхивают. Запах полностью исчезает.
Адсорбцию можно показать и с помощью обыкновенных кукурузных палочек.
4. Два цилиндра наполняют углекислым газом. В один цилиндр помещают несколько кукурузных палочек и встряхивают. Затем в два стакана приливают немного известковой воды, а потом в них «переливают» углекислый газ из цилиндров. Раствор известковой воды мутнеет в том стакане, где нет палочек.
Приложение 2.
Демонстрационный опыт «Восстановление меди из оксида меди (II) углем»
Прокалить в пробирке смесь черного порошка оксида меди (II) с порошком древесного угля. Смесь приобретет красный цвет из-за образовавшейся в результате реакции меди:
2CuO + C = CO2 + 2Cu


 Получите свидетельство
Получите свидетельство Вход
Вход




















 Методическая разработка урока по химии "Неметаллы. Углерод" (0.79 MB)
Методическая разработка урока по химии "Неметаллы. Углерод" (0.79 MB)
 2
2 537
537 6
6







Успехов Вам в работе!