Химические реакции.

Химические реакции – это реакции, при которых из атомов вступивших в реакцию веществ образуются новые вещества (простые или сложные), причем общее число атомов каждого элемента всегда остается постоянным.
Химические реакции классифицируют по различным признакам.
По признаку выделения или поглощения теплоты. Реакции протекающие с выделением теплоты называются экзотермическими.
H2+Cl2=2HCL H=-184.6 кДж
Реакции, протекающие с поглощением теплоты из окружающей среды, называются эндотермическими.
N2+2O2=2NO2 H=180.8 кДж
Количество выделенной или поглощенной в результате реакции теплоты называется тепловым эффектом.
Тепловой эффект обозначают H и выражают в килоджоулях (кДж).
Энтальпия (Н) – это внутренняя энергия вещества, поэтому у экзотермических процессов H – отрицательная величина (теплота выделяется), а у эндотермических H – положительная (теплота поглощается).
По признаку обратимости реакции делят на обратимые и необратимые.
Обратимые – реакции, которые протекают одновременно в двух взаимно противоположных направлениях и не доходят до конца.
3H2+N2 2NH3
В уравнениях обратимых реакций между левой и правой частями ставятся две стрелки, направленные в противоположные стороны.
Необратимые – реакции, которые протекают только в одном направлении и завершаются полным превращением исходных веществ в конечные продукты.
Признаками необратимости реакций являются:
BaCl2+Na2SO4=BaSO4+2NaCl
CaCO3+2HCl=CaCl2+H2O+CO2
NaOH+HNO3=NaNO3+H2O
Поскольку угольная кислота H2CO3 и гидрооксид аммония NH4OH существуют только в растворах, то вместо их молекулярных формул в уравнениях реакций записываются продукты их распада:
ЗАПОМНИТЬ:

H2CO3H2O+CO2
NH4OHNH3+H2O
3. По изменению числа исходных данных и конечных веществ реакции подразделяют на следующие типы:
Соединения;
Разложения;
Замещения;
Обмена.
Реакции соединения – реакции, в результате которых из двух или нескольких веществ образуется одно вещество.
2Na+Cl2=2NaCl
CaO+CO2=CaCO3
Реакции разложения – реакции, в результате которых из одного вещества образуется несколько новых веществ.
2HgO=2Hg+O2
2KMnO4=K2MnO4+O2+МnО2
Реакции замещения – реакции между простыми и сложными веществами, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества.
CuSO4+Fe=Cu+FeSO4
2HCl+Zn=ZnCl2+H2
Реакции обмена – реакции, в результате которых два вещества обмениваются своими составными частями, образуя два новых вещества.
2Al(OH)3+6HCl=2AlCl3+3H2O
BaCl2+Na2SO4=BaSO4+2NaCl
HCl+AgNO3=AgCl+HNO3
По признаку изменения степени окисления атомов, входящих в состав реагирующих веществ, различают реакции, протекающие без изменения степени окисления атомов (электроностатические реакции) и окислительно-восстановительные реакции (с изменением степени окисления атомов).
. Скорость химических реакций.
Химическое равновесие.

Скорость химической реакции - это изменение концентрации одного из реагирующих веществ в единицу времени.
Концентрацию реагирующих веществ выражают в моль/л, а время – в секундах или минутах. Математическое выражение для скорости реакции:
V = 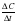
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации C, температуры tº; присутствия катализаторов и др.
Влияние концентрации. Зависимость скорости реакции от концентрации реагирующих веществ характеризуется законом действующих масс:
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
Для реакции, протекающей по уравнению:
mA + nB = qAB
этот закон в общем виде будет записан:
V = K•CmA•CnB или V = K• [A]m •[B]n,
где CA, CB или [A], [B] - концентрации веществ А и В в моль/л; К – константа скорости реакции; m, n – стехиометрические коэффициенты.
Константа скорости реакции (К) – величина постоянная для каждой реакции. Она зависит от природы реагирующих веществ и температуры, но не зависит от концентрации. Константа скорости численно равна скорости реакции при концентрациях реагирующих веществ, равных 1 моль/л т.е. V = К
Задача: Записать выражение закона действующих масс для реакций: а) синтез аммиака; б) горение угля.
Решение:
а) N2 + 3H2 = 2NH3
Закон действующих масс для данной реакции будет иметь вид:
V = K•[N2] • [H2]3
б) С + О2 = СО2
Для реакции горения угля закон действующих масс запишется так:
V = K•[О2]
Концентрация твердого угля не учитывается.
Влияние температуры. Зависимость скорости реакции от температуры определяется правилом Вант-Гоффа:
При повышении температуры на каждые 10 скорость реакции увеличивается в 2-4 раза.
Математически эта зависимость выражается соотношением:
 Vt2 = Vt1•γ (t2-t1) / 10
Vt2 = Vt1•γ (t2-t1) / 10
где Vt2 и Vt1 – скорости реакций при начальной (t1) и конечной (t2) температурах; γ - температурный коэффициент.
Задача: Определить, во сколько раз увеличится скорость реакции, при нагревании от 20 до 6, если температурный коэффициент равен 2.
Решение:
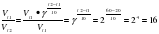 раз
раз
Влияние катализаторов.

Катализаторы – это вещества, изменяющие скорость химических реакций, при этом находятся в числе продуктов реакции в неизменном состоянии.
Катализаторы бывают ускоряющими реакцию (положительные) и замедляющие реакцию (отрицательные) или ингибиторы. Изменение скорости реакции с помощью катализатора называется катализом.
Катализ бывает двух типов: гомогенный и гетерогенный.

Гомогенный катализ – реагирующие вещества и катализатор образуют однородную, однофазную систему. Например, окисление сернистого газа в серный ангидрид осуществляется с участием катализатора NO2:
SO2 + NO2 = SO3 + NO
2NO + O2 = 2NO2



Гетерогенный катализ – реагирующие вещества и катализатор составляют неоднородную, многофазную систему. Например, взаимодействие газообразных веществ на поверхности твердого катализатора: N2 + 3H2 2NH3 (катализатор – металлическое железо)

Биокатализаторы – ферменты, которые ускоряют реакции в 1012 – 1013 раз.
Обратимость реакций.
Обратимые реакции отличаются от необратимых тем, что не доходят до конца, одновременно идут в обе стороны: в сторону образования продуктов реакции (прямая реакция) и их разложения (обратная реакция) и заканчивается установлением химического равновесия. Например:
прямая реакция


3H2 + N2 2NH3
обратная реакция

Химическое равновесие – такое состояние системы реагирующих веществ, при котором скорости прямой и обратной реакции равны:
V1 = V2
Химическое равновесие характеризуется следующими признаками:
Прямая и обратная реакция не прекращаются, скорости их равны.
Равновесие является подвижным и чутко реагирует на изменение внешних условий (концентрация, температура, давление), и при новых условиях создается новое равновесие, отличное от прежнего.
При установившихся условиях (постоянной температуре, давлении) концентрации компонентов остаются неизменными как угодно долго, и называются равновесными.

Константа равновесия – количественная характеристика химического равновесия, показывающая во сколько раз скорость прямой реакции больше обратной.
Константа равновесия равна отношению произведения концентраций образующихся веществ к произведению концентраций исходных веществ.
Для обратимой реакции:

 mA + nB pC + qD
mA + nB pC + qD
Константа равновесия будет иметь вид:
K = 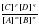
Константа равновесия – величина постоянная для данной реакции при данной температуре: она зависит от природы реагирующих веществ, но не зависит от концентрации.
Положение равновесия может быть нарушено, смещено изменением внешних условий: концентрации, температуры, давления (давления).

Смещение равновесия. Направление смещения равновесия определяется принципом (правилом) Ле-Шателье.
Если на систему, находящуюся в равновесии, оказывается внешнее воздействие (изменение С, t˚, p), то равновесие сдвигается в сторону той реакции, которая противодействует данному изменению.
Из правила Ле-Шателье следует:
При увеличении концентрации исходных веществ и уменьшении концентрации продуктов реакции равновесие смещается в сторону прямой реакции: образования продуктов реакции, т.е. практически до конца.
Например:



2C + O2 2CO
увеличение [O2] или уменьшение [CO] сдвигает равновесие в сторону прямой реакции.
При повышении температуры равновесие смещается в сторону эндотермической реакции; при понижении температуры в сторону экзотермической.
Например:

Повышение t N2 + O2 2NO  H = 180 кДж
H = 180 кДж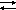
прямая реакция – эндотермическая

Понижение t H2 + Cl2 2HCl  H = -184,6 кДж
H = -184,6 кДж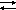
прямая реакция – экзотермическая
При увеличении давления равновесие смещается в сторону образования газов с меньшим числом молекул; при уменьшении давления – в сторону большего числа молекул.
Например:

Повышение P N2 + 3H2 2NH3 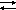
4 моля 2 моля

Понижение P 2NO + O2 2NO2 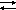
3 моля 2 моля
Изменение Р H2 + J2 2HJ
не смещает равновесия 2 моля 2 моля
Решение типовых задач.
Задача: Как изменится скорость реакции 2SO2 + O2 2SO3, если увеличить концентрацию реагирующих веществ в 3 раза?
Решение:
Выразим начальные концентрации реагирующих веществ:
[SO2] = a [O2] = b. Тогда по закону действующих масс скорость реакции в начальный момент равна:
V1 = K•[SO2] • [O2] = K• a2• b
в результате увеличения концентраций реагирующих веществ в 3 раза они стали равны соответственно [SO2] = 3а и [O2] = 3b. При новых концентрациях скорость реакции стала равна:
V2 = K•[SO2]2 • [O2] = K• (3a)2• 3b = K• 27a2• b
находим отношение:

Ответ: скорость реакции возросла в 27 раз.
Задача: Как повлияет на равновесие реакции N2 + 3H2 2NH3 – 91,8 кДж а) увеличение давления; б) повышение температуры; в) увеличение концентрации водорода?
Решение:
а) Для газообразной системы N2 + 3H2 2NH3 имеем в левой части уравнения 4 молекулы, в правой – 2 молекулы. В соответствии с правилом Ле-Шателье увеличение давления будет смещать равновесие в сторону той реакции, которая идет с образованием меньшего числа молекул, т.е. в сторону образования аммиака.
б) Реакция образования аммиака – экзотермическая  H = -91,8 кДж, поэтому повышение температуры будет смещать равновесие в сторону эндотермической реакции, т.е. в сторону исходных веществ.
H = -91,8 кДж, поэтому повышение температуры будет смещать равновесие в сторону эндотермической реакции, т.е. в сторону исходных веществ.
в) При увеличении концентрации водорода по закону действующих масс сразу возрастет скорость прямой реакции, следовательно равновесие сместиться в сторону образования аммиака.


 Получите свидетельство
Получите свидетельство Вход
Вход






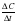
 Vt2 = Vt1•γ (t2-t1) / 10
Vt2 = Vt1•γ (t2-t1) / 10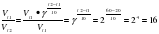 раз
раз







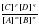











 Материал по химии по теме "Химические реакции" (41.42 КB)
Материал по химии по теме "Химические реакции" (41.42 КB)
 0
0 426
426 58
58 Нравится
0
Нравится
0






