| 1.Общая характеристика алюминия. Главную подгруппу III группы периодической системы составляют бор (В),алюминий (Аl), галлий (Ga), индий (In) и таллий (Тl). Как видно из приведенных данных, все эти элементы были открыты в XIXстолетии. Открытие металлов главной подгруппы III группы | В | Al | Ga | In | Tl | | 1806 г. | 1825 г. | 1875 г. | 1863 г. | 1861 г. | | Г.Люссак, | Г.Х.Эрстед | Л. де Буабодран | Ф.Рейх, | У.Крукс | | Л. Тенар | (Дания) | (Франция) | И.Рихтер | (Англия) | | (Франция) |
|
| (Германия) |
| Бор представляет собой неметалл. Алюминий - переходный металл, а галлий, индий и таллий - полноценные металлы. Таким образом, с ростом радиусов атомов элементов каждой группы периодической системы металлические свойства простых веществ усиливаются. В данной лекции мы подробнее рассмотрим свойства алюминия. 2. Положение алюминия в таблице Д. И. Менделеева. Строение атома, проявляемые степени окисления. Элемент алюминий расположен в III группе, главной «А» подгруппе, 3 периоде периодической системы, порядковый номер №13, относительная атомная массаAr(Al) → 27. Его соседом слева в таблице является магний – типичный металл, а справа – кремний – уже неметалл. Следовательно, алюминий должен проявлять свойства некоторого промежуточного характера и его соединения являются амфотерными. Al +13 )2)8)3, p –элемент, | Основное состояние 1s22s22p63s23p1 | 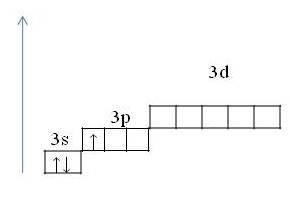
| | Возбуждённое состояние 1s22s22p63s13p2 | 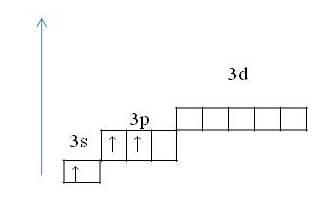
| Алюминий проявляет в соединениях степень окисления +3: Al0– 3e-→Al+3 3. Физические свойства, нахождение в природе Алюминий в свободном виде - серебристо-белый металл, обладающий высокой тепло- и электропроводностью.Температура плавления 650 оС. Алюминий имеет невысокую плотность (2,7 г/см3) - примерно втрое меньше, чем у железа или меди, и одновременно - это прочный металл. По распространённости в природе занимает 1-е среди металлов и 3-е место среди элементов, уступая только кислороду и кремнию. Процент содержания алюминия в земной коре по данным различных исследователей составляет от 7,45 до 8,14% от массы земной коры. В природе алюминий встречается только в соединениях(минералах). Некоторые из них: ·Бокситы - Al2O3• H2O (с примесями SiO2, Fe2O3, CaCO3) ·Нефелины - KNa3[AlSiO4]4 ·Алуниты - KAl(SO4)2• 2Al(OH)3 ·Глинозёмы (смеси каолинов с песком SiO2, известняком CaCO3, магнезитом MgCO3) ·Корунд - Al2O3 ·Полевой шпат (ортоклаз) - K2O•Al2O3•6SiO2 ·Каолинит - Al2O3•2SiO2• 2H2O ·Алунит - (Na,K)2SO4•Al2(SO4)3•4Al(OH)3 ·Берилл - 3ВеО • Al2О3• 6SiO2 | Боксит |
| | Al2O3 |  Корунд | |
|  Рубин | |
|  Сапфир Сапфир
| 4.Химические свойства алюминия и его соединений | Алюминий легко взаимодействует с кислородом при обычных условиях и покрыт оксидной пленкой (она придает матовый вид).
| 
| ДЕМОНСТРАЦИЯ ОКСИДНОЙ ПЛЁНКИ Её толщина 0,00001 мм, но благодаря ней алюминий не коррозирует. Для изучения химических свойств алюминия оксидную пленку удаляют. (При помощи наждачной бумаги, или химически: сначала опуская в раствор щелочи для удаления оксидной пленки, а затем в раствор солей ртути для образования сплава алюминия со ртутью – амальгамы). I. Взаимодействие с простыми веществами Алюминий уже при комнатной температуре активно реагирует со всеми галогенами, образуя галогениды. При нагревании он взаимодействует с серой (200 °С), азотом (800 °С), фосфором (500 °С) и углеродом (2000 °С), с йодом в присутствии катализатора - воды: 2Аl + 3S→ Аl2S3 (сульфид алюминия), 2Аl + N2→2АlN (нитрид алюминия), Аl + Р → АlР (фосфид алюминия), 4Аl + 3С → Аl4С3 (карбид алюминия). 2 Аl + 3I2→2 AlI3 (йодид алюминия) ОПЫТ Все эти соединения полностью гидролизуются с образованием гидроксида алюминия и, соответственно, сероводорода, аммиака, фосфина и метана: Al2S3 + 6H2O → 2Al(OH)3 + 3H2S Al4C3 + 12H2O → 4Al(OH)3+ 3CH4 В виде стружек или порошка он ярко горит на воздухе, выделяя большое количество теплоты: 4Аl+ 3O2→ 2Аl2О3+ 1676 кДж. ГОРЕНИЕ АЛЮМИНИЯ НА ВОЗДУХЕ ОПЫТ II. Взаимодействие со сложными веществами Взаимодействие с водой: 2 Al + 6 H2O→2 Al (OH)3+3 H2 без оксидной пленки ОПЫТ Взаимодействие с оксидами металлов: Алюминий – хороший восстановитель, так как является одним из активных металлов. Стоит в ряду активности сразу после щелочно-земельных металлов. Поэтому восстанавливает металлы из их оксидов. Такая реакция – алюмотермия – используется для получения чистых редких металлов, например таких, как вольфрам, ваннадий и др 3 Fe3O4+8 Al →4 Al2O3+ Fe +Q Термитная смесь Fe3O4 и Al (порошок) – используется ещё и в термитной сварке. Сr2О3 + 2Аl → 2Сr + Аl2О3 Взаимодействие с кислотами: С раствором серной кислоты: 2 Al + 3 H2SO4 → Al2(SO4)3 + 3 H2 С холодными концентрированными серной и азотной не реагирует (пассивирует). Поэтому азотную кислоту перевозят в алюминиевых цистернах. При нагревании алюминий способен восстанавливать эти кислоты без выделения водорода: 2Аl + 6Н2SО4(конц) → Аl2(SО4)3 + 3SО2 + 6Н2О, Аl + 6НNO3(конц) → Аl(NO3)3 + 3NO2 + 3Н2О. Взаимодействие со щелочами. 2 Al + 2 NaOH + 6 H2O →2 Na[Al(OH)4] + 3 H2 ОПЫТ Na[Аl(ОН)4] – тетрагидроксоалюминат натрия По предложению химика Горбова, в русско-японскую войну эту реакцию использовали для получения водорода для аэростатов. С растворами солей: 2Al + 3CuSO4 → Al2(SO4)3 + 3Cu Если поверхность алюминия потереть солью ртути, то происходит реакция: 2Al + 3HgCl2 → 2AlCl3 + 3Hg Выделившаяся ртуть растворяет алюминий, образуя амальгаму. Обнаружение ионов алюминия в растворах: ОПЫТ 5. Применение алюминия и его соединений Приложение 1 РИСУНОК 1 Приложение 2 РИСУНОК 2
Физические и химические свойства алюминия обусловили его широкое применение в технике. Крупным потребителем алюминия является авиационная промышленность: самолет на 2/3 состоит из алюминия и его сплавов. Самолет из стали оказался бы слишком тяжелым и смог бы нести гораздо меньше пассажиров. Поэтому алюминий называют крылатым металлом. Из алюминия изготовляют кабели и провода: при одинаковой электрической проводимости их масса в 2 раза меньше, чем соответствующих изделий из меди. Учитывая коррозионную устойчивость алюминия, из него изготовляют детали аппаратов и тару для азотной кислоты. Порошок алюминия является основой при изготовлении серебристой краски для защиты железных изделий от коррозии, а также для отражения тепловых лучей такой краской покрывают нефтехранилища, костюмы пожарных. Оксид алюминия используется для получения алюминия, а также как огнеупорный материал. Гидроксид алюминия – основной компонент всем известных лекарств маалокса, альмагеля, которые понижают кислотность желудочного сок. Соли алюминия сильно гидролизуются. Данное свойство применяют в процессе очистки воды. В очищаемую воду вводят сульфат алюминия и небольшое количество гашеной извести для нейтрализации образующейся кислоты. В результате выделяется объемный осадок гидроксида алюминия, который, оседая, уносит с собой взвешенные частицы мути и бактерии. Таким образом, сульфат алюминия является коагулянтом. 6. Получение алюминия 1) Современный рентабельный способ получения алюминия был изобретен американцем Холлом и французом Эру в 1886 году. Он заключается в электролизе раствора оксида алюминия в расплавленном криолите. Расплавленный криолит Na3AlF6растворяет Al2O3,как вода растворяет сахар. Электролиз “раствора” оксида алюминия в расплавленном криолите происходит так, как если бы криолит был только растворителем, а оксид алюминия - электролитом. 2Al2O3эл.ток→4Al + 3O2 В английской “Энциклопедии для мальчиков и девочек” статья об алюминии начинается следующими словами: “23 февраля 1886 года в истории цивилизации начался новый металлический век - век алюминия. В этот день Чарльз Холл, 22-летний химик, явился в лабораторию своего первого учителя с дюжиной маленьких шариков серебристо-белого алюминия в руке и с новостью, что он нашел способ изготовлять этот металл дешево и в больших количествах”. Так Холл сделался основоположником американской алюминиевой промышленности и англосаксонским национальным героем, как человек, сделавшим из науки великолепный бизнес. 2) 2Al2O3 + 3 C →4 Al + 3 CO2 7. Вопросы для самоконтроля Ответьте на вопросы: а) Чем отличается алюминий по химическим свойствам от других типичных металлов, ответ подтвердите уравнениями реакций. б) Почему, алюминиевые изделия, используемые в быту, не вступают в химические реакции с кислотами, щелочами, не окисляются?
8. Задания для закрепления №1. Для получения алюминия из хлорида алюминия в качестве восстановителя можно использовать металлический кальций. Составьте уравнение данной химической реакции, охарактеризуйте этот процесс при помощи электронного баланса.
Подумайте! Почему эту реакцию нельзя проводить в водном растворе? №2. Закончите уравнения химических реакций:
Al + H2SO4 (раствор) →
Al + CuCl2→
Al + HNO3(конц) -t→
Al + NaOH + H2O → №3. Осуществите превращения:
Al →AlCl3 →Al → Al2S3→ Al(OH)3t→Al2O3→Al №4. Решите задачу:
На сплав алюминия и меди подействовали избытком концентрированного раствора гидроксида натрия при нагревании. Выделилось 2,24 л газа (н.у.). Вычислите процентный состав сплава, если его общая масса была 10 г?
Список литературы Программы для общеобразовательных учреждений, ХИМИЯ, 8 – 11 класс, Москва, Дрофа, 2001г. Р.П.Суровцева и др., ХИМИЯ, методическое пособие 10 – 11 класс, Москва, Дрофа, 2000г. Л.С.Гузей, Р.П.Суровцева, ХИМИЯ – учебники 9, 10 класс, Москва, Дрофа, 1998г. Энциклопедический словарь юного химика, Москва, Педагогика, 1990г. Школьная энциклопедия ХИМИЯ, Москва, Дрофа, 2000г. Э.Т.Оганесян, Важнейшие понятия и термины в химии, Москва, Высшая школа, 1993г. Э.Т.Оганесян, Руководство по химии поступающим в вузы, Москва, Высшая школа, 1991г. С.И.Венецкий,Ю Рассказы о металлах, Москва, Металлургия, 1975г.
Приложение1 ЭТО ИНТЕРЕСНО: Металлический алюминий первым выделил в 1825 году датский физик Ханс Кристиан Эрстед. Пропустив газообразный хлор через слой раскаленного оксида алюминия, смешанного с углем, Эрстед выделил хлорид алюминия без малейших следов влаги. Чтобы восстановить металлический алюминий, Эрстеду понадобилось обработать хлорид алюминия амальгамой калия. Через 2 года немецкий химик Фридрих Вёллер. Усовершенствовал метод, заменив амальгаму калия чистым калием. В 18-19 веках алюминий был главным ювелирным металлом. В 1889 году Д.И.Менделеев в Лондоне за заслуги в развитии химии был награжден ценным подарком – весами, сделанными из золота и алюминия. К 1855 году французский ученый Сен- Клер Девиль разработал способ получения металлического алюминия в технических масштабах. Но способ был очень дорогостоящий. Девиль пользовался особым покровительством Наполеона III, императора Франции. В знак своей преданности и благодарности Девиль изготовил для сына Наполеона, новорожденного принца, изящно гравированную погремушку – первое «изделие ширпотреба» из алюминия. Наполеон намеревался даже снарядить своих гвардейцев алюминиевыми кирасами, но цена оказалась непомерно высокой. В то время 1 кг алюминия стоил 1000 марок, т.е. в 5 раз дороже серебра. Только после изобретения электролитического процесса алюминий по своей стоимости сравнялся с обычными металлами. А знаете ли вы, что алюминий, поступая в организм человека, вызывает расстройство нервной системы. При его избытке нарушается обмен веществ. А защитными средствами является витамин С, соединения кальция, цинка. При сгорании алюминия в кислороде и фторе выделяется много тепла. Поэтому его используют как присадку к ракетному топливу. Ракета "Сатурн" сжигает за время полёта 36 тонн алюминиевого порошка. Идея использования металлов в качестве компонента ракетного топлива впервые высказал Ф. А. Цандер. | 

 Получите свидетельство
Получите свидетельство Вход
Вход







 Сапфир
Сапфир











 Лекция по химии на тему "Алюминий его физические и химические свойства" (0.69 MB)
Лекция по химии на тему "Алюминий его физические и химические свойства" (0.69 MB)
 0
0 1191
1191 58
58 Нравится
0
Нравится
0


