Урок химии в технологии продуктивного обучения
Урок химии, 8 класс
Тема: Физические и химические свойства кислот.
Гайдучик Н.А. - Учитель химии
гимназии Новокаховского горсовета

2013 год. Декабрь.
Урок проводится согласно структуре создания продуктивного урока и состоит из 7 этапов. Кроме этого для проведения урока используются элементы медиа образования и фрагменты технологий: интерактивной, критического мышления, проблемной. Объяснение нового материала осуществляется путём чтения учителем мини - лекции, которая сопровождается презентацией (PowerРoint), при защите работ учащихся используется демонстрация пяти виртуальных экспериментов.
1 этап. Пропедевтическая практика.
На этом этапе проводится организация класса, проверка домашнего задания и актуализация опорных знаний проводится путём решения кроссворда.
2 этап. Ориентация
На этом этапе ученики знакомятся с целями урока (тема и цели предлагаются в распечатанном виде на доске). Для дальнейшего проведения урока класс делится на 5 групп по количеству изучаемых вопросов, капитаны вытягивают вопросы из «МЕШОЧКА ЗАДАНИЙ» для своих групп. Здесь же учащиеся знакомятся с правилами составления опорного конспекта (в алгоритмах указано, что один вопрос готовит вся группа сообща и оформляет его на листе А3, остальные 4 вопроса выполняют в рабочих тетрадях).
3 этап. Презентация.
Изучение нового материала.
При объяснении нового материала учитель читает мини-лекцию, используя электронную презентацию (PowerPoint) .( 5 слайдов презентации– объяснение материала (12 минут), 6 слайд – подача нового материала в уменьшенном виде).
4 Этап. Практика на примерах.
Решение примеров на доске. Одно уравнение решает учитель, другое – ученик под руководством учителя.
5 Этап. Управляемая практика.
Этот этап представлен в виде презентации группами выполненной работы. В процессе защиты проводится демонстрация виртуальных опытов.( Виртуальная лаборатория. 8 класс)
6 этап. Независимая практика.
Выполнение теста «Правильно-неправильно». Закончить уравнения возможных реакций.
После выполнения ученики выполняют взаимопроверку по готовому ключу ответов.
7 этап. Домашняя самостоятельная практика.
Выполнение домашнего задания начинается в классе. Когда звенит звонок, работа прерывается на полуслове ( лучше запоминаются незавершённые действия)
Цели: Познакомить с физическими и химическими свойствами кислот; расширить знания о реакциях замещения и обмена;
воспитывать толерантность;
развивать навыки составления уравнений химических реакций; воспитывать умения работать в группах.
Тип урока: комбинированный.
Формы: Мини-лекция, виртуальный эксперимент, тестирование, решение кроссворда.
Технологии и методы: для проведения урока используются элементы медиа образования и фрагменты технологий: интерактивной, критического мышления, проблемной.
Межпредметные связи: биология, экология, природоведение.
Ход урока:
1 этап. Пропедевтическая практика.
Организационный момент.
Проверка домашнего задания.
Актуализация опорных знаний.
Разгадать кроссворд из озера кроссвордов
.
|
|
|
|
|
|
|
| 1 с | у | л | ь | ф | а | т | н | а | я |
|
|
|
|
|
| 2и | о | д | и | д | н | а | я |
|
|
|
|
|
|
|
|
|
|
|
| 3с | у | л | ь | ф | и | д | н | а | я |
|
|
|
|
|
|
|
|
|
| 4 н | и | т | р | а | т | н | а | я |
|
|
|
|
|
|
|
|
|
|
| 5 к | а | р | б | о | н | а | т | н | а | я |
|
|
|
| 6 ф | о | с | ф | а | т | н | а | я |
|
|
|
|
|
|
|
|
|
|
|
| 7 н | и | т | р | и | т | н | а | я |
|
|
|
|
|
| 8 б | р | о | м | и | д | н | а | я | |
|
|
|
|
|
|
|
| 9 ф | т | о | р | и | д | н | а | я |
|
|
|
|
|
|
|
|
|
|
| 10х | л | о | р | и | д | н | а | я |
|
|
|
|
|
|
|
|
H2SO4
HI
H2S
HNO3
H2CO3
H3PO4
HNO2
HBr
HF
HCl
2 этап. Ориентация

Знакомство с целями урока.
Объединение учеников в 5 групп для изучения нового материала. Капитаны групп вытягивают из «МЕШОЧКА ЗАДАНИЙ» вопросы.


Группа. Действие кислот на индикаторы.
Группа. Взаимодействие кислот с металлами.
Группа. Взаимодействие кислот с оксидами.
Группа. Взаимодействие кислот с основаниями.
Группа. Взаимодействие кислот с солями.
Знакомство с правилами составления опорного конспекта.(Один вопрос готовит вся группа сообща на листе А3, остальные 4 вопроса размещают в рабочей тетради на одном листе)


3 этап. Презентация.
Изучение нового материала.При объяснении нового материала учитель читает мини-лекцию, используя электронную презентацию (PowerPoint) ( 5 слайдов презентации– объяснение материала (12 минут), 6 слайд – подача нового материала в сокращенном виде.
(1 слайд).
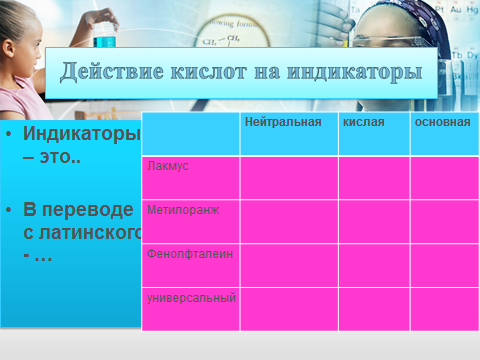
Слово учителя.К материку неорганических соединений причаливают корабли с разными соединениями и возникает необходимость определить, какому соединению в какую страну ехать( демонстрация карты «Материк неорганических соединений»). Для этого существуют индикаторы – вещества, которые изменяют цвет в зависимости от среды. С их помощью можно определять наличие кислот или оснований. Индикатор в переводе с латыни обозначает «показатель». Мы знакомы с 4 индикаторами. 3 могут определять и кислоты и основания: лакмус, метилоранж, универсальный. Фенолфталеином можно определять только основания. Вспомните, как индикаторы изменяют свой цвет в зависимости от среды
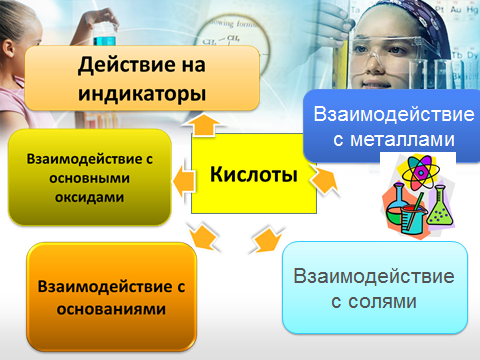
(2 слайд.Взаимодействие кислот с металлами.)
2.1. Понятие о ряде активности металлов. Разведенные кислоты взаимодействуют с металлами, стоящими в ряду активности до водорода, образуя соль и воду.
2.2. Схема реакции: Ме + кислота = соль + водород
2.3. Реакция замещения. Определение. Общая схема: А + ВС = АС + В

(3 слайд.Взаимодействие кислот с оксидами.)
Кислоты взаимодействуют с основными оксидами с образованием соли и воды. С кислотными оксидами кислоты не реагируют. Тип реакции – реакция обмена. Определение и схема реакции обмена.

(4 слайд.Взаимодействие кислот с основаниями).
Жители страны Кислот имеют хорошие отношения с жителями страны Оснований, и со штатом Щелочей, и со штатом Нерастворимых оснований. Кислоты взаимодействуют с основаниями с образованием соли и воды. Тип реакции – обмена. Частный случай реакции обмена – реакция нейтрализации. Определение реакции нейтрализации.

(5 слайд.Взаимодействие кислот с солями.)
Кислоты взаимодействуют с растворами солей, которые образованы более слабыми кислотами, или в случае выпадения осадка.
Сила кислот падает в ряду:
HF, HClO4, HBr, HCl, H2SO4, HNO3, H2SO3, H3PO4, HI, HNO2, H2CO3, H2S, H2SiO3.

(6 слайд.Подача нового материала в сокращённом виде)
.

4 Этап. Практика на примерах.
Решение примеров на доске. Одно уравнение решает учитель, другое – ученик под руководством учителя.
Na + H2SO4=
Mg + HNO3=
CaO + H3PO4
FeO + HCl=
NaOH + H2S=
Cu(OH)2 + HCl=
На доске по очереди работают учитель и ученики.

5 Этап. Руководимая практика.
Групповая работа. Группы защищают свои доклады. В процессе защиты демонстрируются виртуальные опыты. ( Виртуальная химическая лаборатория. 8 класс)
Группа. Действие кислот на индикаторы.
Группа. Взаимодействие кислот с металлами.
Группа. Взаимодействие кислот с оксидами.
Группа. Взаимодействие кислот с основаниями.
Группа. Взаимодействие кислот с солями.





6 этап. Независимая практика.
Выполнение теста «Правильно-неправильно»
Правильный ответ – 1 балл.
Хлоридная кислота взаимодействует с каждым металлом из ряда активности металлов.
Разбавленная сульфатная кислота реагирует с металлами, расположенными в ряду активности до водорода.
Все неорганические кислоты – жидкости.
Кислоты хорошо реагируют с кислотными оксидами.
Кислоты хорошо реагируют с основными оксидами.
Растворимые кислоты изменяют цвет лакмуса на красный.
Растворимые кислоты изменяют цвет индикатора метилоранжа на жёлтый.
Растворимые кислоты не изменяют цвет фенолфталеина.
Кислоты хорошо реагируют с основаниями.
Закончите уравнения возможных реакций ( 3 балла)
1 вариант
Hg + HCl
Fe(OH)2 + H2SO4
NaOH + HNO3
2 вариант
CO2 + H2SO4
Mg + H3PO4
KOH + HCl
Взаимопроверка ответов.
Ключ:
1 вариант
Hg + HCl = нереагирует
Fe(OH)2 + H2SO4= FeSO4 + 2 H2O
NaOH + HNO3= NaNO3 + H2O

2 вариант
CO2 + H2SO4=нереагирует
3Mg + 2H3PO4= Mg3(PO4)2 + 3H2
KOH + HCl= KCl + H2O
7 этап. Домашняя самостоятельная практика. Выучить параграф.
Выполнение домашнего задания начинается в классе, Когда звенит звонок, работа прерываться на полуслове ( лучше запоминаются незавершённые действия)
Заполнить пропуски в схемах реакций и составить уравнения.
LiOH + …. = Li2SO4 + …
Ba + … = BaBr2 + …
…. + HCl = ZnCl2 + …
… + H2SO4 = CuSO4 + …
Осуществить превращения
Cu- CuO - CuCl2

12


 Получите свидетельство
Получите свидетельство Вход
Вход

































 Конспект урока по химии по теме "Физические и химические свойства кислот" (4.51 MB)
Конспект урока по химии по теме "Физические и химические свойства кислот" (4.51 MB)
 0
0 678
678 34
34 Нравится
0
Нравится
0


